Spike-Glykoprotein von SARS-CoV-2
Das Spike-Glykoprotein von SARS-CoV-2 ist eine nach außen ragende Proteinstruktur (Peplomer) des SARS-CoV-2 Virions. Es ist ein transmembranes Glykoprotein auf der Virusoberfläche des SARS-CoV-2 und dient als Ligand zum Andocken an ACE2 auf der Zelloberfläche sowie als fusogenes Protein zum Zelleintritt. Wie bei den anderen Mitgliedern der Coronaviridae bilden die Spike-Gykoproteine die markante und namensgebende (lateinisch Corona ‚Krone‘) Oberflächenstruktur dieser Virionen.
| Spike-Glykoprotein von SARS-CoV-2 | ||
|---|---|---|
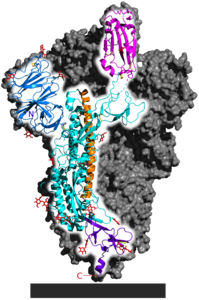 | ||
| Spike-Glykoprotein in der Präfusionsfaltung, nach PDB 6VSB (bestimmt mit Kryo-EM) | ||
| Andere Namen | S-Glykoprotein (SARS-CoV-2) | |
| Masse/Länge Primärstruktur | 1.273 Aminosäuren, 141 kDa[1] | |
| Bezeichner | ||
| Externe IDs | ||

Eigenschaften


Die SARS-CoV-2 Virion bindet mit Hilfe der Spike-Glykoproteine an den ACE2-Rezeptor von Körperzellen, mit denen es verschmilzt und sich darin vermehrt (Wirtszellen).[4]
Bindung und Fusion mit den Wirtszellen
Das Spike-Glykoprotein ist ein homotrimeres Protein[5] und eines der vier strukturellen Proteine des SARS-CoV-2.[6] Es bestimmt den Wirts- und Zelltropismus des SARS-CoV-2.[6][7] Auf der Oberfläche eines Virions befinden sich 15–30 frei rotierbare Homotrimere des Spike-Glykoproteins.[8]Jedes der drei gleichen Monomere besitzt drei interne Disulfidbrücken.[5] Jede der drei gleichen Untereinheiten wird durch Proteolyse von einer Furin-artigen Protease vor der Position 686 in zwei Teile S1 und S2 gespalten, wobei die gespaltenen Teile S1 und S2 aneinander gebunden bleiben. Im Gegensatz zu anderen Coronaviren besitzt die Schnittstelle die Sequenz RRAR, welche die Spaltung erleichtert.[9] Im S1-Bereich liegt nach einem Signalpeptid zunächst die N-terminale Domäne (NTD), gefolgt von der Rezeptorbindungsdomäne (RBD) zum Andocken an die Wirtszelle.[10] Das Signalpeptid enthält 13 Aminosäuren, die spiralförmig und hydrophob (wassermeidend) angeordnet sind.[10] In der NTD liegt die Sequenz GTNGTKR, die vermutlich die Bindung an weitere Membranproteine ermöglicht.[8] N-Glykosylierungen an N165 und N234 stabilisieren die Bindung der RBD an ACE2.[2] N-Glykosylierungen an N61 und N603 führen zu einer erhöhten Zugänglichkeit der Schnittstelle für Proteasen.[8]
S2 wird nach Aufnahme ins Endosom weiter durch TMPRSS2 vor der Position 816 gespalten, wodurch S2' (Position 816 – 1273) entsteht[5] und die Fusionsdomäne aktiviert wird.[7][11] Diese Spaltung wird durch Cathepsin L nichtessentiell unterstützt.[12] Im S2-Bereich liegen das Fusionspeptid (FP) und das interne fusionspeptid (IFP) für die Verschmelzung von Virus- und Zellmembran, zwei Heptad-Repeat-Domänen (HR1 und HR2), eine Transmembrandomäne und zuletzt eine kurze C-terminale Domäne, die im Zytosol liegt.[10] Bei S2' fehlt durch die Spaltung das Fusionspeptid FP.[10] Die Proteine M und E des SARS-CoV-2 modulieren den Proteintransport neugebildeter Spike-Glykoproteine über unterschiedliche Mechanismen.[13] Die Transmembrandomäne ist die zweite hydrophobe Aminosäuresequenz des Spike-Glykoproteins.[10]
Proteinfaltungen

Das Spike-Glykoprotein besitzt drei mögliche Proteinfaltungen: die native Präfusionsform, die Prä-Haarnadelschleifenform und die Postfusions-Haarnadelschleifen-Form.[5] Bei der Membranfusion mit der Wirtszelle bilden Coiled-Coil-Strukturen (mit Heptadenmuster) ein Trimer von Haarnadelschleifen, wodurch das Fusionspeptid in die Nähe des C-terminalen Bereichs der extrazellulären Proteindomäne gebracht wird, woraufhin die Membranfusion mit der Membran der Wirtszelle erfolgt.[5] Durch die Bindung an den Rezeptor wird eine Änderung der Faltung induziert, welche das Fusionspeptid stärker exponiert, wodurch die Membranfusion ausgelöst wird.[16] Das Fusionspeptid besteht aus zwei Teilen an den Positionen 816 – 837 und 835 – 855.[5] Die Transmembrandomäne liegt bei den Aminosäuren 1214 – 1236.[5] Durch die Fusion wird das Virusinnere (englisch core) mit dem viralen Genom ins Zytosol freigesetzt, woraufhin die Translation der viralen Proteine beginnt.[6] Wie viele andere fusogene Proteine führen Spike-Glykoproteine von humanen Coronaviren[17] und auch das von SARS-CoV-2 zur Bildung von Syncytien,[18][19] vermutlich zur Infektion von Nachbarzellen.[10]
Manche SARS-CoV-2-Impfstoffe verwenden als Antigen eine Variante des S-Glykoproteins, die zwei geänderte Proline in der Nähe der Fusionsdomäne aufweist, welche die Proteinfaltung vor der Membranfusion stabilisieren (engl. 2P-prefusion-stabilised). Bei der 2P-Variante wurden zwei Aminosäuren gegen Proline getauscht: an Position 1060 war zuvor ein Valin, an Position 1061 war zuvor ein Leucin.[20] Die 2P-Variante wurde für Coronaviren erstmals beim MERS-CoV beschrieben.[20] Die Analogie der 2P-Variante bei SARS-CoV-2 wurde bestätigt.[21]
Immunologie


Antikörper gegen das Spike-Glykoprotein werden sowohl nach Infektion mit SARS-CoV-2 als auch nach Impfung mit COVID-19-Impfstoffen gebildet. Neutralisierende Antikörper gegen SARS-CoV-2 binden zu einem Anteil von etwa 90 % an die RBD im S1.[16][11] Die monoklonalen Antikörper Bamlanivimab, Casirivimab, Cilgavimab, Etesevimab, Imdevimab, Regdanvimab, Sotrovimab und Tixagevimab binden an die Rezeptorbindungsdomäne (RBD) des Spike-Glykoproteins von SARS-CoV-2. Viele Epitope auf der Oberfläche des Spike-Glykoproteins sind durch umfangreiche Glykosylierungen maskiert.[2] Da die RBD im Vergleich zu anderen Oberflächenstrukturen weniger durch Glykosylierungen maskiert ist, wirkt die RBD vermutlich für neutralisierende Antikörper immundominant.[22] Antikörper-Fluchtmutationen treten vor allem in einem bestimmten Bereich der RBD auf, was ebenfalls auf die Immundominanz der RBD für Antikörper hinweist.[23] Neutralisierende Antikörper gegen das Spike-Glykoprotein werden nach ihren Bindungseigenschaften in 4 Klassen eingeteilt:[24]
- ACE2-blockierende Antikörper, welche die offene Faltungsform des Spike-Glykoproteins binden (Klasse 1)
- ACE2-blockierende Antikörper, welche die offene und die geschlossene Faltungsform des Spike-Glykoproteins binden (Klasse 2)
- Nicht-ACE2-blockierende Antikörper, welche die offene und die geschlossenen Faltungsform der RBD des Spike-Glykoproteins binden (Klasse 3)
- Neutralisierende Antikörper, welche außerhalb der ACE2-Bindungsstelle und nur an die offene Faltungsform binden (Klasse 4)
Die wenigen neutralisierenden Antikörper, welche nicht an die RBD binden, binden meist an die NTD.[16] Sie binden gehäuft an die Positionen 14–20, 140–158 und 245–264.[25]
Es gibt in Mäusen eine Kreuzreaktivität von neutralisierenden Antikörpern gegen das S-Glykoprotein, die sowohl den Zelleintritt von SARS-CoV als auch von SARS-CoV-2 hemmen.[26] Beide SARS-assoziierten Coronaviren (1 und 2) verwenden den gleichen Rezeptor zum Zelleintritt, das Angiotensin-konvertierende Enzym 2 (ACE2), während MERS-CoV die Dipeptidylpeptidase 4 (CD26) verwendet.[27] Die Bindungsfläche zu ACE2 unterscheidet sich zwischen den RBD der Spike-Glykoproteine von SARS-CoV-1 und -2, weshalb nicht alle ihrer neutralisierenden Antikörper kreuzreaktiv sind.[10] S1 ist variabler als S2 in der Aminosäuresequenz, weshalb eher S2-bindende Antikörper kreuzreaktiv sind.[10]
Im Spike-Glykoprotein des SARS-CoV-2 wurden für den Menschen 13 Epitope für MHC I (erzeugen eine zelluläre Immunantwort) und 3 für MHC II (erzeugen eine humorale Immunantwort) identifiziert.[28] Konservierte Epitope wurden im S-Glykoprotein und im Nukleokapsidprotein identifiziert, die sich für breitenwirksame Impfstoffe eignen könnten.[29]
Mutationen
Mutationen des Spike-Glykoproteins von SARS-CoV-2 entstehen bei der Replikation des viralen Genoms. Diese sind überwiegend Mutationen ohne oder mit geringen Fitnesskosten.[16] Daneben werden auch Mutationen beobachtet, die sich stark auf die Aminosäuresequenz des Spike-Glykoproteins auswirken.[16] Diese wirken sich üblicherweise auf die Pathogenität, Infektivität, Übertragbarkeit und/oder Antigenität aus.[16] Einige der Mutationen mit stärkerer Auswirkung sind im Laufe der Covid-19-Pandemie mehrfach und unabhängig voneinander in der Sequenz des Spike-Glykoproteins entstanden.[16]
An der Position 614 – in der Rezeptorbindungsdomäne (RBD) – treten gehäuft nichtsynonyme Mutationen auf, was auf eine stärkere positive Selektion für diese Stelle im Spike-Glykoprotein hindeutet.[16] Die Mutationen D614G, N501Y, E484K-Q, K417N/T und L452R sind mit erhöhter Virusproduktion, erhöhter Übertragbarkeit, geänderter Virulenz und vermutlich auch mit Immunflucht assoziiert.[30][31] Die Mutation D614G vermittelt eine höhere Infektivität und Übertragbarkeit des SARS-CoV-2.[16][32][33] Die Mutation N439K führt zu einer höheren Affinität zum Rezeptor und mindert die Bindung mancher neutralisierender Antikörper.[16] Die Mutation Y453F führt ebenso zu einer größeren Affinität für ACE2.[16] Mutationen an der Position 484 führen zu einer geminderten Bindung durch neutralisierende Antikörper und sind somit Fluchtmutationen,[34] vor allem E484K, E484Q, E484P, E484A, E484D und E484G.[16][35] Ebenso an der Position die Mutationen K444R, K444N, K444Q, V445E und an Position 477 die Mutationen S477G, S477N and S477R.[16] Als weitere Antikörper-Fluchtmutationen an anderen Positionen wurden K417N/T, L452R, Y453F, S477N, und N501Y beschrieben.[36][37][33]
In der NTD wurden die Bereiche 140–156 und 246–260 als Orte für Fluchtmutationen beschrieben, darunter N148S, K150R, K150E, K150T, K150Q und S151P.[16] Die Deletion der Aminosäuren an der Position 69 und 70 – in der NTD – erhöht die Infektivität.[16] In der Omikron-Variante besitzen die Mutationen 478K, E484A, Q493R und N501Y den stärksten Einfluss unter ihren über 30 geänderten Aminosäuren im Spike-Glykoprotein.[38]
Auswirkungen
Das Spike-Glykoprotein trägt zur Pathogenese der Covid-19 Krankheit durch verschiedene Mechanismen bei:
- Die Bindung zum ACE2 Rezeptor kann zur Deregulierung der Funktionen dieses Enzyms in mehreren Organen führen, darunter in den Lungen, den Gefäßen, dem Herz, den Nieren, dem Darm und dem Gehirn. Viele Symptome und Folgen von Covid-19 können durch diese Deregulierung verstanden werden.[39]
- Unter anderen Mechanismen, die zur Deregulierung der Blutgerinnungsmechanismen in den Gefäßen durch SARS-CoV-2 führen können, steht auch der direkte oder indirekte Einfluss des S1-Bereichs des Spike-Glykoproteins auf Rezeptoren und andere Strukturen der Blutgefäße.[40][41]
- Das Spike-Glykoprotein kann sich auch zu anderen Rezeptoren binden und dadurch zur Deregulierung weiterer Funktionen führen.[42]
Verwendung
In Impfstoffen
Alle zugelassenen Impfstoffe enthalten als Antigen das Spike-Glykoprotein oder sein Gen. Oftmals wird die 2P-Variante verwendet, bei der die Proteinfaltung vor der Fusion des Virus mit der Zellmembran stabilisiert wurde. Dies soll dazu dienen, „das theoretische Risiko der Erzeugung infektionsverstärkender Antikörper zu reduzieren“.[43]
In Neutralisation-Assays
Zur Untersuchung von Blutproben auf ihre Neutralisierungsfähigkeit von SARS-CoV-2 werden aufgrund der Gefährlichkeit des Virus häufig statt der eigentlichen Virionen nur pseudotypisierte Viren eingesetzt, dies sind modifizierte („chimäre“) Viren, die das Spike-Glykoprotein von SARS-CoV-2 enthalten.[44][45][46] Es werden hierbei lentivirale Vektoren verwendet, die auch Spikeproteine an der Oberfläche haben, wobei der genetische Code für die (Lentivirus-)Spike-Glykoproteine durch den Code des SARS-CoV-2-Spike ausgetauscht ist.
Literatur
- Zunlong Ke, Joaquin Oton u. a.: Structures and distributions of SARS-CoV-2 spike proteins on intact virions. In: Nature. 588, 2020, S. 498, doi:10.1038/s41586-020-2665-2.
- Bálint Kiss, Zoltán Kis, Bernadett Pályi, Miklós S. Z. Kellermayer: Topography, Spike Dynamics, and Nanomechanics of Individual Native SARS-CoV-2 Virions. In: Nano Letters. 21, 2021, S. 2675, doi:10.1021/acs.nanolett.0c04465.