Fera (II) sulfato
| Fera (II) Sulfato | |||
 | |||
| Plata kemia strukturo de la Fera (II) Sulfato | |||
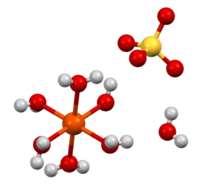 | |||
| Tridimensia strukturo de la Fera (II) Sulfato | |||
 | |||
| Verdaj kristaloj de Fera (II) Sulfato heptahidratigita | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | *7720-78-7 (anhidra)
| ||
| ChemSpider kodo | *22804 (anhidra) | ||
| PubChem-kodo | 9238 | ||
| Merck Index | 15,4084 | ||
| Fizikaj proprecoj | |||
| Aspekto | * blankaj kristaloj (anhidra)
| ||
| Molmaso |
| ||
| Denseco |
| ||
| Fandpunkto | |||
| Refrakta indico | * 1,591 (.H2O)
| ||
| Solvebleco | Etileno-glikolo: 6.4 g/100 ml (20 °C) | ||
| Solvebleco:Akvo: | |||
| Mortiga dozo (LD50) | 237 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Risko | R22 R36/38 | ||
| Sekureco | (S2) S46 | ||
| Pridanĝeraj indikoj | |||
| Danĝero | |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H315, H319 | ||
| GHS Deklaroj pri antaŭgardoj | P264, P280, P302+352, P305+351+338, P332+313, P363 | ||
(25 °C kaj 100 kPa) | |||
Fera (II) Sulfato aŭ feroza sulfato estas gamo da saloj pli konataj pro la hidratoj formitaj. Ĉi-hidratigita formo medicine uzatas por traktato de fera nesufiĉo, kaj ankaŭ en industriaj aplikoj. Konata ekde la antikveco kiel verda vitriolo, la blu-verdeca sephidrato estas la plej ordinara formo de ĉi-substanco. Ĉiuj ferozaj sulfatoj dissolviĝas en akvo por estigi la akvan kompleksaĵon [Fe(H2O)6]2+, kiu posedas oktoedran molekulan geometrion kaj estas paramagneta.
Sintezo
- Per traktado de sulfata acido varmigita kun fera pulvoro:
- Komerce, feroza sulfato estas produktita per oksidigo de la fera pirito:
- Fera (II) sulfato estiĝas en la galvanoplasta procezo per agado de la sulfata acido sur la fera (II) hidroksido:
Reakcioj
- Solvaĵoj de feroza sulfato laŭgrade oksidiĝas al ferika sulfato sub agado de la aera oksigeno:
- Kiam hejtata super 480 °C ĝi malkomponiĝas:
Uzoj
Industrie, la feroza sulfato ĉefe uzatas kiel antaŭaĵo al aliaj feraj komponaĵoj. Ĝi estas reduktagento, kaj estas utila por
reduktigo de la kromato en cementoj al malpli toksaj kromiaj (III) komponaĵoj. Historie, feroza sulfato uzatis en la tekstila industrio dum jarcentoj kiel tinkturo-fiksanto. Historie, ĝi uzatas por malblankigi ledon kaj kiel konstituanto de la inko. Aliaj uzoj estas kiel nutro-aldonaĵoj, kolorigiloj kaj fungicidoj en agrikulturo.
Literaturo
- Chemical Book
- Chemicalland21
- Royal Society of Chemistry
- Encyclopedia.com
- A Manual for the Chemical Analysis of Metals
- Chemistry, John Daintith
- Remington: The Science and Practice of Pharmacy, David B. Troy, Paul Beringer
- Primary Care Medicine: Office Evaluation and Management of the Adult Patient, Allan H. Goroll, Albert G. Mulley
- The International Pharmacopoeia, Volume 1, World Health Organization









