Infarto miocardico acuto
L'infarto miocardico acuto (IMA) è una necrosi dei miociti provocata da ischemia prolungata, susseguente a inadeguata perfusione del miocardio per squilibrio fra richiesta e offerta di ossigeno, spesso secondaria all'occlusione di una coronaria causata da un trombo.[1]
| Infarto miocardico acuto | |
|---|---|
 | |
| Specialità | cardiologia |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 410 |
| ICD-10 | I21 |
| OMIM | 608557 |
| MeSH | D009203 |
| MedlinePlus | 000195 |
| eMedicine | 155919 e 897453 |
Se l'ostruzione coronarica conduce all'arresto totale del flusso sanguigno nel territorio irrorato dall'arteria interessata, provocando nell'ECG un sopraslivellamento del tratto ST, l'infarto è denominato STEMI (ST elevation myocardial infarction).[2] Se invece l'occlusione della coronaria è parziale o transitoria, come evidenziato dalla presenza di sottoslivellamento del tratto ST all'esame elettrocardiografico, l'evento è definito NSTEMI (Non-ST elevation myocardial infarction).[2]
Le patologie cardiovascolari rappresentano la principale causa di morte nelle nazioni industrializzate, ma anche paesi in via di sviluppo come l'India non ne sono esenti.[3][4][5] L'Organizzazione mondiale della sanità ha individuato numerosi fattori di rischio che provocano decessi, perdita di anni di vita in buona salute e aumento delle spese sanitarie in Italia, così come nel resto dell'Europa e del mondo; alcuni dei suddetti elementi di rischio, come ad esempio obesità e sovrappeso, fumo di sigaretta, abuso di alcool, sedentarietà, ipercolesterolemia, ipertensione arteriosa e diabete mellito, sono suscettibili di correzione mediante opportune modifiche dello stile di vita.[3]
Secondo alcuni studi, circa metà dei pazienti colpiti da ischemia miocardica acuta non riescono ad arrivare in ospedale vivi; la percentuale di mortalità si riduce al 10-15% fra coloro che raggiungono i reparti di emergenza.[6] È dunque fondamentale individuare prontamente un dolore toracico di origine cardiaca, al fine di ridurre il tempo di intervento e avviare le terapie idonee quanto prima.[7][8]
Gli approcci terapeutici più utilizzati – dalla trombolisi,[9] all'angioplastica coronarica con impianto di stent, al bypass aorto-coronarico – hanno subìto modifiche e miglioramenti nel corso degli anni. Tutti i pazienti che superano un infarto miocardico dovrebbero essere seguiti dalla medicina riabilitativa con percorsi prestabiliti e personalizzati.[10]
Definizione
La locuzione «infarto miocardico acuto» può essere utilizzata quando vi sia evidenza di necrosi miocardica nell'ambito di un quadro clinico di ischemia. Tale specificazione è contenuta nei vari documenti di consensus[1] elaborati per tentare di raggiungere una definizione universale di infarto miocardico quanto più condivisa. La definizione proposta nel 2007,[11] accettata da tutte le più grandi società internazionali di cardiologia e dall'Organizzazione mondiale della sanità,[12] si delineò in modo più preciso nel 2012.[13]
La definizione completa che riportiamo di seguito, suddivisa nei due casi di infarto «acuto» e «pregresso», fa riferimento al documento sottoscritto nel 2012.[13]
A) I criteri diagnostici per infarto miocardico acuto sono i seguenti:
- riscontro di un aumento dei marcatori biochimici cardiaci, specie la troponina I, unitamente a evidenza di ischemia miocardica associata ad almeno uno dei seguenti fattori:
- sintomi di ischemia;
- variazioni elettrocardiografiche di nuova ischemia con alterazioni del tratto ST (sopra- o sottoslivellamento ST), dell'onda T o comparsa di blocco di branca sinistra;
- presenza di onde Q patologiche all'elettrocardiogramma;
- riscontro con ecocardiogramma di nuove alterazioni della cinetica parietale del ventricolo interessato;
- riscontro di trombo coronarico alla coronarografia o all'autopsia;
- morte cardiaca improvvisa, in genere testimoniata da famigliari o altre persone riferenti la presenza di possibili sintomi di ischemia cardiaca, rilevata angiograficamente o post-mortem (comunque nei casi in cui non sia stato possibile eseguire esami di laboratorio);
- nei pazienti sottoposti a rivascolarizzazione percutanea o in presenza di trombosi dello stent, riscontro di marker di necrosi, quali la troponina, superiori di cinque volte rispetto al 99º percentile del valore massimo di riferimento, nei pazienti con valori di base normali, oppure quando i livelli di troponina aumentano del 20% rispetto ai valori di base nei casi in cui siano già alterati;[14]
- nei pazienti sottoposti a bypass aorto-coronarico in cui si evidenzi la presenza di nuove onde Q, la chiusura del graft venoso o della coronaria nativa, associato comunque all'aumento dei marker (sempre con riferimento alla troponina) di almeno dieci volte rispetto al 99º percentile del valore massimo di riferimento;
- riscontro di nuovo infarto del miocardio.
B) I criteri diagnostici per infarto miocardico pregresso sono i seguenti:
- comparsa di nuove onde Q patologiche all'ECG in presenza o assenza di sintomi;
- evidenza all'ecocardiogramma di un'area assottigliata e con discinesie, in assenza di cause di origine non ischemica;
- riscontro patologico di infarto miocardico in evoluzione o stabilizzato, rinvenuto casualmente.
Epidemiologia
Le malattie cardiovascolari sono uno dei problemi più importanti di salute pubblica; rappresentano la principale causa di morte in Europa, con oltre 4,3 milioni di morti nel 2005. Oltre il 40% di queste sono premature, si verificano prima dei 75 anni (1,8 milioni) e il 54% colpisce il genere femminile. Le forme più comuni di malattia cardiovascolare sono la cardiopatia ischemica e l'ictus, che costituiscono rispettivamente il 22% (1,9 milioni) e il 14% (1,2 milioni) del totale dei decessi. La cardiopatia ischemica è responsabile del 20% di tutte le morti al di sotto dei 75 anni.[3]
L'Organizzazione mondiale della sanità ha individuato fattori di rischio comuni a diverse patologie (malattie cardiovascolari, tumori, diabete mellito, malattie respiratorie croniche, problemi di salute mentale e disturbi muscolo scheletrici) che hanno causato l'86% dei decessi, il 77% della perdita di anni di vita in buona salute e il 75% delle spese sanitarie in Europa e in Italia: tali fattori di rischio sono quelli definiti «modificabili», quali l'obesità e il sovrappeso, il fumo di sigaretta, l'abuso di alcool, lo scarso consumo di frutta e verdura, la sedentarietà, la dislipidemia e l'ipertensione arteriosa.[3] Anche in Italia le malattie cardiovascolari sono la prima causa di morte. L'età aumenta la possibilità di infarto, come anche il sesso maschile: sino a 60 anni i maschi vengono colpiti dall'infarto da due a quattro volte più delle donne. In realtà l'infarto miocardico acuto nella donna presenta delle differenze eziopatogenetiche, anatomiche e di rischio genere-specifici rispetto a quello maschile[15], almeno in fase pre-menopausale. Tale situazione si modifica quando la donna è già in menopausa e il rapporto maschi/femmine supera di poco l'unità.[16]
Nei paesi industrializzati come gli Stati Uniti d'America, le morti per malattie cardiache sono più numerose rispetto alla mortalità per neoplasie.[4] Negli Stati Uniti più di un milione di persone subiscono un attacco anginoso ogni anno e di questi il 40% morirà a causa di infarto.[17] Dati recenti e ottenuti su un numero alto di pazienti, tratti dal Registro Nazionale Americano, hanno considerato più di un milione di casi di infarto, dal 1994 al 2006: gli infarti sono stati trattati sia con fibrinolitico sia con angioplastica primaria, di cui il 42% erano donne, i risultati danno una mortalità del 14% nelle donne e del 10% negli uomini.[18]
Nel Registro Francese, che analizza la mortalità nelle unità di terapia intensiva cardiologica in tutta la Francia registrando i dati per un mese all'anno, nel 1995, cioè in epoca trombolitica, si segnalò una mortalità del 23,7% nelle donne contro il 9,8% negli uomini, però nel report del 2010, quando ormai più dell'80% dei pazienti veniva trattato con la PTCA, si registrò una riduzione della mortalità rispettivamente del 9,8% e del 2,6%.[19]
Anche in Paesi come l'India, le malattie cardiovascolari sono la principale causa di morte.[20] In questo Paese, un terzo dei decessi nel corso dell'anno 2007 erano dovuti a malattie cardiovascolari, un numero destinato ad aumentare entro il 2010.[5][21][22] Dagli anni ottanta si è verificata per entrambi i sessi una lenta e graduale diminuzione della mortalità per questa patologia, probabilmente per la campagna di prevenzione primaria mirata alla riduzione dei fattori di rischio cardiovascolare. A livello mondiale si cerca di costruire un modello comune di comportamento per ridurre l'impatto di tali patologie sulla salute pubblica.[23][24]
Storia
Dagli inizi al 1950
Sin dall'inizio del XIX secolo è noto che una trombosi occlusiva dell'arteria coronaria può portare alla morte.[25][26] Gli esperimenti sugli animali con legatura di un vaso coronarico e i reperti autoptici rilevati hanno suggerito che l'occlusione di una coronaria costituisce un evento irreversibile. Nel 1901 il tedesco Krehl dimostrò che l'infarto non è sempre fatale, ma la prima descrizione dettagliata di attacchi cardiaci non fatali si deve ai russi Obraztsov VP e Strazhesko ND nel 1910.[27] Nel 1912 alcuni autori americani, fra cui James B. Herrick, definirono le prime basi terapeutiche per i pazienti affetti da angina stabile da sforzo: il solo riposo fisico fu riportato come primo approccio terapeutico.[25] Tale indicazione fu l'unica opzione di trattamento sino ai primi anni cinquanta ed era caratterizzata dal riposo assoluto per due settimane con l'obbligo di essere alimentati a letto.

Marey e Willem Einthoven[28] migliorarono, attraverso i loro studi, uno strumento ancora rudimentale e nel 1908 arrivò il primo elettrocardiografo avanzato per migliorare la possibilità di diagnosi di infarto del miocardio.
Nel 1923 Wearn descrisse il decorso clinico di diciannove pazienti con infarto miocardico, a cui furono prescritti riposo assoluto e restrizione nell'assunzione di liquidi; essi ricevettero la digossina[29] contro la congestione polmonare[30][31], la caffeina e la canfora per la prevenzione e il trattamento dell'ipotensione, della sincope e delle aritmie cardiache. Nel 1928 Parkinson e Bedford descrissero la loro esperienza somministrando per il trattamento del dolore la morfina a cento pazienti infartuati, associando dei nitrati per il loro effetto antipertensivo.[28]
Nel 1929 il cardiologo statunitense di origine polacca Samuel A. Levine scrisse il primo libro dedicato esclusivamente al trattamento dell'infarto miocardico, nel quale affrontò, tra le altre cose, l'importanza delle aritmie cardiache e l'uso della chinidina nella tachicardia ventricolare e dell'adrenalina nei blocchi atrioventricolari.[25]
Nel 1950, l'attacco di cuore era già considerato come una causa importante di morte nei paesi industrializzati. A causa del rischio elevato di trombosi e di embolia polmonare per il lungo riposo a letto si riconobbe la necessità della mobilitazione per prevenire il problema della stasi venosa. Vennero inoltre raccomandate assunzione di liquidi e somministrazione regolare di ossigeno.[32]
L'epoca trombolitica
Già nel 1948 venne raccomandato l'uso degli anticoagulanti, come il warfarin, nella prevenzione delle trombosi nei sopravvissuti a un attacco di cuore. Nel 1959 il tedesco Behring-Werke portò sul mercato la streptochinasi che fu utilizzata per la trombolisi nell'infarto miocardico acuto.
Negli anni compresi tra il 1970 e il 1979 furono attivi diversi gruppi di lavoro che utilizzarono la streptochinasi nella trombolisi intracoronarica[33][34]: i risultati dimostrarono che nel 90% dei pazienti con sopraslivellamento del tratto ST si otteneva la dissoluzione del trombo con ricanalizzazione del vaso colpito. Nei primi anni ottanta risultò chiaro come un'infusione endovenosa, preceduta da un'infusione intracoronarica del fibrinolitico, migliorasse e mantenesse la risposta al farmaco.
Fra il 1981 e il 1986 vi furono alcuni gruppi che utilizzarono l'urochinasi intracoronarica[35][36][37], perché più sicura e meno allergizzante della streptochinasi.[9][38][39][40]
Nel 1986, è stato lo studio GISSI il primo trial clinico randomizzato pubblicato sulla trombolisi, che arruolò 11 712 pazienti; si riscontrò una riduzione del tasso di mortalità a ventun giorni dall'evento acuto dal 13% al 10,7%[41]; successivamente il GISSI2 completò lo studio degli outcome non ancora valutati nel primo trial.[42]
Sviluppo della terapia
L'American Heart Association nel 1960 pubblicò i primi risultati dello Framingham Heart Study che per primo mostrò la relazione tra il fumo e l'insorgenza dell'angina pectoris.[43]
Nel settembre 1977 a Zurigo l'angiologo tedesco Andreas Roland Grüntzig introdusse una nuova tecnica che si serviva di un palloncino per dilatare i vasi coronarici stenotici o come opzione terapeutica anche nell'infarto miocardico acuto.[44][45] All'inizio del XXI secolo l'angioplastica coronarica con il posizionamento di stent è divenuta la pratica di cardiologia interventistica più usata nell'approccio all'infarto miocardico acuto nelle terapie intensive di tutto il mondo.
Eziologia
L'infarto miocardico acuto si verifica in pazienti con cardiopatia ischemica nota, precedenti episodi di angina pectoris, o come episodio iniziale della malattia. In genere questo si verifica quando una placca aterosclerotica che si trova all'interno di una coronaria si ulcera e ciò può causare un'ostruzione acuta del vaso interessato.[1] La presenza di aterosclerosi in un vaso sanguigno provoca un restringimento (stenosi) fatto che più facilmente può portare allo sviluppo della trombosi: un coagulo di piastrine, proteine della coagulazione e detriti cellulari. In casi più rari si può trattare di un embolo che è un coagulo di sangue che ha raggiunto un piccolo vaso trasportato dalla corrente sanguigna.
Fattori di rischio
La cardiopatia ischemica e quindi anche l'infarto del miocardio, è strettamente correlata con l'aterosclerosi e i numerosi fattori di rischio cardiovascolare.
- Fattori predisponenti non influenzabili:
- familiarità, età, [46] sesso maschile.[47]
- Fattori di rischio maggiori:[48]
- dislipidemia, in particolar modo un aumento del colesterolo totale e LDL, un aumento dei trigliceridi e una diminuzione nei livelli di HDL; ipertensione arteriosa sistemica;[49] diabete mellito;[49] sindrome metabolica; obesità,[50] bulimia, resistenza all'insulina; tabagismo;[49] stress mentale, fisico e traumatico che induce la stimolazione del sistema adrenergico con aumento dell'aggregazione delle piastrine: un antico meccanismo difensivo che favorisce la trombosi del vaso lesionato allo scopo di ridurre il sanguinamento causato da ferite di animali o combattimenti.[51][52][53][54]
- Fattori di rischio minori:
- iperomocisteinemia > 12 micromoli/L; anticorpi antifosfolipidi; sedentarietà;[49] fattori psicosociali: stress negativo, stato sociale inferiore; pillola anticoncezionale[49] se associata al fumo. Può essere così calcolato uno score di rischio: se sono presenti due fattori maggiori, il rischio di sviluppare una coronaropatia si quadruplica; se sono presenti tre fattori maggiori, il rischio aumenta di dieci volte rispetto alla popolazione non affetta.
- Fattori di rischio in studio:
Infarto giovanile
Nell'infarto al di sotto dei trenta anni possono rilevarsi patologie spesso, ma non sempre, a trasmissione genetica:
- dislipidemia familiare;
- cardiomiopatia ipertrofica;
- sindrome degli anticorpi antifosfolipidi;[58][59]
- ipotiroidismo;
- compressione sistolica delle coronarie da ponte muscolare;
- vasculiti;[60][61]
- origine anomala delle coronarie;
- abuso di sostanze stupefacenti (per esempio cocaina), con effetto dose-indipendente;[62][63]
- sforzi fisici violenti, stress con grandi variazioni della pressione arteriosa;[16]
- ritmi circadiani: il 40% di tutti gli infarti avvengono al mattino tra le 6 e le 12, probabilmente in seguito al picco cortisolico, che in genere diminuisce con l'età.[64]
Cause infrequenti
Nonostante l'aterosclerosi sia alla base della maggior parte degli infarti, esistono determinate condizioni patologiche che portano all'infarto in assenza di placche aterosclerotiche oppure ostruzioni evidenti dei vasi coronarici. Tra queste ne ricordiamo due in particolare: l'angina variante (dovuta a spasmo[65] delle arterie coronarie subepicardiche che, se protratto nel tempo, possono portare a necrosi) e la malattia microvascolare, detta anche sindrome X cardiaca,[66] la cui eziologia e fisiopatologia è molto poco conosciuta; tale sindrome è denominata anche «disfunzione del microcircolo»[67] dal momento che si ritiene sia dovuta a degli squilibri metabolici che portano all'alterazione e conseguente degenerazione delle strutture capillari. Si è parlato inoltre della possibilità infettiva come concausa all'aterosclerosi nell'esordio di alcune forme di necrosi miocardica: tale situazione sarebbe legata alle infezioni croniche di Chlamydia pneumoniae[68][69] e alla parodontite che tende ad aumentare i livelli ematici di proteina C-reattiva, di fibrinogeno e citochine.[70][71]
Patogenesi
Circa il 50% dei pazienti colpiti da infarto muore prima di arrivare in ospedale: la percentuale si riduce al 10-15% nell'insieme dei pazienti che giungono in un reparto di emergenza.[6]
Le alterazioni fisio-patologiche dell'infarto miocardico si evidenziano e si sviluppano in fasi diverse come le complicanze a cui possono dare luogo. Vengono riconosciuti diversi stadi:
- stadio della necrosi: dura all'incirca 48h, le più pericolose poiché possono comparire problemi del ritmo[72] legati alla riperfusione del vaso occluso; per contro, una fibrillazione ventricolare intercorrente da una a quattro settimane dopo l'infarto peggiora la prognosi. L'insufficienza cardiaca può essere presente fin in 1/3 dei pazienti.
- stadio della cicatrizzazione (30-50 giorni): potrebbero definirsi degli aneurismi ventricolari nel 20% con tromboembolia, pericardite, sindrome di Dressler da una a sei settimane dopo l'infarto.
- stadio della riabilitazione: mobilizzazione precoce,[73] educazione igienico-dietetica, controllo dell'ansia.
- stadio della prevenzione delle recidive infartuali: abolizione del fumo, ottimizzazione della terapia diabetica e miglioramento del profilo lipidico, controllo della pressione arteriosa. L'introduzione della dieta mediterranea controlla e diminuisce la mortalità del 40-50% secondo quanto rilevato da numerosi studi.[74][75][76][77][78]
Al contrario la mortalità intra-ospedaliera e a lungo termine[79] è aumentata proporzionalmente all'aumento dei casi di insufficienza cardiaca: ciò è susseguente a un numero maggiore di angioplastiche, che portano a una riduzione di mortalità totale, ma in egual misura aumenteranno i pazienti sopravvissuti a un insulto ischemico con sempre più anziani con comorbilità, e un relativo aumento di scompenso cardiaco, legato alle situazioni con infarti miocardici estesi.
Comunque i risultati delle ricanalizzazioni nel post-infarto conducono a un naturale rimodellamento del lume dell'arteria trattata, vista la presenza dello stent, che possono portare alla riocclusione.[80] Nel contempo, la perdita più o meno importante di miociti porterà a un processo analogo, che oltre al riassestamento delle fibre condurrà al rimaneggiamento del sistema neuroendocrino necessario al mantenimento dell'omeostasi del sistema cardiocircolatorio. Durante la fase di rigenerazione le cellule colpite dall'ischemia andranno incontro ad apoptosi, ma verranno sostituite da altre[81] che, attraverso il torrente circolatorio, giungeranno nella zona peri-lesione per ricostruire dal tessuto connettivo a nuovi vasi (neoangiogenesi).[82] Il rimaneggiamento riguarderà anche il tessuto di conduzione in tutta la sua estensione.[83]
Complicanze
Nelle prime 48 ore vi è un'alta probabilità di aritmie da riperfusione, generalmente ventricolari.[84][85] Abbiamo già trattato dell'insufficienza cardiaca, che può evolvere in edema polmonare acuto e nel più pericoloso shock cardiogeno che ha un tasso di mortalità dell'80-90%: è una situazione legata a infarti massicci, ove è colpito oltre il 40% del muscolo cardiaco.[86] Altra temibile complicanza è la rottura della parete laterale del cuore, che porta alla morte in pochi secondi.[87] Ricordiamo l'embolia da frammentazione del trombo coronarico, le trombosi venose profonde da allettamento, l'embolia polmonare da possibile trombo apicale.[88] La pericardite e le recidive ischemiche sono sempre da tener presenti, come le aritmie sopraventricolari (fibrillazione atriale e flutter atriale).
Complicanze aritmiche
Le aritmie possono influire gravemente sul decorso poiché: peggiorano la funzione di pompa del cuore, aumentano l'estensione della necrosi, sia per aumento del consumo di ossigeno sia per la peggiore perfusione coronarica, evolvono verso forme aritmiche maggiori, come la fibrillazione ventricolare.
Si possono instaurare:[89]
- aritmie ipercinetiche ventricolari:
- extrasistoli ventricolari, associate ad aumentato rischio di sviluppare tachiaritmie gravi;
- tachicardia ventricolare, per il rischio di degenerare in fibrillazione ventricolare;
- ritmo idioventricolare, ben tollerato, non comporta aumento significativo del rischio di aritmie gravi;
- fibrillazione ventricolare, principale causa di morte precoce nei pazienti con infarto miocardico acuto;
- aritmie ipercinetiche sopraventricolari;
- aritmie ipocinetiche:
- bradicardia sinusale, può essere spia di un'ischemia del nodo seno-atriale;
- blocchi atrioventricolari, la prognosi è solitamennte favorevole.
Anatomia patologica
Dal punto di vista anatomo-patologico, la necrosi delle cellule miocardiche viene classificata come necrosi coagulativa o necrosi a bande di contrazione, la cui evoluzione è in genere determinata da un processo oncotico e da meccanismi apoptotici: tale differenza può essere rilevata da un'analisi delle sezioni istologiche da parte di personale altamente qualificato.[1]
Dopo l'insorgenza di ischemia la necrosi non è immediatamente evidente, ma richiede tempo per svilupparsi (almeno venti minuti in alcuni modelli animali).[90] Sono necessarie diverse ore prima che la necrosi si possa evidenziare all'esame macroscopico o microscopico, infatti può completarsi nelle cellule a rischio in circa due-quattro ore, se non oltre, e ciò può essere condizionato dalla presenza di circoli collaterali, dall'occlusione coronarica persistente o intermittente nonché del fabbisogno individuale di ossigeno e nutrienti.[11] Se valutiamo l'infarto in base alla localizzazione e alle dimensioni potremmo definirlo in:[13]
- microscopiche, come nella necrosi focale;
- piccole, se è interessato meno del 10% della massa ventricolare sinistra;
- medie, se la massa ventricolare sale dal 10 al 30%;
- grandi, se l'interessamento supera il 30%.
Se analizziamo il profilo anatomo-patologico dovremmo valutare il quadro anche sotto il profilo temporale: infarto in evoluzione (< alle sei ore), acuto (dalle sei ore ai sette giorni), in via di cicatrizzazione (dai sette ai ventotto giorni) e stabilizzato (dai ventinove giorni in poi).[11]
Il quadro acuto è caratterizzato da infiltrati di leucociti polimorfonucleati (granulociti neutrofili, granulociti eosinofili, granulociti basofili); nella fase successiva compaiono cellule mononucleate (macrofagi) e fibroblasti. L'infarto stabilizzato presenta una cicatrice priva di infiltrati cellulari: tutto il processo può durare all'incirca dalle cinque alle sei settimane.[11]
È importante sottolineare che, in termini temporali, il riscontro clinico ed elettrocardiografico dello stadio della necrosi può non coincidere con il rilievo anatomo-patologico: ad esempio, se dal punto di vista anatomo-patologico l'infarto è già nella fase di cicatrizzazione, potrebbero essere evidenziate sia sottoslivellamento del tratto ST sia inversione con negativizzazione dell'onda T sia elevati valori dei marcatori di necrosi come nell'infarto acuto.[11]
Clinica
Classificazione

L'infarto acuto del miocardio ricade nel gruppo delle sindromi coronariche acute, che si differenziano a seconda della presentazione all'elettrocardiogramma in infarto del miocardio con sopraslivellamento del tratto "ST" (o STEMI: ST Elevation Myocardial Infarction) e infarto miocardico senza sopraslivellamento del tratto "ST" (o NSTEMI: Non-ST Elevation Myocardial Infarction).[2]
La valutazione laboratoristica dell'IMA viene definita dall'aumento di alcune sostanze nel sangue o enzimi miocardio specifici. Sino alla fine degli anni novanta venivano presi in considerazione il CPK totale, il CK-MB e le LDH, in seguito sostituiti dalla troponina I, che è un esame molto più sensibile dei precedenti, tanto da essere usato per la diagnosi differenziale nel dolore toracico dubbio. Alcuni pazienti con infarto miocardico, ma non tutti, sviluppano onde Q di necrosi; i pazienti in cui non vi sono aumenti significativi di troponina potrebbero essere affetti da angina instabile.[2]
Vengono riconosciute alcune ulteriori categorie di infarto.
- Tipo 1: infarto miocardico spontaneo correlato a un evento coronarico primario, come nel caso di erosione e/o rottura, fissurazione o dissezione della placca con conseguente trombosi endoluminale.[13][14]
- Tipo 2: infarto miocardico secondario a uno squilibrio tra richiesta e offerta di ossigeno, come nel caso di spasmo coronarico, embolizzazione coronarica, anemia, aritmie, insufficienza respiratoria, ipertensione arteriosa o ipotensione marcata.[13][14]
- Tipo 3: morte cardiaca improvvisa e inattesa, con arresto cardiaco, spesso accompagnata da sintomi suggestivi di ischemia miocardica, associata a nuovo sopraslivellamento del tratto ST, o riscontro di blocco di branca sinistra non noto o riscontro angiografico e/o autoptico di recente trombosi coronarica. In ogni caso, morte verificatasi prima di qualsiasi riscontro laboratoristico documentabile con il prelievo di sangue basale.[13]
- Tipo 4a: infarto miocardico correlato a intervento coronarico percutaneo (angioplastica coronarica con posizionamento di stent).[13]
- Tipo 4b: infarto miocardico associato a riscontro angiografico o autoptico di trombosi dello stent.[13]
- Tipo 5: infarto miocardico correlato a intervento di bypass aorto-coronarico.[13]
Segni e sintomi
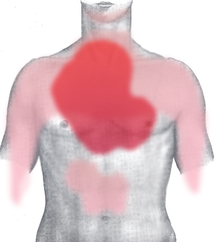

Il dolore, ove presente, è tipicamente localizzato nella regione dietro allo sterno, cioè al centro del torace: tende a irradiarsi tipicamente verso la spalla e all'arto superiore sinistro, benché sia possibile l'irradiazione cervicale o alla scapola sinistra. Nel caso di infarto miocardico di tipo inferiore (o «diaframmatico») il dolore insorge all'epigastrio e può essere confuso con un dolore all'addome o allo stomaco. Queste sono le sedi più tipiche di irradiazione del dolore toracico di origine cardiaca, ma ve ne sono molte altre, meno frequenti, come l'irradiazione alla mandibola, ai gomiti e ai polsi.[91]
Il dolore è in genere molto forte, di tipo costrittivo o urente, mai trafittivo o puntorio, sovente accompagnato da sudorazione algida e a un senso imminente di morte (angor animi). Sintomi minori, ma quasi sempre presenti: profonda astenia, nausea e talora vomito. Differentemente dall'angina stabile, che dura al massimo 10-15 minuti, il dolore provocato dall'infarto miocardico dura più di 30-40 minuti e non è alleviato né dal riposo, né dall'assunzione di farmaci come l'isosorbide dinitrato o la trinitrina.[91]
Spesso si riscontrano ipertensione e tachicardia in corso di infarto anteriore o laterale e un'ipotensione associata a bradicardia in quelli inferiori, per l'influenza dell'innervazione vagale della parete diaframmatica.[92]
In presenza di segni di insufficienza cardiaca o di scompenso (1/3 dei pazienti), il soggetto lamenta dispnea e si evidenziano rantoli alle basi polmonari, eventualmente edema polmonare acuto, se l'infarto è molto esteso e quasi sempre a localizzazione anteriore. Nei pazienti più anziani possono presentarsi segni di ipossia cerebrale associati a disorientamento e confusione mentale.[93]
All'auscultazione del cuore, un soffio meso-telesistolico può identificare un'insufficienza mitralica acuta dovuta a ischemia o necrosi dei muscoli papillari. Sfregamenti pericardici possono essere presenti nei giorni seguenti, in caso di necrosi subepicardica estesa e conseguente pericardite epistenocardica.[94][95]
Esami strumentali e di laboratorio
La presenza di alcune proteine rilasciate nel sangue dai miociti danneggiati dall'ischemia possono confermare la presenza di infarto miocardico; le più utilizzate nei laboratori di analisi sono la mioglobina, la troponina T e I, la CPK e la CK-MB, la LDH.[96]
| Inizio (h) | Picco (h) | Normalizzazione (g) | |
|---|---|---|---|
| Troponina I | 4-8 | 24-48 | 10-15 |
| CK-MB | 4-8 | 12-18 | 2-3 |
| CPK totali | 4-8 | 16-36 | 3-6 |
| GOT | 4-8 | 16-48 | 3-6 |
| LDH | 6-12 | 24-60 | 7-15 |
Questi marcatori biochimici riflettono la presenza di necrosi miocardica senza però indicarne il meccanismo responsabile, perciò un aumento delle troponine in assenza di evidenza clinica di ischemia cardiaca deve portare a ricercare altre cause quali miocardite, embolia polmonare, scompenso cardiaco, dissecazione aortica, insufficienza renale o altre ancora, diverse dalla cardiopatia ischemica conclamata:[96]
- contusione miocardica o altro trauma cardiaco;
- cardiomiopatia ipertrofica;
- aritmie cardiache;
- sindrome tako-tsubo;
- rabdomiolisi con interessamento cardiaco;
- ictus ed emorragia subaracnoidea;
- malattie infiltrative come l'amiloidosi, l'emocromatosi, la sarcoidosi e la sclerodermia;
- endocardite, pericardite con coinvolgimento del miocardio;
- tossicità da farmaci o tossine;
- insufficienza respiratoria o sepsi;
- ustioni interessanti oltre il 30% della superficie corporea;
- attività fisica con sforzo estremo.
Nelle Unità di terapia intensiva cardiologica (UTIC) vengono utilizzate le troponine e il CK-MB.
- Elevazione dei marcatori di necrosi cardiaca
- Confronto dei valori degli enzimi cardiaci nella prima ora dall'inizio dei sintomi e le relative concentrazioni
- Confronto dei valori degli enzimi cardiaci nella prima ora dall'inizio dei sintomi e le variazioni dei cutoff
- Cinetica dei marker cardiaci nell'infarto miocardico con e senza il trattamento di riperfusione
Elettrocardiogramma


L'ECG nelle prime 24 ore dopo un infarto può essere completamente silente. Esso comunque contribuisce a fornire indicazioni sulla sede e l'estensione dell'infarto.

Segni elettrocardiografici di infarto NSTEMI sono il sottoslivellamento del tratto ST presente nelle derivazioni interessate dalla sub-occlusione della coronaria responsabile.
Segni elettrocardiografici diretti d'infarto in corso STEMI sono il sopraslivellamento del tratto ST dovuto all'onda di lesione, onda T en dôme o «onda di Pardee» (vecchia dizione in disuso), nelle aree interessate dall'ischemia, con coinvolgimento dell'onda T, secondari all'occlusione della coronaria interessata. Un blocco di branca sinistra (BBS) preesistente potrebbe mascherare le modificazioni dell'ECG, fatta salva la presenza di sintomatologia tipica.
Ecocardiogramma

La metodica dell'ecocardiografia nacque nel 1953 con i primi apparecchi chiamati «reflettoscopi»[97], ma entrò nella pratica clinica soltanto tra il 1971 e il 1977 con gli apparecchi M-Mode (dove M sta per monodimensionale).[98] L'ecografia Doppler e bidimensionale si svilupparono dal 1978 al 1984[97] ed entrarono a far parte integrante delle valutazioni dell'emergenza cardiologica.
I pronto soccorso sono dotati di un ecocardiografo per una valutazione primaria della cinetica ventricolare sinistra[99].
Il controllo e l'evoluzione della funzione miocardica sono in genere seguiti durante la degenza in ospedale da personale altamente qualificato[100] e sempre più spesso in sala operatoria durante un intervento di bypass aorto-coronarico[101].
È l'esame più utilizzato insieme all'elettrocardiogramma nella diagnosi differenziale del dolore toracico acuto: eventuali modifiche nella cinetica delle pareti dei ventricoli cardiaci, sono la conferma della presenza di problemi ischemici nelle aree in cui il movimento è alterato.[98]
Diagnosi differenziale
Il sintomo principale di una crisi ischemica è il dolore; se ci riferiamo al dolore toracico abbiamo una discreta possibilità che possa non essere di origine cardiaca, per tale motivo in qualsiasi pronto soccorso vi sono già dei percorsi prestabiliti e condivisi, che permettono di arrivare a una diagnosi nel più breve tempo possibile.[102] Nel frattempo dobbiamo tener presente una serie di altre patologie che hanno in comune il dolore toracico:[91]
- pleurite, il dolore è trafittivo e in genere modificato dal respiro e dalla posizione.[91]
- pericardite, è forse il dolore più simile a quello dell'infarto, ma è continuo, accompagnato spesso da sfregamenti, si riduce in posizione seduta e mostra un'alterazione all'ECG, spesso caratterizzata da un sopraslivellamento di ST-T diffuso. Gli enzimi sono negativi, tranne nei casi in cui non vi sia un coinvolgimento del miocardio.[91]
- costocondrite, le articolazioni sternali risultano dolenti spontaneamente e alla palpazione.[91]
- esofagite da reflusso, dolore retrosternale, in genere più localizzato in epigastrio, che risponde agli antiacidi e mostrano un ECG e un ecocardiogramma nella norma.[91]
- ulcera gastrica, il dolore è epigastrico, ma si allevia con gli antiacidici e gli inibitori di pompa protonica.[103]
- pneumotorace, il dolore è acuto, improvviso, localizzato a un emitorace e accompagnato da dispnea improvvisa, la radiografia del torace è dirimente.[103]
- embolia polmonare, rappresenta una diagnosi differenziale[103] difficile infatti il dolore può essere intenso, retrosternale accompagnato da una dispnea, spesso improvvisa, senza sintomi di congestione polmonare, tipici invece dell'infarto scompensato. L'ecocardiogramma e maggiormente un'angio-TAC (tomografia assiale computerizzata) con mezzo di contrasto sono gli esami guida in questi casi.
- aneurisma dell'aorta toracica dissecante, è forse l'evento più drammatico che un individuo possa sperimentare e nel contempo una diagnosi differenziale più difficile e ingannevole per il medico che debba porre diagnosi. Il sospetto va posto in presenza di un dolore improvviso, profondo e irradiato in diverse sedi (torace, scapola, mandibola, arti superiori); la presenza di un soffio diastolico aortico facilita di molto la diagnosi, ma è di difficile auscultazione; l'ecotransesofageo è diagnostico, dove non sia possibile l'esame principe, la risonanza magnetica nucleare.[103]
- colecistite acuta e pancreatite acuta, presentano sintomi simili all'infarto diaframmatico, ma la negatività dell'ECG, degli enzimi miocardiospecifici e la positività di una TAC e/o eco-addome dileguano i dubbi.[104]
- herpes zoster, non rappresenta un problema dopo l'eruzione vescicolo-bollosa, ma in taluni casi, specie nei pazienti anziani, può porre dei dubbi a seconda del metamero colpito.[104]
Diagnosi precoce
Per diagnosi precoce si potrebbe intendere la velocità con cui si giunge a una diagnosi, in realtà il tutto dipende dal tempo di arrivo in ospedale, il cosiddetto «ritardo evitabile»[7][8] poiché la fase extra-ospedaliera di individuazione del problema dovrebbe essere la più breve possibile: ogni sintomo che indichi l'inizio di un infarto impone la consultazione di un medico nel più breve tempo possibile.
Esistono dei numeri telefonici per l'emergenza sanitaria in tutto il mondo (per esempio in Italia è il 112 o il 118, in Canada, Stati Uniti d'America, Paraguay e Uruguay è il 911[105], in Inghilterra è il 999 e così via per le altre nazioni), quindi è consigliabile chiamare prontamente un'ambulanza con personale medico a bordo per raggiungere velocemente il pronto soccorso dell'ospedale più vicino; nel frattempo si possono avviare già delle terapie ed effettuare il primo elettrocardiogramma durante il tragitto in presenza del personale specializzato.[106]
Potremmo dire che se si è in grado di riconoscere i sintomi dell'angina e dell'infarto, avremo una possibilità in più di salvare la vita a sé stessi e agli altri,[107] se invece non li dovessimo nemmeno sospettare, ma li confondessimo con un'indigestione, un dolore osseo o simili, il trattamento dell'infarto arriverebbe troppo tardi con le conseguenze negative di una riperfusione tardiva.
Risvolti psicologici
I fattori psicologici hanno un'influenza non solo sul benessere generale del paziente, ma anche sul decorso della malattia, la cui prognosi può essere influenzata da atteggiamenti mentali negativi.[108] Un evento cardiovascolare acuto non è solo una malattia importante, ma colpisce la persona nella sua totalità: un infarto mette a prova l'equilibrio psichico del paziente, che dopo l'evento può non sentirsi più lo stesso. Una volta dimesso deve reintegrarsi nella famiglia e nella società e anche nel mondo del lavoro, ma tutto ciò può essere visto e vissuto in modo totalmente distorto.[108][109]
La depressione è un fattore prognostico sfavorevole dopo un infarto miocardico acuto, perciò diversi studi si sono occupati di tale problema[110], in particolare vi sono state delle associazioni positive fra l'induzione di ischemia in pazienti sottoposti a imaging di perfusione miocardica a riposo, dopo stress mentale, che non si sono poi ripresentate dopo l'esercizio fisico o lo stress farmacologico.[111] Questi risultati hanno una notevole importanza per la salute pubblica e la medicina in generale; infatti la depressione colpisce circa il 20% degli uomini infartuati e il 40% delle donne di età inferiore ai 60 anni.[111] A differenza dell'ischemia indotta da stress fisico, l'ischemia innescata dallo stress mentale è per lo più silente e non associata ad alterazioni elettrocardiografiche, così che può non essere riconosciuta agevolmente.[111]
Trattamento
Trattamento farmacologico
Si considerano un trattamento pre-ospedaliero e uno ospedaliero:
- la terapia preospedaliera di un sospetto infarto si basa principalmente sulla sedazione del dolore con la morfina cloridrato[112]; controllo dei valori di pressione e vasodilatazione coronarica con i nitrati[113] sotto forma sublinguale, come l'isosorbide dinitrato o la nitroglicerina[114] ripetibili; l'aspirina[115] viene utilizzata in dosi che vanno dai 300 ai 500 mg per il suo effetto antiaggregante piastrinico; l'ossigeno viene somministrato in maschera o in sonda nasale a 4 L/min al fine di mantenere la SpO2 > 90%.[116]
- trattamento ospedaliero: è fondamentale riaprire il vaso nel più breve tempo possibile attraverso l'uso del fibrinolitico[117], se non vi è la possibilità di una coronarografia nei primi novanta minuti dall'occlusione acuta, oppure con l'angioplastica, se vi è un servizio di emodinamica vicino all'ospedale che fa il ricovero. La terapia comprende inoltre farmaci per la prevenzione di nuove trombosi: ASA, eparina[118], UFH endovena o meglio eparine a basso peso molecolare[119], inibitori della glicoproteina IIb-IIIa.[116][120]
Ovviamente si assoceranno i farmaci che trattano le singole patologie implicate nell'eziologia come l'ipertensione e l'ipercolesterolemia[116]: i betabloccanti[121], gli ace-inibitori[122], i calcio-antagonisti[123] e le statine[124], se non sono già in corso al momento del ricovero, in aggiunta i diuretici[125] se comparisse insufficienza cardiaca.[126][127]
Un discorso a parte per la doppia antiaggregazione[128] necessaria nei pazienti trattati con l'impianto di stent coronarico metallico (Bar Metal Stent) o di stent coronarico a rilascio di farmaco (Drug eluting stent): i farmaci che si associano all'aspirina sono il clopidogrel (Plavix)[129], il ticagrelor (Brilique)[130] e il prasugrel (Efient)[131] per un tempo non inferiore ai dodici mesi.[132][133][134]
Successivamente si passerà alla mono-somministrazione del solo acido acetilsalicilico, tranne nei casi in cui si riscontri intolleranza e il farmaco in tal caso sarà sostituito dalla ticlopidina.[116][135]
Cardiologia interventistica

Il 16 settembre 1977 Andreas Roland Grüntzig, per la prima volta nella storia della cardiologia, dilatò una stenosi critica prossimale sull'interventricolare anteriore per via percutanea, inserendo un catetere a palloncino dall'arteria femorale. Quello fu il giorno della nascita di una nuova branca dell'emodinamica: la cardiologia interventistica. Si calcola che dal 1986 in poi l'intervento di rivascolarizzazione percutanea o PTCA (acronimo di Percutaneous transluminal coronary angioplasty), in italiano angioplastica coronarica, con o senza l'impiego di stent, sia ormai la terapia di prima scelta nel trattamento dell'infarto acuto: solo negli Stati Uniti nel 1999 si raggiunsero un milione di procedure con un rapporto di circa 2:1 rispetto alle rivascolarizzazioni chirurgiche.[136] Tale metodica non è ovviamente priva di complicanze, la più temuta è sicuramente l'occlusione precoce dello stent da trombosi dello stesso. A distanza, anche di alcuni mesi, è possibile la re-stenosi: questo è ben riportato nello studio ACUITY pubblicato nel maggio del 2012.[137][138][139] In associazione all'angioplastica la tromboaspirazione è la tecnica che permette di aspirare il trombo, ossia il materiale che ha causato l'ostruzione dell'arteria. Tale metodica è spesso utilizzata nell'infarto STEMI.[136][140]
Possiamo considerare in questo paragrafo anche le procedure correttive in caso di alterazioni del sistema di conduzione cardiaco secondarie all'ischemia: in pratica il posizionamento di pacemaker e defibrillatore cardiaco impiantabile, rispettivamente in corso di blocchi atrioventricolari avanzati e nei casi di tachicardie ventricolari in genere secondarie alla cardiomiopatia ischemica.
Trattamento chirurgico

Qualora la terapia medica associata o meno all'angioplastica abbia fallito, o ci trovassimo con una patologia vasale che non permettesse l'approccio medico, si deve ricorrere al trattamento chirurgico.[141] Chirurgicamente si rivascolarizza la coronaria responsabile dell'infarto a valle dell'ostruzione così da interrompere l'ischemia, contenere l'area di necrosi, migliorare la funzione di pompa del miocardio colpito e aumentare la sopravvivenza; vi sono comunque studi che hanno valutato l'approccio conservativo[142], che a un anno dall'intervento non avrebbero confermato differenze fra i due trattamenti.[136]È indicato in pazienti con controindicazioni alla trombolisi e all'angioplastica e con anatomia favorevole più alla chirurgia, pazienti in cui la PTCA è fallita con persistenza di dolore e/o presenza di instabilità emodinamica, angina persistente o ricorrente refrattaria alla terapia medica con controindicazioni alla PCI. Altra indicazione è lo shock cardiogeno[143] con anatomia coronarica non suscettibile di PTCA ma favorevole al bypass entro sei ore dall'insorgenza dell'infarto. Può essere indicato se presente una complicanza meccanica con instabilità emodinamica (rottura di un muscolo papillare, perforazione del setto interventricolare).[144]
Prognosi
Postumi e follow up
Nel post-infarto la sensibilità barorecettoriale può essere temporaneamente compromessa e la sua valutazione rappresenta un ottimo indice prognostico: i pazienti con marcata riduzione hanno un aumentato rischio di fibrillazione ventricolare.[145][146] Tale valutazioni faranno parte di un controllo seriato di tutti i parametri interessati nella fase di follow-up, che segue delle indicazioni ben precise e dei percorsi clinici-strumentali condivisi dalla comunità cardiologica internazionale. Saranno molto utili delle pubblicazioni che verranno consegnate a tutti gli infartuati al momento della dimissione.[147]
Riabilitazione e prevenzione secondaria
La medicina riabilitativa è strettamente raccomandata per i pazienti post-infartuati dopo stabilizzazione clinica.[148] Evidenze scientifiche di tipo A dimostrano miglioramento della tolleranza allo sforzo con innalzamento della soglia ischemica e riduzione dei sintomi, mentre evidenze di tipo B sottolineano miglioramenti del profilo di rischio cardiovascolare, dello stile di vita e del benessere psicosociale nonché una riduzione della mortalità, attribuibile solo in parte all'esercizio fisico.[149]

Queste evidenze hanno portato, nel corso degli anni, alla definizione di linee guida da parte delle associazioni cardiologiche di tutto il mondo e anche in Italia, da parte dell'Istituto superiore di sanità[150], le quali suggeriscono programmi di mobilizzazione precoce e di educazione alla salute seguito, alla dimissione dal reparto, da un programma di training fisico e da un supporto per le modificazioni dello stile di vita.[148][151]
Ottimizzare la terapia, informare il paziente e migliorare l'aderenza alle prescrizioni farmacologiche rappresentano il primo passo.[108] La prevenzione secondaria sarà rivolta alla riduzione dei fattori di rischio modificabili.[152] In Italia il Progetto cuore ha predisposto delle Carte del rischio cardiovascolare generale e un Calcolo del punteggio individuale di facile consultazione e compilazione.[153][154]
Il training fisico sarà impostato sulla base della valutazione funzionale del paziente, solitamente effettuata tramite un test da sforzo al cicloergometro o al treadmill circa 2-3 settimane dopo l'evento acuto.[148] Il test ergospirometrico, con valutazione della soglia anaerobica e del picco di VO2 (termine noto anche come massimo consumo di ossigeno), potrebbe essere limitato a quei pazienti con disfunzione del ventricolo sinistro.[155] In tutti i pazienti le controindicazioni all'allenamento fisico dovranno essere valutate e i programmi di attività, solitamente basati su programmi di endurance traning o di interval training (simili allo Steady State Training, traducibile in Allenamento in stato costante o Allenamento continuo), dovranno essere individualizzati in termini di modalità, frequenza e intensità.[150][156] Un buon programma riabilitativo prevede il proseguimento di un training autogestito per tutta la vita[148], per mantenere i risultati ottenuti (valutabili con un ulteriore test da sforzo alla fine del trattamento sotto osservazione) e scongiurare il rischio di reinfarto.[10]
Note
Bibliografia
- Ettore Bartoli, Medicina Interna: Metodologia, Semeiotica, Fisiopatologia, Clinica, Terapia Medica, Genova, Restless Architect of Human Possibilities sas (R.A.H.P.sas), 2010, ISBN 978-88-904381-1-0.
- Eugene Braunwald, Malattie del cuore, 7ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2987-3.
- Vincenzo Ceci, La riabilitazione nel post infarto, 1ª ed., Chiesi Library in Cardiology, 1989, ISBN non esistente.
- Silvio Fiocca et al., Fondamenti di anatomia e fisiologia umana, 2ª ed., Napoli, Sorbona, 2000, pp. 189-277, ISBN 978-88-7150-024-9.
- Frances Fischbach, Dunning III, Marshall B., A Manual of Laboratory and Diagnostic test, 8ª ed., Filadelfia, Lippincott Williams & Wilkins, maggio 2009, p. 1344, ISBN non esistente.
- William F. Ganong et al., Fisiologia medica, Padova, Piccin, 2011, ISBN 978-88-299-2113-3.
- Philippe Gorny, Storia illustrata della cardiologia dalla preistoria ai giorni nostri, Milano, Editiemme, 1988, ISBN non esistente.
- Brian P. Griffin, Eric J. Topol, Malattie del Cuore, Filadelfia, Lippincott Williams & Wilkins, 2010, ISBN non esistente.
- Tinsley Randolph Harrison, Malattie del sistema cardiovascolare, in Principi di medicina interna, vol. 2, 16ª ed., Mc Graw Hill, 2005, ISBN 88-386-2999-4.
- Mirko D. Grmek, Storia del pensiero medico occidentale, Milano, Laterza, 2007, ISBN 978-88-420-8403-7.
- John Willis Hurst, Il cuore, 12ª ed., Milano, McGraw-Hill, 2009, ISBN 978-88-386-3943-2.
- Lionel H. Opie, Gersh Bernard J., Farmaci per il cuore, 8ª ed., Milano, Edra, 2014, ISBN 978-88-214-3768-7.
- Patrizia Presbitero, Il cuore della donna, Milano, One Global Medicine, 2014, ISBN 978-88-904646-4-5.
- Bruno Trimarco et al., Cardiologia, Napoli, Idelson Gnocchi, 2013, ISBN 978-88-7947-568-6.
Voci correlate
Altri progetti
 Wikiquote contiene citazioni sull'infarto del miocardio
Wikiquote contiene citazioni sull'infarto del miocardio Wikiversità contiene risorse sull'infarto del miocardio
Wikiversità contiene risorse sull'infarto del miocardio Wikimedia Commons contiene immagini o altri file sull'infarto del miocardio
Wikimedia Commons contiene immagini o altri file sull'infarto del miocardio
Collegamenti esterni
| Controllo di autorità | LCCN (EN) sh85059683 · GND (DE) 4024654-1 · BNF (FR) cb11932573j (data) · J9U (EN, HE) 987007553140905171 · NDL (EN, JA) 00571052 |
|---|









