バセドウ病
バセドウ病またはバセドー病(バセドウびょう、バセドーびょう、 独: Basedow-Krankheit)とは、甲状腺疾患のひとつで、甲状腺機能亢進症を起こす代表的な病気である。自己免疫疾患の一つ。機能亢進によって甲状腺ホルモンが必要以上に産生されるため、肉体及び精神に様々な影響を及ぼす。
ロバート・ジェームス・グレーブス(1835年)とカール・アドルフ・フォン・バセドウ(1840年)によって発見、報告された。かつては発見者のカール・フォン・バセドウ(Carl von Basedow)にちなみ、バセドウ氏病とも呼ばれた[1]。英語圏ではグレーブス病(グレーブスびょう、 英: Graves' disease)と呼ばれる[2]。
病態・原因
甲状腺刺激ホルモンとして機能する自己抗体の無秩序な産生がその本態である。ヨウ素の摂取量が少ない地域(西ヨーロッパなど)では、ヨウ素を大量摂取することで、潜在的なバセドウ病を発病することがある。これはヨードバセドウ病と呼ぶ[3]。
過剰分泌の主な原因は[3]、
甲状腺の表面には、下垂体によって産生される甲状腺刺激ホルモン(thyroid stimulating hormone;TSH)、別名:チロトロピン、の受容体(甲状腺刺激ホルモンレセプター、TSHレセプター、チロトロピンレセプター)が存在する。
バセドウ病では、この受容体に対する自己抗体である抗TSHレセプター抗体、別名:抗チロトロピンレセプター抗体(thyrotropin receptor antibody;TRAb)、が生じる。それがTSHの代わりにTSHレセプターを過剰に刺激するために、甲状腺ホルモンが必要以上に産生されている。甲状腺ホルモンは全身の新陳代謝を高めるホルモンであるため、このホルモンの異常高値によって代謝が異常に活発になることで、肉体及び精神に様々な影響を及ぼす。
この自己抗体(TRAb)産生が引き起こされるメカニズム・原因は、2007年の時点では知られておらず、後述の通り2017年になってようやく判明した。過度なストレス・過労が発症・再発に関与しているという説もある。またバセドウ病を発症する場合、多くはその家系内に甲状腺関連の病気を患った事が多いことから遺伝的な要因の寄与が大きいと考えられている。
2015年鳥取大学らの研究グループが、このバセドウ病を引き起こしているTRAbがEBウイルスに感染したB細胞から分泌されていることを示し、EBウイルスがバセドウ病の一つの原因となっていることを明らかにした[4][5][6]。
原因に関わる研究
2011年から鳥取大学医学部医学科分子病理学分野の研究グループはEBウイルス(Epstein-Barr virus;EBV)というB細胞指向性で9割以上の人間が保有しているヘルペスウイルスの一種の再活性化とバセドウ病の自己抗体(抗TSHレセプター抗体、TRAb)産生との関連を指摘し始めた[7][8][9][10][11]。
2011年の研究では10%以上のTRAbを持つバセドウ病患者において、EBVの再活性化を示唆する初期抗原(EA)に対する抗体価とTRAbのレベルが中程度にしかし顕著に相関することが示された[7]。
2015年の研究では13例中8例のバセドウ病患者から実際にTRAb(+)EBV(+)なB細胞が末梢血単核球から in vitro(実験環境下)にて確認されている。しかし予想に反して、11例の健常対照群全員からもTRAb(+)なB細胞が検出され、さらにTRAb(+)EBV(+)なB細胞も8例見つかっていた。しかしながらバセドウ病患者においてはTRAb(+)なB細胞の検出頻度は健常対照群のそれに比べ顕著に高かった[8]。
同年のまた別の研究では、EBVの再活性化がEBVに感染したB細胞を抗体産生細胞(形質細胞)に分化させ抗体の産生を行わせることができることから、EBVが潜伏感染したTRAb(+)なB細胞が実際にEBVが再活性化した時にTRAbを産生するか否かを調べている。この研究では末梢血単核球においてEBVの再活性化を in vitro(実験環境下)にて誘導した際に、健常対照群(12例)に比べバセドウ病患者(12例)のTRAb(+)EBV(+)なB細胞からより高いレベルのTRAbの産生が行われることが確かめられた[9]。
また同年の症例報告では、EBVの初感染による伝染性単核球症の発症に伴いTRAbのレベルが上昇した小児の例が確認され、in vivo(生体内)におけるEBVとバセドウ病の関連を示唆している[10]。
2016年の研究では、15例の健常対照群に比べ34例のバセドウ病患者ではTRAb-IgMとTRAb-IgGの抗体価が顕著に高いことが示されている。しかしながら、全IgM価よりも全IgG価の方が高いにもかかわらず、TRAb-IgM価の方がTRAb-IgG価よりも高いという結果が出ている。一方で、EBVが再活性化しているバセドウ病患者においてはTRAb-IgM価が高いことが観察された。これは自己応答性IgM+B細胞の数が自己応答性IgG+B細胞の数よりも多いという事実に一致し、EBVによる多クローン性のB細胞の活性化を示唆する結果となった。そしてTRAb-IgMの生理学的な特徴、TRAbのアイソタイプとバセドウ病の病態との関連を明らかにする必要が生じた[11]。
そして最終的に2017年、鳥取大学の研究グループはバセドウ病の自己抗体(抗TSHレセプター抗体、TRAb)が、EBVの潜伏感染Ⅲ型遺伝子の一つLMP-1による、T細胞非依存性のCD40の共刺激シグナルの模倣によって引き起こされるNF-κB活性化によってトランスフォーメーション(形質転換)した、EBVに感染したTRAb陽性B細胞から産生されていることを分子生物学的に証明した[4][5]。さらにその2017年の論文によれば、バセドウ病を引き起こすのはIgG1のアイソタイプを持ったTRAbであり、そのためにはTRAb陽性B細胞で免疫グロブリン(抗体)のクラススイッチ遺伝子再編成を引き起こす活性化誘導シチジンデアミナーゼ(AID)の発現が必須となるが、EBVの潜伏感染Ⅲ型遺伝子のLMP-1はT細胞非依存性にCD40のシグナルを模倣しNF-κBを活性化させることができ、NF-κBはAID遺伝子(AICDA)の転写を促進するので、バセドウ病を引き起こすIgG1のアイソタイプを持ったTRAbの産生が可能になるということである[4][5]。
同研究グループは2018年、11例のリンパ球・形質細胞の浸潤を認めるバセドウ病患者の、7例の甲状腺摘出検体においてEBV(+)B細胞・IgG4(+)形質細胞の存在をそれぞれ EBV-encoded small RNA 1(EBER-1)の in situ ハイブリダイゼーション・免疫組織科学により調べ、実際にEBV(+)細胞とIgG4(+)形質細胞が甲状腺組織の同じ位置に存在していることを確認している。また、14例の健常対照群と13例のバセドウ病患者のリンパ球におけるEBVの再活性化を誘導し、両方のリンパ球においてIgG4の産生を確認している。特に、病状のコントロールができなくなり甲状腺の摘出を受けた患者においては血清におけるIgG4/IgG比がとても高く、IgG4関連疾患様の状態にあることが分かった(IgG4関連疾患に認められる tumefactive な病変・花筵状線維化・閉塞性静脈炎は認められず、IgG4関連疾患とは言い難い)。これは2014年の和歌山大学の研究グループによる、バセドウ病患者の一部において血清IgG4価が高いという結果[12]に一致している。
IgG4へのクラススイッチ遺伝子再編成にはTh2細胞性サイトカインとIL-10という免疫抑制系のサイトカインが必要である[13][14]が、EBVのBCRF-1遺伝子の転写産物はIL-10のホモログ[15]であり、さらに EBV-encoded small RNAs (EBERs) は宿主のB細胞にIL-10の産生を促す[16]ので、EBVのIL-10のホモログとEBERsによって産生が促されたIL-10が制御性T細胞の代わりにIgG4へのクラススイッチに寄与しているようである。通常、形質細胞は抗原に対して高い親和性(high-affinity)を示すIgGを産生する[17][18]が、IgG4は抗原に対し高い親和性を示す抗体ではない[19][20][21]ので、胚中心におけるB細胞の抗原に対しての親和性成熟においてはIgG4へのクラススイッチは非常に稀にしか起こらないと考えてよく、それゆえにこの研究におけるバセドウ病患者の甲状腺切除組織におけるIgG4(+)形質細胞は胚中心におけるB細胞の親和性成熟以外の過程で発生したものと考えられ、そしてその過程はEBVの再活性化によって誘導されたIgG4産生であるということが結論づけられた[22]。
統計
バセドウ病は、甲状腺ホルモンが過剰に作られる病気、すなわち甲状腺機能亢進症を起こす代表的な病気である。中年以上の女性がバセドウ病に罹患した場合、更年期障害と誤認する事が多い。
ほかの甲状腺の病気と同じように女性に多い病気だが、その比率は男性1人に対して女性4人ほど。甲状腺の病気全体の男女比は男性1対女性9の割合であるから、甲状腺の病気のなかでは比較的男性の比率が高い病気である。発病年齢は、20歳代と30歳代で全体の過半数を占め、次いで40歳代、50歳代となっており、青年から壮年に多い病気といえる。何らかのアレルギーを持っている人が多い。
EBウイルスに感染したB細胞からバセドウ病の自己抗体(抗TSHレセプター抗体、TRAb)が分泌されることを証明した論文[4]によれば、EBウイルスに感染したB細胞は、EBウイルスの潜伏感染Ⅲ型遺伝子のLMP1によって多クローン性にクラススイッチさせられIgEのアイソタイプを持った抗体を分泌しうるため、これにより何らかのアレルギーを持つバセドウ病患者が多い現象を説明しうる。
症状・症候
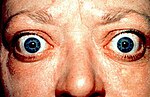
あらゆる臓器が常に全力疾走しているかのような状態となる。症状の出現には個人差があり、特徴的な症状として知られる眼球突出の出現率は患者の 50% 程度とされている[3]。
重篤な病態として、甲状腺クリーゼがあり致死率は 20% 以上との報告がある[3]。
典型的な症状[23]は、
- 心拍数の増加と血圧上昇
- 不整脈
- 大量発汗と体のほてり
- 手の振戦(ふるえ)
- 神経過敏と不安・焦燥感
- 睡眠障害(不眠症)
- 食欲が亢進するにもかかわらず、体重が減少する
- 疲労や脱力を感じるにもかかわらず活動レベルが高まる
- 排便回数増加(ときに下痢を伴う)
- 生化学的検査上のコリンエステラーゼの低下(検診結果を解釈する上で、この所見を認めた際、甲状腺機能亢進状態も鑑別診断に挙げる必要がある)
人間関係に及ぼす影響
この疾患は、患者のおかれた社会的立場にも影響を及ぼす。
性格に驚くほどの変化をきたすことが多い。ある程度自分の苦しみを隠す能力はあるが、すぐに行動や言葉に著しい変化が現れ、他の人は簡単に変化に気がつく。その変化の原因が突き止められない限り、問題の元を突き止めることができない。
特に夫婦関係に支障をきたすケースが多い。患者は気分の変転が多くなり、コミュニケーションがうまくいかず、多くは配偶者の行動を歪んで認識する。患者自身が病変による不慣れな感覚を理解するのに苦労しており、配偶者もストレスを共有するため、誤解や誤った期待などの混乱、些細なことでの口喧嘩をもたらす。患者は口論のストレスにうまく対処できずに不仲になる危険性をはらむ。甲状腺機能低下症であっても亢進症であっても、どちらも行動の変化を惹起する[24]。
検査
診断
甲状腺腫大、眼球突出、頻脈、体重減少、手指振戦、発汗増加等の甲状腺中毒症所見などからバセドウ病が疑われる場合、血中の甲状腺ホルモン測定などにより判断する。
- 甲状腺ホルモン:freeT4、freeT3の高値、TSHの異常低値。ただしeuthyroid Graves' diseaseの場合はホルモン正常であるので注意。
- 自己抗体:抗TSH受容体抗体(TRAb)陽性、または抗TSH受容体刺激抗体(TSAb)陽性。
- 甲状腺機能の亢進:甲状腺シンチでの摂取率高値、エコーでの血流増加。
これについては、日本甲状腺学会より「甲状腺疾患診断ガイドライン2013」として「バセドウ病の診断ガイドライン」が提示されている[26]。
病理学
チロキシンが過度に利用される疾患であるため、甲状腺濾胞には、光学顕微鏡下でも明らかな空胞が生じる。
治療
薬剤による治療
甲状腺ホルモンの合成を抑える薬(抗甲状腺薬:メチマゾール(チアマゾール、メルカゾール)、プロピルチオウラシル(チウラジール、プロバジール)を、規則的に服用する方法。定期的に甲状腺ホルモンの量を測定しながら、適切な量の薬を服用することで、血液中の甲状腺ホルモンの濃度を正常にする。薬で甲状腺刺激ホルモンの量を調整することで普通の人と変わらない生活を営むことができるが、甲状腺刺激抗体が消えるまで薬を飲みつづける必要がある為、完治には長い期間を要する。副作用としては、5%に皮膚の炎症、0.05%に白血球の減少や無顆粒球症が生じることがある。これらの副作用は服用開始から3か月以内に現れることが多い。無顆粒球症が生じたら直ちに服薬を中止し、他の治療法に切り替える必要がある。(好中球数 1000個/μLを下回れば中止とする。)
- メルカゾールではMPO-ANCA関連血管炎がまれに引き起こされる。
- メルカゾールは15mg/dayで開始が安全といわれている。
- プロピルチオウラシルは重症肝障害が出現することがあるため、ガイドラインでもメルカゾールを第一選択薬としている[26]。
アイソトープ(放射性ヨード)内用療法
放射線治療の一種であり、非密封小線源治療に分類される。外来治療が可能であり、簡便性の面で優れている。甲状腺にヨードがほぼ特異的に集積する性質を利用し、ヨードの放射性同位元素(ラジオアイソトープ; radio isotope; RI) "131I" を内用することで、甲状腺に集積した放射性ヨードから出るβ線によって、甲状腺細胞の一部を死滅させ細胞の数を減らす方法。
甲状腺細胞数を減少させ、産生・分泌される甲状腺ホルモンの量が減ることで治療効果を発現する。治療効果に即効性はなく、およそ2 - 6か月で甲状腺ホルモンの量が減少すると言われ、手術に比べ患者への総合的な負担が少なく、抗甲状腺薬より早く治る(註:症状軽減ではなく、原因治療による治癒を指す)のが、この治療法の長所である。
ただし、放射性ヨードの最適量を算出する方法が存在せず、経験的に甲状腺機能の亢進をほぼ確実に是正できる量を、患者個人の因子を考慮せず、一律に投薬するため、時間経過とともに細胞が減りすぎて、逆に甲状腺の機能低下が発生することもある。なお、治療に寄与するのは、飛程の短いβ線であるが、131Iは同時にγ線を放出するため、患者の体外であっても、患者近傍では放射線の被曝を生じる。
放射性物質を用いるので、被曝の影響が全くないとはいえず、妊娠中や授乳中の女性および、すぐに妊娠を希望する女性などには行なわない。放射線の影響は約4か月でなくなるとされることから、4か月で妊娠を許可している施設もあるが、甲状腺機能の変動があるため、全身状態を考慮すると、1年は待つべきとされる。
ヨード内用療法は施行する際に、前処置が必要である。と言うのも、非放射性同位元素のヨードが体内に大量(または通常量であっても)にあると、体内の全ヨード中の放射性ヨードの占める割合が著しく低下する。こうした状態では、ヨードは無作為に甲状腺に取り込まれることから、確率的に甲状腺に取り込まれる放射性ヨードが治療量に達しない恐れがあるため、前処置としてヨード制限を行なう。
西欧諸国では、食物中に含まれるヨード量が少ないため、ヨード制限はヨードが含有していることが明らかな食品を避けることで、比較的容易に制限することが可能である。日本で普及している食品(外食も含め)には、昆布だしを使用しているなどにより、非明示的にヨードが含まれているものも多く、医師により摂取可能な食品の指導を受け、食事に対し十分な注意を払う必要がある。
その一環で、治療前に造影CTで一般に用いられるヨード系造影剤の使用も避けるのが原則であるが、無機ヨードが甲状腺へ取り込まれる量は僅少であり、実臨床では治療前に造影検査を行なっていても、ヨード内用療法の効果に与える影響は、無視できる程度である。
- RI治療により、バセドウ眼症(甲状腺眼症)が悪化することもある。眼症を持つ患者のRI治療の適応は、ヨード内用療法以外の治療法も視野に入れ、慎重に判断する必要がある。また眼症増悪の際には、プレドニゾロン投与、またはステロイドパルスとX線による球後照射の併用が施行される。
- 13mCi投与により、ややover-burnとすることが多い。
手術
甲状腺の一部を残して、切除する方法。甲状腺組織量を外科的に減量し、過剰な甲状腺ホルモンの分泌を是正する。他の治療法より効果発現が速く、再発も少ないという利点がある一方で、周術期管理のために入院を要する。
合併症としては、反回神経麻痺による嗄声などが知られている。また、皮膚切開が通常衣服で覆われない位置で行なわれるために、術後瘢痕(傷跡)が整容性を減じることは、適応判断に影響を及ぼす。手術は全身麻酔で行なわれるため、侵襲性が高く、患者が高齢者である場合や、心疾患や腎疾患がある場合には原則として外科的治療を選択することはない。
術前に最適な甲状腺組織の切除量を推定する方法は知られておらず、外科的治療によって理想的な甲状腺機能を得ることは甚だ困難で、甲状腺機能亢進症の確実な制御を優先して、十分量の切除を行なうため、術後に甲状腺機能低下症に陥ることが多いが、その場合の治療は通常の甲状腺機能低下症と同じであり、甲状腺ホルモン薬(チラーヂンSなど)を、術後は服用を続けることとなる。
なお、再発した場合は再手術は行なわず、ヨード治療などに切り替える。
対症療法
頻脈性不整脈に対し、β遮断薬を対症療法として処方することがある。
予後
バセドウ病は適切な治療を行なえば予後良好である。しかし、無治療のまま放置すると、致死的結果を招くこともあり得る。心臓に与える影響として洞性頻脈は必発で、臨床的により深刻な心房細動に至ると、心房内に鬱滞した血液が凝固して血栓を生じ、血栓塞栓症として脳塞栓を起こし、脳梗塞に至る危険性もある。この場合、動脈硬化性の脳梗塞とは異なり、後方循環系にも脳梗塞が起こりうる。甲状腺クリーゼは、早急に専門医に紹介されるべき病態のひとつである。
周期性四肢麻痺は、そのものは生命には関与しないが、てんかん発作と同様に車の運転中などに発作を起こすと事故に至ることも懸念される症状のひとつであり、広義では予後に影響を与える。
妊娠・出産
適切な治療が行われていないとき、妊娠中、へその緒を通しての胎児への栄養がうまく送れなくなり、胎児が発育遅延になる場合がある。母体のTRAbやTSAbが多い場合、これらの抗体が胎盤を通して胎児に送られるため、新生児に一時的にバセドウ病の症状が現れることがあるが、これらの抗体は新生児が産生しているものではないため、やがて症状は消える。
甲状腺の治療薬は長い間、胎児の奇形に寄与すると信じられていたが、現在では否定されている。
歴史
アイルランドの医師グレーブス(1835年)によって初めて報告された。その後バセドウ伯(1840年)が独自に発見・報告し[27]、ゲオルグ・ヒルシュによりこの名が付けられた。症状の「メルゼブルクの三徴」は、バセドウの出身地、メルゼブルクの地名に因む[28]。本症の発見前後、日本の医学は主にドイツからの情報に依存していたため、グレーブス病(Graves' disease)ではなくバセドウ病と呼ばれる事が多い。
ANCA関連血管炎とバセドウ病との関連
未治療のバセドウ病患者や抗甲状腺薬内服後にANCA陽性となる症例が報告されている。そのほとんどはMPO-ANCAである。抗甲状腺薬内服後にANCA陽性となった場合は無症状で低抗体価ならば内服変更はせずに経過観察でもよいという報告はある。しかし、血管炎症状合併時や高抗体価の場合は内服薬の変更が好ましいとされている。
脚注
参考文献
- グレーブス=ロバート・ジェイムズ、1835年5月23日「Clinical lectures - At the Meath Hospital during the Session of 1834-5. Lecture XII」『The London Medical and Surgical Journal』7巻2号513 - 520ページ、2010年11月6日閲覧
- バセドウ伯=カール・アドルフ、1840年3月28日「Exophthalmus durch Hypertrophie des Zellgewebes in der Augenhöhle」『Wochenschrift für die gesammte Heilkunde. 1840』13号197 - 204・220 - 228ページ、2010年11月6日閲覧
- 長田佳子、林一彦、臨床免疫・アレルギー科 第66巻第3号(2016年9月発行) 出版:科学評論社 , ISSN 1881-1930, NAID 40020953161
関連項目
外部リンク
- バセドウ病とは? - 日本小児内分泌学会
- バセドウ病の診断ガイドライン2013(医師・医療関係者用) - 日本甲状腺学会
- 甲状腺眼症(バセドウ病などの一症状) - 日本眼科学会
- バセドウ病 - 日本内分泌学会
- 甲状腺機能亢進症(バセドウ病、グレーブス病) - 岐阜赤十字病院