先天性高インスリン血症
先天性高インスリン血症(せんてんせいこうインスリンけっしょう、英: congenital hyperinsulinism、略称: CHI)は、インスリンの分泌過多によって低血糖が引き起こされる、一連の先天性疾患を指す用語である[4][5]。先天性高インスリン血性低血糖症には、一過性のものと持続性のものがあり、軽症から重症までさまざまである。こうした症状は出生時には既に存在しており、ほとんどの場合には乳児期の初期に明らかとなる。軽症例は頻回食によって治療することができるが、より重症例ではインスリンの分泌や作用を低下させる医薬品による制御が行われる[1][5]。
| Congenital hyperinsulinism | |
|---|---|
| 別称 | CHI |
 | |
| インスリン (この疾患では過剰産生される) | |
| 概要 | |
| 症状 | 低血糖[1] |
| 原因 | ABCC8遺伝子変異(最も一般的)[2] |
| 診断法 | 血液試料[3] |
| 治療 | オクトレオチド、ニフェジピン[4] |
| 分類および外部参照情報 | |
徴候と症状

CHIは先天性疾患であるため、通常は新生児は出生後数日以内に徴候や症状を示し始めるが、極めて稀に、より後の段階になって症状が出現する可能性がある。CHIの徴候や症状は新生児や幼児の典型的挙動と混同されることが多く、その特定は困難であることが多い[6]。
CHIの症状はいくつかの形で出現する可能性があるが、低血糖症に一般的な症状は次のようなものである。
- 易刺激性[7][8]
- 嗜眠[8][9]
- Jitteriness/振戦[7][8][9][10]
- 頻脈または徐脈[11]
- 異常呼吸パターン/無呼吸[7][8]
- 低体温[7][8][9]
- 異常な摂食行動(摂食のために目覚めることがない、哺乳困難、落ち着きがない、順調な授乳が続いた後に頻繁に授乳を要求する)[7][8][9]
- 甲高い泣き声[9]
- 筋緊張低下[7][8][9]
- 蒼白/チアノーゼ[7]
- 発汗[8][10]
より成長した小児や成人の症状には、頭痛、意識不鮮明、めまいなどがある[11]。
親による最初の懸念や症状として、吸い付きが弱い、眠りがち、過敏などと表現されることが多い[12]。
低血糖状態が持続したり、極度の低血糖状態となった場合には、てんかん発作(けいれん)などより重篤な症状が生じる場合がある[7][8][10][13]。血糖値が回復しない場合には、意識消失や脳損傷が生じる可能性がある[13]。
何らかの低血糖症状がみられる場合には、簡易的な血糖測定が不可欠である[14]。
原因
高インスリン血症(HI)や先天性高インスリン血症(CHI)には、遺伝的要因と後天的要因の双方がありうる。後天的要因によるものとしては、胎児発育不全、周産期仮死、妊娠糖尿病など周産期の因子によって二次的に生じたものの可能性があり、これらはまとめてperinatal stress-induced HI(周産期ストレス誘発性HI)と呼ばれることも多い。こうした症状は出生後24時間以内にみられるのが一般的であり、多くの場合2週以内に消失する[15][16]。
周産期ストレスによる低血糖とは対照的に、CHIは遺伝的要因によるものもある。そのため、後天的要因の可能性が低い小児に対しては遺伝子検査が考慮に入れられる。こうしたケースには、第一選択薬となるジアゾキシドに反応しない場合などが含まれる。ジアゾキシドに反応するものの低血糖が4ヶ月以降も持続する小児に対しても、遺伝子検査が行われる場合がある[17][18]。
CHIの遺伝的要因は多くあり、症状が単独で出現する場合(非症候群性、isolated form)と、より広範囲の疾患(症候群)の一部として症状がみられる場合(症候群性、syndromic form)がある[19]。
非症候群性
非症候群性の高インスリン血症は、CHIの大部分を占める。最も一般的な遺伝的要因は、カリウムチャネル(KATPチャネル)の構成要素をコードする遺伝子(ABCC8もしくはKCNJ11)の一方または双方のコピーの変化である[20][21]。このチャネルは通常は膵臓のβ細胞において血糖値に応答したインスリン産生を調節しているが、チャネルの変化や欠陥によって無制御かつ過剰なインスリン産生が行われるようになる。こうしたABCC8もしくはKCNJ11遺伝子の変化によるCHIは優性遺伝する場合も劣性遺伝する場合もある。優性型の場合、一方の親から遺伝した1つの変化(もしくは散発的に生じた変化)によってびまん性のCHIが引き起こされる。びまん性CHIでは、膵臓全体が影響を受ける。優性型のCHIは軽症でジアゾキシドに反応する場合も、重症でジアゾキシドに反応しない場合もある。ABCC8もしくはKCNJ11遺伝子の変化によるCHIの一部は劣性遺伝する。こうした家系では、両親はそれぞれ1コピーずつ欠陥遺伝子を保有しているが、発症に至ることはない。子が両親から1つずつ欠陥遺伝子を受け継いだ場合、CHIを発症する。一般的に劣性型は、ジアゾキシド不応性のびまん性CHIを引き起こす。一部の症例では、父親由来の欠陥遺伝子の遺伝と膵臓内での母親由来の正常コピーの喪失との組み合わせによってCHIが引きこされている場合がある。こうしたケースでは局所性のCHIとなり、膵臓の一部(局所性病変)でのみインスリンか過剰産生される[17][22][23]。
重症のCHIで医薬品に反応しない場合には、ABCC8、KCNJ11遺伝子の迅速な検査が推奨される。この検査は、疾患初期に局所性CHIの可能性を特定するために有用である。遺伝子検査後には、18F-DOPAを用いたポジトロン断層撮影(PET)によって外科的除去を行う局所性病変を特定する。遺伝子検査はABCC8もしくはKCNJ11遺伝子の双方のコピーが欠陥を有するかどうかを明らかにするためにも有用であり、両コピーに欠陥がみられる場合にはジアゾキシド不応性のびまん性CHIと診断される。こうした症例はオクトレオチドなどの代替的な医薬品による治療を必要とし、膵臓の大部分の外科的除去が必要となる可能性がある。このように、重症CHIの小児に対する内科的・外科的管理の指針として、早期の迅速な遺伝子検査は重要である。CHIに関する遺伝子検査の結果は、CHIに関して経験豊富で専門的知識を有する分子遺伝学研究室で解析されることが望ましい[18][19][23][24]。
CHIの原因として一般的な他の遺伝的要因には、グルタミン酸デヒドロゲナーゼ(GDH)をコードする遺伝子GLUD1の変化がある。このタイプはGDH-CHIもしくはGLUD1-CHIと呼ばれる。このタイプのCHIは優性遺伝するが、散発性のものである可能性もある。このタイプのCHIでは、血中アンモニア濃度が緩やかに上昇する。GDH-CHIの小児や成人はジアゾキシドに反応することが多い。食事中のタンパク質の過剰によって低血糖がもたらされるため、炭水化物とタンパク質の比率を適切にすることが勧められる。非症状群性CHIの遺伝的要因は他にも多くあり、ヒドロキシアシルCoAデヒドロゲナーゼ(SCHAD-CHI)やグルコキナーゼ(GCK-CHI)の変異のほか、近年ではグルコキナーゼに類似した酵素HK1も軽症型・重症型双方の原因となることが特定されている[18][23][25]。
症候群性
症候群性のCHIは非症候群性CHIと比較して少数であり、疾患レジストリのデータからは報告症例の1%未満であることが示唆されている[26]。症候群性CHIは、遺伝的要因が一般的である[27]。ベックウィズ-ヴィーデマン症候群(BWS)は、症候群性CHIの原因としてよく知られた過成長症候群である。CHIを一般的な特徴とする他の症候群には、歌舞伎症候群やターナー症候群がある。症候群性CHIの大部分はジアゾキシド治療に反応し、CHIは経時的に軽快する可能性があるが、BWSに伴うCHIは重症型で通常の治療に反応しない場合もある[28][29][30]。
診断

CHIは膵臓β細胞のインスリン分泌の調節不全を原因とする。低血糖時にはインスリンは抑制されず血中に存在する。インスリン濃度は変動するため、測定は困難な場合がある。CHIの診断は、低血糖時のインスリン作用の亢進や血漿インスリンの不十分な抑制をもとに行われる。インスリン作用の亢進は、グルコース必要量の増加によって示される(一例として、新生児の正常値4-6 mg/kg/分に対し、8 mg/kg/分以上)[31]。過剰なインスリン作用の他の徴候としては、低血糖時の遊離脂肪酸やケトン体(β-ヒドロキシ酪酸)の血中濃度の低下が挙げられる。臨床診断は低血糖時グルカゴン投与後の血糖値の大幅な上昇によっても支持される[32][33][34]。グルカゴンは膵臓から分泌される他のホルモンであり、インスリンの作用に対抗して肝臓に貯蔵されているグリコーゲンからグルコースの放出を刺激する。インスリン、C-ペプチド(インスリンと共に分泌される)、遊離脂肪酸、ケトン体濃度の測定やグルカゴン負荷試験は、自然に生じた低血糖時や管理下絶食によって誘発された低血糖時に行われる。新生児の場合、出生後72時間以内は一過性低血糖の期間であるため、臨床診断は72時間経過後に行うのが最善である[35]。血中アンモニア、アシルカルニチン分析、尿中代謝物分析、タンパク質やアミノ酸(ロイシン)に対する応答の検査は、CHIのサブタイプの決定に有用である可能性がある[36][37][38][39]。
治療
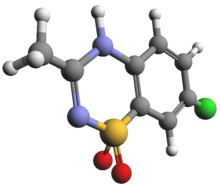

高インスリン血症の治療目標は低血糖による脳損傷を防ぐことであり、血糖値を正常範囲 [>70 mg/dL (3.9 mmol/L)] に維持することが目標となる。第一段階は急性低血糖後の血糖値の正常範囲への回復であり、続いてCHIで一般的な再発性低血糖の防止となる。
最初の治療としてはグルコースの静注が最も効果的となる。遺伝子型や表現型などによってCHIの診断が確定すると、特異的治療が開始される。よく試みられる治療法を次に挙げる。
- 栄養療法: 経腸栄養(経鼻、胃ろう)による炭水化物(ブドウ糖、フォーミュラ)の持続注入[7]
- インスリン分泌を抑える医薬品: ジアゾキシド、オクトレオチドやランレオチドなどソマトスタチンアナログ[40]
- インスリン作用に対抗する医薬品: グルカゴン[40]
- 膵臓の一部またはほぼ全域を除去する外科手術(膵切除術)[40]
ジアゾキシドはKATPチャネル開口薬であり、KATPチャネルのSUR1サブユニットに結合することでインスリン分泌を阻害する。ジアゾキシドはCHIの治療に承認されている唯一の医薬品であり、この疾患の治療における第一選択薬である[41]。ジアゾキシドによる体液貯留の副作用を防ぐため、利尿薬による治療が同時に開始されるのが一般的である。用量の選択と漸増は、反応と副作用を注意深く考慮しながら行う。半減期は長いため、十分な治療効果が得られるには最大で5日かかる可能性がある。次の重要な段階はジアゾキシド反応性の評価であり、診断と治療において重要な意味を持つ。ジアゾキシド反応性の判断は、CHIの主要な特徴である低ケトン性低血糖の改善をもとに行われる。ジアゾキシド反応性は絶食試験による評価が最善であり、血漿グルコース濃度が70 mg/dL(3.9 mmol/L)以上の状態で12–18時間の絶食が可能であること、または絶食時に血漿グルコース濃度が50–60 mg/dL(2.8–3.3 mmol/L)未満に減少する前に血漿β-ヒドロキシ酪酸濃度が1.8 mmol/L以上に増加することで示される。ジアゾキシド不応性は、CHIがKATPチャネルをコードする遺伝子の不活性化変異によるものである可能性を示唆する。こうした症例では、局所性CHIの可能性を明らかにするためにABCC8またはKCNJ11遺伝子の迅速な遺伝子検査が重要である[42]。
局所性CHIには手術が治療選択となるが、手術前に病変部位を特定することが重要である。こうした病変は超音波検査やCTスキャン、MRIといった従来のイメージング手法で可視化することはできない。しかしながら、18F-DOPAを用いたPETスキャンによってほぼ100%正確に局所病変を特定することが可能である[43]。術中凍結組織検体を用いた膵臓組織の専門家による評価と手術の専門的技術が成功の鍵となる。局所性CHIの治癒率は97%と報告されている[44]。
局所性でないジアゾキシド不応性症例の場合、治療オプションは限られている。ソマトスタチンアナログであるオクトレオチドの適応外処方は、CHIの治療におけるセカンドライン治療として長く用いられているが[45]、その効果はタキフィラキシーによって限定的なものとなる。ジアゾキシドを用いることができない地域では、オクトレオチドが第一選択薬となる可能性がある。オクトレオチドは致死的な壊死性腸炎と関係している可能性があるため、新生児に対する使用はリスクとベネフィットを注意深く考慮して行うべきである[46]。オクトレオチドは一般的には6時間ごとに皮下注射によって投与されるが、ポンプを用いた持続皮下注射も可能である。長時間作用型ソマトスタチンアナログであるオクトレオチドLAR(筋肉内注射)やランレオチド(深部皮下注射)は、より年長児にとって便利なオプションとなる。オクトレオチドが適応外もしくは不応性のジアゾキシド不応性症例に対する代替的な治療アプローチは胃ろうを介したブドウ糖の持続注入となる[47]。
予後
CHI患者の予後は、診断の遅れの影響、治療の副作用、治療の効果などの影響を受ける。
ジアゾキシドやソマトスタチンアナログによる治療を行った小児では副作用は一般的であり、さまざまな重症度の治療患者の最大50%が影響を受ける[48][49][50][51][52]。局所性CHIの小児の手術予後は優れており、治癒率は97%である[53]。一方で、びまん型CHIで膵亜全摘を行った小児の最大50%では術後も低血糖が継続し、さらなる治療を必要とする[53][54]。そして時間経過とともにインスリン依存性糖尿病と膵機能不全を発症する。膵亜全摘を行った小児の91%が14歳までにインスリンを必要とする状態となる[55]。
高インスリン血症の小児における神経発達・神経行動学的症状の頻度は、患者の種類や国によって異なるものの40–50%と高い[54][56][57][58]。そのため、成長したり手術によって治癒した場合であっても、小児期を通じて神経発達検査を行うべきである。
疫学
CHIの罹患率はさまざまである。いとこ婚が一般的な地域では2,500人に1人、その他では50,000人に1人とされるが、これらの値は少数の入院患者に基づいたものであるため不正確である可能性がある[59]。イギリスにおける持続性CHIの罹患率は、28,389人に1人と報告されている[60]。フィンランドでは、持続性CHIの罹患率は13,500人に1人、一過性CHIは7,400人に1人と報告されている[61]。しかしながら、周産期ストレスによる高インスリン血症は比較的よくみられるものであるため、実際の値はより高いと予測されている[62]。CHIに関する新生児スクリーニングは開発されていないため、本当の罹患率は未知である。
CHIの経過は疾患の重症度や、一過性のものかどうかによって異なる。重症CHI患者は投薬治療に反応しないことが多く、膵臓の手術が必要となる可能性がある[63]。遺伝性のCHI患者に対しては手術が行われる可能性が高いが、時間経過とともにその重症度は低下するようであり、そのため一部の医師はオクトレオチドと炭水化物に富む食事との併用によって正常な血糖値を維持することを推奨している[64][65]。同様に、KATPチャネルの構成要素をコードする遺伝子(ABCC8/KCNJ11)に変化が生じている小児の一部も経過とともに重症度の低下を示す[66]。
ABCC8またはKCNJ11遺伝子の1コピーの変化が優性遺伝、すなわち患者の親から子へ遺伝する場合がある。こうした小児では、程度はさまざまであるものの、寛解が生じる場合がある[67][68]。このグループでは、小児や成人の一部では後に高血糖と糖尿病を発症する可能性もある[69]。同様の低血糖から高血糖への変化は、HNF1AやHNF4A遺伝子に変化が生じている患者でもみられる[70][71]。
CHIの経過は、低血糖の問題以外にも及ぶ。幼児期の低血糖症による重要な影響は脳損傷である。小児期の発達の遅れは患者の最大50%、特に重症型CHIの患者で多く報告される[72][73]。摂食の問題も親から報告されることが一般的である[74][75]。重症型CHI患者でより高頻度でみられるようであり、長期間継続する可能性がある[76][77]。
CHIの経過には、治療と関連した副作用も関係する。ジアゾキシドは短期的には致死的な肺高血圧を引き起こす可能性があるが、こうした副作用はわずかな症例で生じるのみである[78]。より一般的なものとしては、ジアゾキシドは体毛の増加や長期的には顔貌の変化を引き起こすことがある[74][79][80]。部分的膵切除による治療を受けた局所性CHI患者は多くの場合治癒し、膵臓に問題が残ることはない。対照的に、膵亜全摘などより広範囲の手術行われた場合には、小児期の後期や思春期にインスリン依存性糖尿病を発症する[81]。手術後、糖尿病の発症前には低血糖と高血糖の双方がみられることが多い。こうした患者の約半数では膵酵素補充療法の必要性が生じる[82]。
歴史
先天性高インスリン血症(CHI)はこれまでさまざまな名称で呼ばれており、1970年代には膵島細胞症(nesidioblastosis)やislet cell adenomatosis、1980年代には beta cell dysregulation syndromeやbeta cell dysmaturation syndrome、そして1990年代には乳児持続性高インスリン血性低血糖症(persistent hyperinsulinemic hypoglycemia of infancy、PHHI)という名称が好まれていた[83]。
インスリン誘発性の症候性低血糖は1922年に初めて認識され、インスリン治療を受けた最初の糖尿病患者でインスリンによる低血糖によって神経質になるといった症状がみられた。先天性高インスリン血症の小児の最初の記載は、1954年にIrvine McQuarrieによって米国小児科学会(American Academy of Pediatrics)での会長講演の中でなされた。McQuarrieはこの疾患を"idiopathic hypoglycemia of infancy"と呼び、患者の何人かは血糖値を制御するために膵臓の大部分の切除が必要であった。一部の患者は低血糖の家系であったため、McQuarrieはこの疾患が遺伝性である可能性を示唆した。その翌年、トロントのCochraneらによって、こうした特発性低血糖症の全てではないものの、その一部ではタンパク質もしくは特定のアミノ酸、特にロイシンによって引き起こされることが報告された[83]。こうしたロイシン感受性の低血糖症の発見によって、グルコースだけでなくアミノ酸もインスリン放出の重要な刺激因子となっている可能性が初めて示された[84][85][86]。
CHIは膵島細胞症(nesidioblastosis)と呼ばれることがあるが、この名称は膵臓組織で膵管上皮細胞からインスリン産生細胞が生じているように観察されることに基づいている。しかしながら、このことは新生児の膵臓の一般的特徴に過ぎないことが示され、この名称は用いられなくなった[83]。現在では、CHIは遺伝的変異によるβ細胞でのインスリン調節の異常が疾患の原因であることが広く認識されている[87]。
1964年Drashらによって、インスリン分泌を抑える高血圧治療薬であるジアゾキシドによってCHIの小児の一部で低血糖が制御されることが報告された。現時点では、ジアゾキシドが高インスリン血症の治療に対してFDAの承認を受けている唯一の医薬品である[83]。
1996年、グルコース刺激によるインスリン分泌に重要な役割を果たしているKATPチャネルをコードする遺伝子(ABCC8、KCNJ11)にCHIの原因変異が発見された[88][89]。すぐ後には、グルコキナーゼ(GCK)やグルタミン酸デヒドロゲナーゼ(GLUD1)の変異も高インスリン血症の原因となることが特定された[87][90][91]。現在では、CHIの原因となる遺伝子は30以上同定されている[92]。一般的なCHI原因遺伝子に対する迅速な遺伝子検査は標準的診断の一部となっており、外科的除去によって治癒可能な局所性CHIの可能性が高い幼児の特定に役立っている[93][94]。2003年には、18F-DOPAを用いたPETスキャンが局所性CHIの病変部位の特定と切除に有用であることが示された[95]。
社会と文化
患者支援組織
先天性高インスリン血症の患者の生活の改善を目的とした患者支援組織は、患者とその家族の支援、CHIに関する研究への参加と資金提供、そしてこの疾患への認識を高める重要な役割を果たしている[96][97]。Congenital Hyperinsulinism Internationalはこうした目的で設立された国際的な患者支援組織であり、チャン・ザッカーバーグ・イニシアチブのRare as One Networkのメンバーである[74]。
疾患レジストリ
先天性高インスリン血症の患者は、HI Global Registryと呼ばれる疾患レジストリに登録することができる。自身の経験に関する調査をレジストリに投稿することで、疾患研究に貢献することができる[74][98]。
出典
関連文献
- Hoyme, Louanne Hudgins; Toriello, Helga V.; Enns, Gregory M.; Hoyme, H. Eugene (2014) (英語). Signs and symptoms of genetic disease : a handbook. Oxford: Oxford University Press. ISBN 9780199930975
- (英語) Care of the newborn a handbook for primary care. Philadelphia: Lippincott Williams & Wilkins. (2005). ISBN 9780781755856
関連項目
- 高アンモニア血症
外部リンク
| 分類 | |
|---|---|
| 外部リソース(外部リンクは英語) |