Kubāns
Kubāns (pentaciklo[4.2.0.02,5.03,8.04,7]oktāns, C8H8) ir sintētisks ogļūdeņradis, kurā astoņi oglekļa atomi izvietoti kuba virsotnēs un pie katra piesaistīts viens ūdeņraža atoms. Kubāns ir kristāliska cietviela, termiski stabils līdz 220 °C. To pirmo reizi sintezēja Filips Ītons un Tomass Kols 1964. gadā.[2] Kubānā oglekļa atomi izvietoti tiem neraksturīgā 90° leņķī (salīdzinot ar tetraedriskā oglekļa 109.45°), kas rada lielu spriegumu starp tiem. Šī apstākļa dēļ pirms tā sintēzes tika uzskatīts, ka šādu molekulu iegūt nav iespējams. Kubāns ir kinētiski stabils, jo tam nav viegli pieejamu sadalīšanās ceļu.
| Kubāns | |
|---|---|
  | |
| Citi nosaukumi | Pentaciklo[4.2.0.02,5.03,8.04,7]oktāns |
| CAS numurs | 277-10-1 |
| Ķīmiskā formula | C8H8 |
| Molmasa | 104,15 g/mol |
| Blīvums | 1290 kg/m3 |
| Kušanas temperatūra | 133,5 °C[1] |
| Viršanas temperatūra | 161,6 °C[1] |
Sintēze
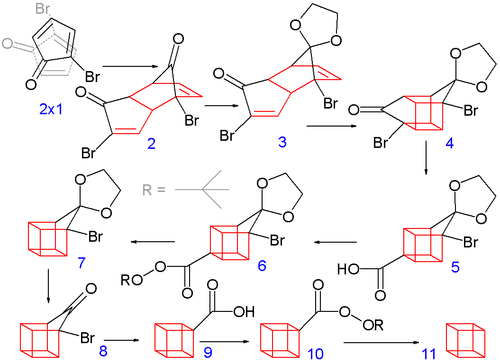
Klasiskā 1964. gada sintēze sākās ar 2-ciklopentenona pārvēršanu par 2-bromciklopentadienonu.[2]
Bromēšana ar N-bromsukcinimīdu tetrahlorogleklī un tam sekojoša broma pievienošana dubultsaitei rada 2,3,4-tribromciklopentanonu. Šim savienojumam pievienojot dietilamīnu dietilēterī notiek divu bromūdeņraža ekvivalentu eliminēšana un iegūts vēlamais diēns.
2-bromciklopentadienons Dīlsa—Aldera reakcijas rezultātā spontāni dimerizējas. Tālāk viena no savienojuma 2 ketogrupām tiek aizsargāta ar etilēnglikolu un iegūtajai molekulai tiek veikta fotoķīmiska [2+2] ciklopievienošana, iegūstot savienojumu 4. Bromketona grupu pārveido par karbonskābi, izmantojot Favorska pārgrupēšanos, kam seko dekarboksilācija un aizsargrupas noņemšana, iegūstot savienojumu 8. Tālāk tiek veikta otra Favorska pārgrupēšanās un tai sekojoša dekarboksilācija, iegūstot kubānu (11).
Laboratorijā pieejamākā sintēzes metodē tiek iegūts biaizvietots kubāns, bromējot ciklopentanona etilēnketālu, iegūstot tribromciklopentanona atvasinājumu, ko ar dehidrobromēšanas un Dīlsa-Aldera reakcijas palīdzību pārvērš kubāna 1,4-diskābē.[3][4]
Iegūto kubāna 1,4-diskābi var izmantot citu kubāna atvasinājumu iegūšanai. Pašu kubānu no šī savienojuma var iegūt, izmantojot Bartona dekarboksilāciju.[5]
Atvasinājumi un to pielietojumi
Laika gaitā ir iegūts liels skaits dažādu kubāna atvasinājumu ar dažādām funkcionālajām grupām.
Lielo spriegumu starp oglekļa atomiem dēļ kubāni ir enerģētiski, bet kinētiski stabili savienojumi, līdz ar to kubāna atvasinājumi, kā oktanitrokubāns un heptanitrokubāns, tiek pētīti kā potenciālas sprāgstvielas.
Tiek pētīts kubāna atvasinājumu potenciāls medicīnas ķīmijā bioloģiski aktīvu molekulu iegūšanā. Kubāna trīsdimensionālā forma un potenciāls pievienot aizvietotājus astoņās dažādās vietās ļauj iegūt specifiskas molekulas ar unikālu telpisko uzbūvi. Kubāna fragmentu var izmantot kā trīsdimensionālu alternatīvu benzola gredzenam.[6]
Ķīmiskās īpašības
Ar kubānu veicot metāla jonu katalizētu pārgrupēšanos var iegūt kuneānu.[7][8]
Rodija katalizatora klātbūtnē kubāns veido syn-triciklooktadiēnu, kas 50—60 °C temperatūrā sadalās par ciklooktatetraēnu.[9]