Karbonat
Karbonati so soli, estri in naravni minerali s karbonatnim anionom (CO32-). So bazični.

Splošno
Prisotnost karbonatnega iona v soleh in raztopinah se ugotavlja z dodatkom razredčene mineralne kisline, na primer klorovodikove kisline, ki povzroči sproščanje mehurčkov ogljikovega dioksida.
Naziv karbonat se uporablja tudi za njegove soli in minerale, ki so v naravi zelo razširjeni. Najpogostejša sta kalcit ali kalcijev karbonat CaCO3, ki je glavna sestavina apnenca in kalcijev magnezijev karbonat CaMg(CO3)2, ki je glavna sestavina dolomita. Proces odstranjevanja ogljikovega dioksida iz karbonatov se imenuje kalciniranje. Takšen proses je, na primer, žganje apna v apnenicah.
Zgradba in kemijske vezi
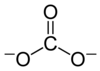
Karbonatni ion je večatomni ion s kemijsko formulo CO32- in molekulsko maso 60,01 daltona. Sestavljen je iz centralnega ogljikovega atoma, obkroženega s tremi enakovrednimi kisikovimi atomi. Razporeditev je trikotna planarna z molekularno simetrijo D3h. Ion ima formalno dva negativna naboja in je konjugirana baza hidrogenkarbonatnemu ionu HCO3-, ta pa je konjugirana baza ogljikove kisline H2CO3.
Zgradbe karbonatnega iona se ne da pravilno opisati z njegovo Lewisovo zgradbo, ki skupino CO32− prikazuje z dvema daljšima enojnima vezema in eno krajšo dvojno vezjo:
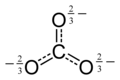
Za popoln opis karbonatnega iona je treba upoštevati njegove resonančne strukture
ki dajejo tri enakovredne in enako dolge vezi C-O:
Kemijske lastnosti
Karbonatne soli nastanejo s spajanjem pozitivno nabitih (kovinskih) kationov in negativno nabitih kisikovih atomov v karbonatnem anionu. Spojina je ionska.
- 2M+ + CO32− → M2CO3
- M2+ + CO32− → MCO3
- 2M3+ + 3 CO32− → M2(CO3)3
Večina karbonatov pri standardnih pogojih ni topna v vodi, ker je njihova konstanta topnosti manjša od 1•10−8. Izjeme so natrijev, kalijev in amonijev karbonat.
V vodnih rzaztopinah vlada med karbonatom, bikarbonatom in ogljikovim dioksidom oziroma ogljikovo kislino dinamično ravnotežje, ki ga zapišemo z naslednjo enačbo:
- CaCO3 + CO2 + H2O ⇋ Ca(HCO3)2
V močno bazičnih pogojih prevladuje karbonatni ion, v šibko bazičnih pogojih pa bikarbonatni ion. V bolj kislih pogojih prevladuje vodna raztopina ogljikovega dioksida, ki je v ravnotežju z ogljikovo kislino:
- CO2 + H2O ⇋ H2CO3
Ravnotežje je pomaknjeno močno v levo (proti ogljikovemu dioksidu), zato je natrijev karbonat (soda) bazičen, natrijev bikarbonat (soda bikarbona) rahlo bazičen, ogljikov dioksid (gazirane pijače) pa rahlo kisel.
V gaziranih pijačah je pod pritiskom raztopljen ogljikov dioksid. Ko se steklenica odpre, se ravnotežje med karbonati, bikarbonati in ogljikovim dioksidom poruši in se pomakne močno proti ogljikovemu dioksidu. Iz raztopine začnejo izhajati mehurčki ogljikovega dioksida, dokler njegova koncentracija v raztopini ne doseže njegove topnosti pri danem tlaku in temperaturi.
V živih organizmih uravnavajo pretvorbo CO2 v ogljikovo kislino encimi ogljikove anhidraze.
Kislo-bazična kemija
Karbonatni ion CO32− je srednje močna baza. Karbonat je konjugirana baza rahlo kislega hidrogenkarbonata HCO3−, ki je sam zmerno močna konjugirana baza rahlo kisle ogljikove kisline. Karbonatni ion kot tak poskuša v vodni raztopini vezati vodikove atome.
Organski karbonati
V organski kemiji se izraz karbonat lahko nanaša tudi na funkcionalno skupino, ki vsebuje ogljikov atom, vezan na tri kisikove atome. Ena od vezi je dvojna vez. Tovrstne spojine so zanane tudi kot organokarbonati ali karbonatni estri in imajo splošno formulo ROCOOR' oziroma RR'CO3. Pomembnejši organokarboati so dimetil karbonat, etilenkarbonat, propilenkarbonat in toksični trifosgen.
Pomen karbonatov v biologiji
Karbonati v krvi delujejo kot pufri. Če je pH krvi prenizek, je koncentracija vodikovih ionov previsoka in izločati se začne CO2. Reakcija se pomakne v levo, kar bistveno zniža koncentracijo H+ ionov in pH se poveča.
Če je pH previsok, je koncentracija H+ ionov v krvi prenizka in ledvice začnejo izločati bikarbonatni ion HCO3−. Reakcija se zato pomakne v desno. Koncentracija H+ ionov se bistveno poveča in pH se zmanjša.
Karbonati
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
Karbonati v vesolju
Med znanstveniki prevladuje mnenje, da je prisotnost karbonatov v kamninah trden dokaz za prisotnost tekoče vode. Nedavna opazovanja planetarne meglice NGC 6302 kažejo na prisotnost karbonatov v vesolju,[1] čeprav je kroženje vode, kakršno poznamo na Zemlji, zelo malo verjetno.
Raziskave Marsa z opazovanjem iz vesolja pa tudi na sami površini planeta niso odkrile večjih depozitov karbonatov, čeprav se jih v Marsovih meteoritskih kraterjih najde v manjših količinah. Talna voda bi se lahko nahajala v meteoritskem kraterju Gusev[2] in na Meridiani Planum.[3]