Supstitucija (hemija)
U supstitucionim reakcijama, funkcionalna grupa jednog hemijskog jedinjenja se zamenjuje drugom grupom.[1][2] U organskoj hemiji, reakcije elektrofilne i nukleofilne supstitucije imaju primarni značaj. Reakcije organske supstitucije se klasifikuju u nekoliko glavnih tipova organskih reakcija u zavisnosti od toga da li je reagens elektrofil ili nukleofil, da li je reakcioni intermedijar karbokatjon, karbanjon ili slobodni radikal, ili da li je supstrat alifatičan ili aromatičan. Detaljno razumevanje tipa reakcije pomaže u predviđanju produkta reakcije. To je takođe korisno za optimizaciju reakcije u pogledu promenljivih, kao što su temperatura i izvor rastvarača.
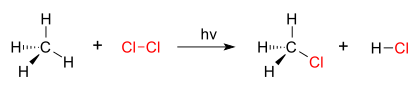
Dobar primer reakcije supstitucije je fotohemijska hlorinacija metana kojom se formira metil hlorid. Kada se hlorni gas (Cl2) ozrači, neki od molekula se cepaju na dva radikala hlora (Cl•), čiji su slobodni elektroni jako nukleofilni. Jedan od njih prekida kovalentnu vezu C–H u CH4 i grabi atom vodonika da bi formirao električni neutralni HCl. Drugi radikal reformiše kovalentnu vezu sa CH3• da bi formirao CH3Cl (metil hlorid).
| Hlorinacija metana hlorom |
|---|
Nukleofilna supstitucija
Nukleofilna supstitucija se odvija kad je reagens nukleofil (atom ili molekul sa slobodnim elektronima).[1][2] Nukleofil reaguje sa alifatičnim supstratom u reakciji nukleofilne alifatične supstitucija.[3][4] Ta supstitucija se može odvijati putem dva različita mehanizma: unimolekularna nukleofilna supstitucija (SN1) i bimolekularna nukleofilna supstitucija (SN2). SN1 mehanizam ima dva stupnja. U prvom stupnju, odlazeća grupa se udalji, čime se formira karbokatjon. U drugom stupnju, nukleofilni reagens napada karbokatjon i formira sigma vezu. Ovaj mehanizam može da proizvede bilo inverziju ili zadržavanje konfiguracije. SN2 reakcija ima samo jedan stupanj. Napad reagensa i uklanjanje odlazeće grupe se odvijaju istovremeno. Ovaj mehanizam uvek dovodi do inverzije konfiguracije.[5]
Kad je supstrat aromatično jedinjenje reakcioni tip je nukleofilna aromatična supstitucija. Derivati karboksilnih kiselina reaguju sa nukleofilima u nukleofilnoj acilnoj supstituciji.[6] Ova vrsta reakcije može biti korisna u pripremi jedinjenja.
Najopštiji oblik za reakciju može se dati kao
- Nuc: + R-LG → R-Nuc + LG:
gde R-LG označava supstrat. Elektronski par (:) iz nukleofila (Nuc:) napada supstrat (R-LG), formirajući novu kovalentnu vezu Nuc-R-LG. Prethodno stanje naelektrisanja se vraća kada odlazeća grupa (LG) ode sa elektronskim parom. Glavni proizvod u ovom slučaju je R-Nuc. U takvim reakcijama, nukleofil je obično električno neutralan ili negativno naelektrisan, dok je supstrat obično neutralan ili pozitivno naelektrisan.
Primer nukleofilne supstitucije je hidroliza alkil bromida, R-Br, pod baznim uslovima, gde je napadački nukleofil baza OH−, a odlazeća grupa je Br−:
- R-Br + OH− → R-OH + Br−
Reakcije nukleofilne supstitucije su uobičajene u organskoj hemiji i mogu se široko kategorisati kao da se odvijaju na ugljeniku zasićenog alifatičnog jedinjenja ugljenika ili (ređe) u aromatičnom ili drugom nezasićenom ugljenikovom centru.[1]
Mehanizmi
Nukleofilne supstitucije na alifatičnim ugljeničnim centrima mogu se odvijati pomoću dva različita mehanizma, unimolekularne nukleofilne supstitucije (SN1) i bimolekularne nukleofilne supstitucije (SN2).
Mehanizam SN1 ima dva koraka. U prvom koraku, odlazeća grupa odlazi, formirajući karbokatjon C+. U drugom koraku, nukleofilni reagens (Nuc:) se vezuje za karbokation i formira kovalentnu sigma vezu. Ako supstrat ima hiralni ugljenik, ovaj mehanizam može rezultirati ili inverzijom stereohemije ili zadržavanjem konfiguracije. Obično se i jedno i drugo javlja bez preferencije. Rezultat je racemizacija.
Mehanizam SN2 ima samo jedan korak. Napad reagensa i izbacivanje grupe koja odlazi se dešavaju istovremeno. Ovaj mehanizam uvek rezultira inverzijom konfiguracije. Ako je supstrat koji je pod nukleofilnim napadom hiralan, reakcija će stoga dovesti do inverzije njegove stereohemije, nazvane Valdenova inverzija.
SN2 napad se može desiti ako napad sa zadnji strane nije sterički ometan supstituentima na supstratu. Stoga se ovaj mehanizam obično javlja u neometanom primarnom centru ugljenika. Ako postoji sterično zakrčenje na supstratu u blizini odlazeće grupe, kao što je u tercijarnom centru ugljenika, supstitucija će uključivati SN1 a ne SN2 mehanizam; SN1 bi takođe bio verovatniji u ovom slučaju, jer bi se mogao formirati dovoljno stabilan karbokacioni posrednik.
Elektrofilna supstitucija
Elektrofili učestvuju u reakcijama elektrofilne supstitucije, a posebno u elektrofilnim aromatičnim supstitucijama.[7][8]
| Elektrofilna aromatična supstitucija |
|---|
Elektrofilne reakcije sa drugim nezasićenim jedinjenjima, osim arena, generalno dovode do elektrofilne adicije umesto supstitucije.
Radikalna zamena
Reakcija radikalne supstitucije uključuje radikale.[1] Primer je Hansdikerova reakcija.[9][10][11][12][13]
Organometalna supstitucija
Reakcije kuplovanja su klasa reakcija katalizovanih metalom koje uključuju organometalno jedinjenje RM i organski halid R′X koji zajedno reaguju da bi formirali jedinjenje tipa R-R′ sa formiranjem nove veze ugljenik-ugljenik. Primeri uključuju Hekovu reakciju, Ulmanovu reakciju i Vurc-Fitigovu reakciju. Postoje mnoge varijacije.[14]
Supstituisana jedinjenja
Supstituisana jedinjenja su hemijska jedinjenja u kojima je jedan ili više atoma vodonika u strukturi jezgra zamenjeno funkcionalnom grupom kao što je alkil, hidroksi ili halogen, ili sa većim supstituentskim grupama.
Na primer, benzen je jednostavan aromatični prsten. Benzeni koji su podvrgnuti supstituciji su heterogena grupa hemikalija sa širokim spektrom upotrebe i svojstava:
| Primeri supstituisanih jedinjenja benzena | ||
| jedinjenje | opšta formula | opšta struktura |
| Benzen | C6H6 | 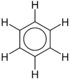 |
| Toluen | C6H5-CH3 |  |
| o-Ksilen | C6H4(-CH3)2 | 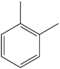 |
| Mesitilen | C6H3(-CH3)3 |  |
| Fenol | C6H5-OH | 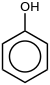 |
Vidi još
Reference
Literatura
Спољашње везе
- „Nucleophiles and Electrophiles”. butane.chem.uiuc.edu. Архивирано из оригинала 01. 08. 2020. г. Приступљено 2020-09-21.
- „Electrophile | chemistry”. Encyclopedia Britannica (на језику: енглески). Приступљено 2020-09-21.
- Aromatic Substitution Reactions – MSU