Itri
L'itri és l'element químic de símbol Y i nombre atòmic 39. És un metall de transició del grup 3 de la taula periòdica i de l'agrupament de les terres rares. Fou descobert pel químic finlandès Johan Gadolin el 1794, essent el primer element de les terres rares en ser descobert. A la naturalesa se'l troba en abundància als minerals bastnäsita-(Y) i xenotima-(Y), dels quals s'obté. Té importants aplicacions en la societat actual, hom els troba al làser YAG (granat sintètic d'itri i alumini), també emprat en joieria com a substitut del diamant; en el superconductor ; en els díodes emissors de llum o LEDs blancs; en les pantalles de cristall líquid o LCD i en les pantalles de plasma.
| Itri | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
39Y | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Blanc platejat  Línies espectrals de l'itri | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Itri, Y, 39 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 3, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 88,90585 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d1 5s2 2, 8, 18, 9, 2  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) | 4,472 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. | 4,24 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.799 K, 1.526 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.609 K, 3.336 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 11,42 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 365 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 26,53 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 3, 2, 1 (òxid bàsic feble) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,22 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 600 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.180 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 1.980 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 190±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (t. a.) (α, poli) 596 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 17,2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (t. a.) (α, poli) 10,6 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.300 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 63,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 25,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 41,2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,243 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-65-5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops de l'itri | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Història
El 1787, el químic i lloctinent de l'armada sueca Carl Axel Arrhenius trobà una roca negra pesada en una vella pedrera prop de la població sueca de Ytterby (actualment part de l'arxipèlag d'Estocolm).[2] Pensant que era un mineral desconegut que contenia un element acabat de descobrir el tungstè,[3] el va anomenar iterbita[nota 1] i envià mostres a químics per a la seva anàlisi.[2]

Johan Gadolin de l'Acadèmia d'Åbo identificà un nou òxid o "terra" a la mostra d'Arrhenius el 1789, i publicà l'anàlisi completa el 1794.[4][nota 2] Anders Gustaf Ekeberg confirmà el 1797 i anomenà el nou òxid itria.[5] Posteriorment Antoine Lavoisier desenvolupà la primera definició moderna d'element químic, es pensava que les terres podien reduir-se als seus elements, el que volia dir que el descobriment d'una nova terra volia dir el descobriment del nou element que hi havia dins, que en aquest cas hagués estat l'itri.[nota 3]
El 1843, Carl Gustav Mosander trobà que les mostres d'itria contenien tres òxids: blanc òxid d'itri (itria), groc òxid de terbi (que va ser anomenat de forma confusa erbia a l'època) i el rosat òxid d'erbi (anomenat terbia a l'època).[6] Un quart òxid, l'òxid d'iterbi, fou aïllat el 1878 per Jean-Charles Galissard de Marignac.[7] Nous elements foren aïllats de cada un d'aquests òxids posteriorment, i cada element fou anomenat d'alguna manera a partir d'Ytterby, el poble prop de la pedrera, iterbi, terbi i erbi.[8] Posteriorment se'n descobriren set nous metalls en la itria de Gadolin.[2] Com que l'itria era un mineral i no un òxid, Martin Heinrich Klaproth la reanomenà gadolinita en honor de Gadolin.[2]
El metall d'itri fou aïllat per primera vegada el 1828 quan Friedrich Wöhler escalfà clorur d'itri amb potassi:[9][10]

Fins als anys 20, s'usà el símbol químic Yt per aquest element, després s'utilitzà Y.[11]
El 1987, es troba l'òxid d'itri bari coure per aconseguir la superconductivitat d'alta temperatura.[12] Fou el segon material conegut que exhibí aquesta propietat,[12] i fou el primer material conegut en aconseguir la superconductivitat per sobre del (econòmicament important) punt d'ebullició del nitrogen.[nota 4]
Estat natural i obtenció
Quant a la seva abundància, l'itri es col·loca en la trentena posició en ordre decreixent, amb un 0,0029 % d'abundància en l'escorça terrestre (el qual el fa pràcticament tan profús com el cobalt, el coure o el zinc). Tanmateix, els seus composts presenten una gran importància tecnològica, el que ha dut a que, a causa de la sobreexplotació, la Comunitat Europea l'hagi declarat com un dels elements "en perill d'extinció" en els propers 100 anys.[13]

A la natura se'l troba formant desenes de minerals amb elevades proporcions. Els que superen un percentatge del 45 % són: Iimoriïta-(Y) 53,9 %, bastnäsita-(Y) 52,95 %, thalenita-(Y) 50,52 %, fluorthalenita-(Y) 50,33 %, xenotima-(Y) 48,35 %, kuliokita-(Y) 45,28 % i rowlandita-(Y) 45,26 %.[14] Són de gran importància minera la bastnäsita-(Y) i la xenotima-(Y).
A l'anàlisi dels aproximadament 300 kg de materials que les missions Apollo de la NASA dugueren de la Lluna s'ha determinat una relativament elevada quantitat d'itri.[15]
Se sol preparar comercialment de manera similar a com ho va fer Wöhler al segle xix, per reducció metalotèrmica de clorur d'itri amb calci:[13]

Propietats
Propietats físiques
L'itri és un metall platejat de densitat 4,469 g/cm³, punt de fusió 1522 °C i punt d'ebullició 3345 °C. És moderadament blan i és dúctil.[16] El metall és paramagnètic i té una susceptibilitat magnètica independent de la temperatura entre 10 i 300 K (−263 i 27 °C). Es converteix en superconductor a 1,3 K (−271,9 °C) a pressions superiors als 110 kilobars.[7]
L'itri existeix en dues formes al·lotròpiques (estructurals). La fase α és hexagonal compacta a temperatura ambient. La fase β és cúbica centrada en el cos a una temperatura de 1478 °C. La seva configuració electrònica és 
Propietats químiques

L'itri s'oxida lentament exposat a l'aire i es crema fàcilment per formar l'òxid d'itri de fórmula 



Reacciona fàcilment amb tots els halògens donant els corresponents halogenurs d'itri(3+):[17]






Altres composts d'itri que s'han descrit són: l'antimonur d'itri 













Isòtops
L'itri 89 és estable i és l'únic isòtop que es hom pot trobar de manera natural. S'han detectat un total de 33 radioisòtops (excloent els isòmers nuclears) de l'itri que van en nombre màssic de 77 a 109 i període de semidesintegració de 41 mil·lisegons (itri 108) fins a 106,63 dies (itri 88).[7]
Aplicacions

Indústria metal·lúrgica
L'itri s'afegeix a aliatges de magnesi i alumini amb la finalitat d'aportar protecció contra la corrosió. El granat sintètic YAG (acrònim de l'anglès yttrium aluminium garnet) de fórmula 
Indústria electrònica

L'itri té un ús destacat en la tecnologia dels díodes emissors de llum, o LEDs, de color blanc. També s'usa en els llums fluorescents per a produir una llum blanca intensa amb un estalvi important d'energia. L'itri, activat pel terbi, és usat com a material fosforescent (fosforòfor) blau i lila en la fabricació de pantalles de plasma i pantalles de cristall líquid LCD.[18]
Per altra banda, el granat d'itri i ferro o YIG (acrònim de l'anglès yttrium iron garnet) és l'òxid d'itri i ferro 
Medicina
Els làsers Nd:YVO₄-YAG (neodimi-itri-vanadat/itri-alumini-granat) són de gran utilitat en oftalmologia, dermatologia i otorrinolaringologia. L'isòtop radioactiu itri 90 és usat en el tractament dels càncers d'ossos, ovaris, pàncrees i de la leucèmia.[18]

 refredat amb nitrogen líquid a –196 °C
refredat amb nitrogen líquid a –196 °CJoieria
El granat de itri i alumini (YAG) presenta una duresa (8 en l'escala de Mohs) i aspecte similar a la del diamant (duresa 10 en l'escala de Mohs), sent usat en joieria. La seva estructura és igual a la dels granats naturals. Es poden obtenir YAGs acolorits afegint els dopants apropiats. Els liles tenen neodimi, terres rares en colors grocs i verds, erbi per a pedres roses, cobalt per blau i crom per verd.[19]
Altres camps
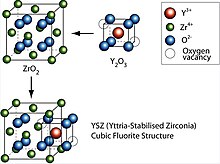
Un ús important de l'itri és en la fabricació de superconductors d'altes temperatures, com ara 
L'òxid d'itri i el de lantani són els substituts del tori en les camises dels llums de gas, perquè són resistents a la calor i donen una llum molt intensa quan s'escalfen.[18] També serveix com a precursor d'un bon nombre de materials de gran interès. Afegit a l'òxid de zirconi 
Vegeu també
Referències
Notes
Enllaços externs
| A Wikimedia Commons hi ha contingut multimèdia relatiu a: Itri |
- Los Alamos National Laboratory - Itri Arxivat 2005-04-08 a Wayback Machine. (anglès)
- webelements.com - Itri (anglès)
- environmentalchemistry.com - Itri (anglès)