Métal de transition
Un métal de transition, ou élément de transition, est, selon la définition de l'IUPAC, « un élément chimique dont les atomes ont une sous-couche électronique d incomplète, ou qui peuvent former des cations dont la sous-couche électronique d est incomplète[1] ». Cette définition correspond à des éléments partageant un ensemble de propriétés communes. Comme tous les métaux, ce sont de bons conducteurs de l'électricité. Ils sont solides dans les conditions normales de température et de pression, avec une masse volumique et une température de fusion élevées. Ils ont le plus souvent des propriétés catalytiques remarquables, aussi bien sous leur forme atomique que sous leur forme ionique. Ils peuvent former une grande variété d'espèces ioniques dans une gamme d'états d'oxydation étendue, grâce à la faible différence d'énergie entre ces différents états d'oxydation, ce qui donne lieu à des complexes diversement colorés en raison des différentes transitions électroniques au sein de la sous-couche d incomplète. Ils sont également susceptibles de former de nombreux composés paramagnétiques sous l'effet d'électrons non appariés dans la sous-couche d.
La définition de l'IUPAC conduit à ranger comme métaux de transition les éléments des groupes 3 à 11 du tableau périodique — y compris la plupart des lanthanides et des actinides — tandis que les éléments du groupe 12 — zinc 30Zn, cadmium 48Cd, mercure 80Hg et copernicium 112Cn — en sont exclus : ces derniers forment en effet des liaisons avec les électrons de leur sous-couche ns, où n est le numéro de la période, laissant leur sous-couche (n – 1)d complète, avec 10 électrons. En pratique, et par commodité, les manuels et de très nombreux ouvrages incluent les éléments du groupe 12 parmi les métaux de transition bien qu'ils ne répondent pas à la définition de l'IUPAC, ce qui permet d'assimiler les métaux de transition aux éléments du bloc d hors lanthanides et actinides ; ces derniers, qui répondent pour la plupart à la définition de l'IUPAC, sont parfois qualifiés de métaux de transition internes, mais ne sont généralement pas présentés comme des métaux de transition.
Sur la 6e période, l'appartenance formelle du mercure à la famille des métaux de transition pourrait être établie par l'existence d'un composé à l'état d'oxydation supérieur à 2, mobilisant alors au moins un électron de la couche 5d. C'est précisément le cas du fluorure de mercure(IV) HgF4, à l'état d'oxydation +4, observé en 2007 dans une matrice cryogénique de néon et d'argon à 4 K[2] ; ce composé n'a cependant pas été observé l'année suivante lors d'une expérience semblable[3], tandis que certains auteurs soulignent que, n'étant observable que dans des conditions hors équilibre[4], il serait peu représentatif de la chimie de cet élément, qui devrait par conséquent être considéré comme un métal pauvre. Sur la 7e période, le copernicium 112Cn serait en revanche probablement un métal de transition, en raison d'effets relativistes stabilisant les orbitales 7s au détriment des orbitales 6d : l'ion Cn2+ aurait ainsi une configuration [Rn] 5f14 6d8 7s2, avec par conséquent une sous-couche 6d incomplète. En solution aqueuse, il serait à l'état d'oxydation +2, voire +4[5].
- Métaux du groupe du platine, éléments de transition typiques
- Ruthénium 44Ru.
- Rhodium 45Rh.
- Palladium 46Pd.
- Rhénium 75Re.
- Osmium 76Os.
- Iridium 77Ir.
- Platine 78.
La distribution des éléments du bloc d dans les différentes familles d'éléments chimiques peut être résumée par le tableau suivant :
Configuration électronique
Les métaux de transition sont des éléments du bloc d qui remplissent progressivement une sous-couche électronique d à la suite d'une sous-couche s saturée, conformément à la règle de Klechkowski. Cette règle permet d'expliquer la configuration électronique d'un peu plus de 80 % des éléments chimiques ; les quelque 20 % restants se trouvent précisément parmi les métaux de transition, les lanthanides, et les actinides : c'est le cas des deux premiers éléments du groupe 6 et des trois premiers du groupe 11, pour lesquels une configuration de type s1 d5 ou s1 d10 est énergétiquement plus favorable que la configuration de type s2 d4 ou s2 d9 ; cette configuration particulière est également observée pour certains éléments adjacents aux groupes 6 et 11 ; la configuration électronique exacte à l'état fondamental des métaux de transition de la septième période (transactinides) reste trop mal connue pour y caractériser de telles exceptions :
Élément Masse
atomiqueTempérature
de fusionTempérature
d'ébullitionMasse
volumiqueRayon
atomiqueConfiguration
électronique[6]Énergie
d'ionisationÉlectronégativité
(Pauling)Scandium 44,955 908(5) u 1 541 °C 2 836 °C 2,985 g·cm-3 162 pm [Ar] 4s2 3d1 633,1 kJ·mol-1 1,36 Titane 47,867(1) u 1 668 °C 3 287 °C 4,506 g·cm-3 147 pm [Ar] 4s2 3d2 658,8 kJ·mol-1 1,54 Vanadium 50,941 5(1) u 1 910 °C 3 407 °C 6,0 g·cm-3 134 pm [Ar] 4s2 3d3 650,9 kJ·mol-1 1,63 Chrome 51,996 1(6) u 1 907 °C 2 671 °C 7,19 g·cm-3 128 pm [Ar] 4s1 3d5 ( * ) 652,9 kJ·mol-1 1,66 Manganèse 54,938 044 u 1 246 °C 2 061 °C 7,21 g·cm-3 127 pm [Ar] 4s2 3d5 717,3 kJ·mol-1 1,55 Fer 55,845(2) u 1 538 °C 2 862 °C 7,874 g·cm-3 126 pm [Ar] 4s2 3d6 762,5 kJ·mol-1 1,83 Cobalt 58,933 194 u 1 495 °C 2 927 °C 8,90 g·cm-3 125 pm [Ar] 4s2 3d7 760,4 kJ·mol-1 1,88 Nickel 58,693 4(4) u 1 455 °C 2 730 °C 8,908 g·cm-3 124 pm [Ar] 4s2 3d8 ou 4s1 3d9 ( ** ) 737,1 kJ·mol-1 1,91 Cuivre 63,546(3) u 1 085 °C 2 562 °C 8,96 g·cm-3 128 pm [Ar] 4s1 3d10 ( * ) 745,5 kJ·mol-1 1,90 Yttrium 88,905 84 u 1 526 °C 2 930 °C 4,472 g·cm-3 180 pm [Kr] 5s2 4d1 600 kJ·mol-1 1,22 Zirconium 91,224(2) u 1 855 °C 4 377 °C 6,52 g·cm-3 160 pm [Kr] 5s2 4d2 640,1 kJ·mol-1 1,33 Niobium 92,906 37 u 2 477 °C 4 744 °C 8,57 g·cm-3 146 pm [Kr] 5s1 4d4 ( * ) 652,1 kJ·mol-1 1,6 Molybdène 95,95(1) u 2 623 °C 4 639 °C 10,28 g·cm-3 139 pm [Kr] 5s1 4d5 ( * ) 684,3 kJ·mol-1 2,16 Technétium [98] 2 157 °C 4 265 °C 11 g·cm-3 136 pm [Kr] 5s2 4d5 702 kJ·mol-1 1,9 Ruthénium 101,07(2) u 2 334 °C 4 150 °C 12,45 g·cm-3 134 pm [Kr] 5s1 4d7 ( * ) 710,2 kJ·mol-1 2,2 Rhodium 102,905 50 u 1 964 °C 3 695 °C 12,41 g·cm-3 134 pm [Kr] 5s1 4d8 ( * ) 719,7 kJ·mol-1 2,28 Palladium 106,42(1) u 1 555 °C 2 963 °C 12,023 g·cm-3 137 pm [Kr] 4d10 ( * ) 804,4 kJ·mol-1 2,20 Argent 107,868 2(2) u 962 °C 2 162 °C 10,49 g·cm-3 144 pm [Kr] 5s1 4d10 ( * ) 731,0 kJ·mol-1 1,93 Hafnium 178,49(2) u 2 233 °C 4 603 °C 13,31 g·cm-3 159 pm [Xe] 6s2 4f14 5d2 658,5 kJ·mol-1 1,3 Tantale 180,947 88 u 3 017 °C 5 458 °C 16,69 g·cm-3 146 pm [Xe] 6s2 4f14 5d3 761 kJ·mol-1 1,5 Tungstène 183,84(1) u 3 422 °C 5 930 °C 19,25 g·cm-3 139 pm [Xe] 6s2 4f14 5d4 770 kJ·mol-1 2,36 Rhénium 186,207(1) u 3 186 °C 5 630 °C 21,02 g·cm-3 137 pm [Xe] 6s2 4f14 5d5 760 kJ·mol-1 1,9 Osmium 190,23(3) u 3 033 °C 5 012 °C 22,59 g·cm-3 135 pm [Xe] 6s2 4f14 5d6 840 kJ·mol-1 2,2 Iridium 192,217(3) u 2 446 °C 4 130 °C 22,56 g·cm-3 136 pm [Xe] 6s2 4f14 5d7 880 kJ·mol-1 2,20 Platine 195,084(9) u 1 768 °C 3 825 °C 21,45 g·cm-3 139 pm [Xe] 6s1 4f14 5d9 ( * ) 870 kJ·mol-1 2,28 Or 196,966 569 u 1 064 °C 1 948 °C 19,30 g·cm-3 144 pm [Xe] 6s1 4f14 5d10 ( * ) 890,1 kJ·mol-1 2,54 Rutherfordium [267] 2 100 °C 5 500 °C 23,2 g·cm-3 150 pm [Rn] 7s2 5f14 6d2 579,9 kJ·mol-1 — Dubnium [268] — — 29,3 g·cm-3 139 pm [Rn] 7s2 5f14 6d3 656,1 kJ·mol-1 — Seaborgium [269] — — 35,0 g·cm-3 132 pm [Rn] 7s2 5f14 6d4 752,6 kJ·mol-1 — Bohrium [270] — — 37,1 g·cm-3 128 pm [Rn] 7s2 5f14 6d5 742,9 kJ·mol-1 — Hassium [277] — — 41 g·cm-3 134 pm [Rn] 7s2 5f14 6d6 733,3 kJ·mol-1 — Copernicium [285] — — 23,7 g·cm-3 147 pm [Rn] 7s2 5f14 6d10 1 154,9 kJ·mol-1 —
- ( * ) Exceptions à la règle de Klechkowski :
- Période no 4 : chrome 24Cr, nickel 28Ni, cuivre 29Cu ;
- Période no 5 : niobium 41Nb, molybdène 42Mo, ruthénium 44Ru, rhodium 45Rh ;palladium 46Pd, argent 47Ag ;
- Période no 6 : platine 78Pt, or 79Au.
- ( ** ) Le nickel présente en réalité deux configurations électroniques correspondant à des énergies totales qui se recouvrent. Les manuels notent généralement la configuration régulière [Ar] 4s2 3d8, étayée par les données expérimentales, car elle contient le niveau d'énergie le moins élevé. Cependant, c'est la configuration irrégulière [Ar] 4s1 3d9 qui présente l'énergie moyenne la moins élevée des deux, de sorte que cette configuration est souvent retenue dans les calculs.
Les orbitales électroniques (n – 1)d des métaux de transition jouent un rôle bien plus important que les orbitales (n – 1)p et ns, car ces dernières demeurent à peu près constantes le long d'une période tandis que la première se remplit progressivement. Ces orbitales d sont responsables des propriétés magnétiques de ces éléments, de la variété de leurs états d'oxydation et des couleurs associées à leurs différents composés ioniques. En revanche, les électrons de valence des éléments de transition d'une même période conservent à peu près la même configuration d'un groupe à l'autre, ce qui explique la forte similitude des propriétés des métaux de transition le long d'une même période.
États d'oxydation
Contrairement aux deux premiers groupes du tableau périodique (les métaux alcalins et les métaux alcalino-terreux), les métaux de transition (notamment des groupes 4 à 11) peuvent former des ions avec une grande variété d'états d'oxydation. Les métaux alcalino-terreux tels que le calcium sont stables à l'état d'oxydation +2, alors qu'un métal de transition peut adopter des degrés d'oxydation de -3 à +8. On peut en comprendre la raison en étudiant les potentiels d'ionisation des éléments des deux familles. L'énergie requise pour enlever un électron du calcium est faible jusqu'à ce qu'on commence à enlever des électrons sous les deux électrons de sa sous-couche 4s. En fait, Ca3+ a une telle énergie d'ionisation qu'il n'existe pas naturellement. En revanche, avec un élément comme le vanadium, on observe une augmentation linéaire de l'énergie d'ionisation entre les orbitales s et d, ce qui est dû à la très faible différence énergétique entre les sous-couches 3d et 4s. Ainsi, un élément comme le manganèse, avec une configuration [Ar] 4s2 3d5, peut perdre sept électrons et atteindre l'état d'oxydation +7, tandis que le ruthénium et l'osmium atteignent couramment l'état d'oxydation +8 :
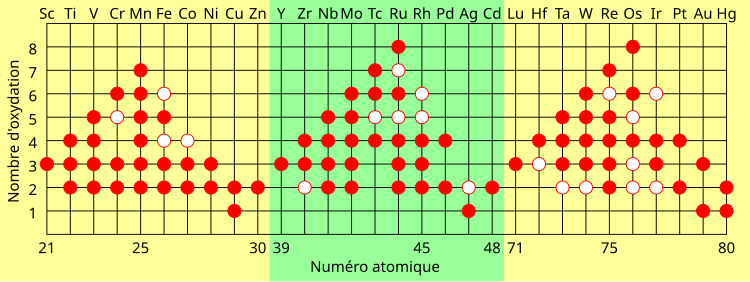
Certaines tendances dans les propriétés des métaux de transition peuvent être observées le long d'une période :
Couleurs des complexes de métaux de transition

- Nitrate de cobalt(II) Co(NO3)2 (rouge)
- Dichromate de potassium K2Cr2O7 (orange)
- Chromate de potassium K2CrO4 (jaune)
- Chlorure de nickel(II) NiCl2 (vert)
- Sulfate de cuivre(II) CuSO4 (bleu)
- Permanganate de potassium KMnO4 (violet)
Compte tenu de leur grande variété d'états d'oxydation et donc de configurations électroniques, les métaux de transition forment des composés aux couleurs les plus variées. Tout le spectre visible est couvert, la couleur d'un élément donné dépendant aussi de son état d'oxydation : ainsi le manganèse à l'état d'oxydation +7 est violet (permanganate de potassium) tandis que l'ion Mn2+ est rose pâle.
La coordination d'un ligand est susceptible de modifier les niveaux d'énergie des orbitales d et donc la couleur des composés d'un métal de transition donné.
Les facteurs déterminant la couleur d'un complexe sont :
- la nature de l'ion métallique, en particulier le nombre d'électrons de l'orbitale d dans la couche de valence ;
- la nature des ligands autour de l'ion métallique, ce qui conditionne l'effet sur les niveaux d'énergie des orbitales d ;
- la géométrie de ces ligands autour de l'ion métallique, car des diastéréoisomères peuvent avoir des couleurs différentes.
Propriétés
Les métaux de transition sont tous des métaux conduisant l'électricité et ils présentent pour certains une toxicité élevée, voire très élevée[7]. Sous forme particulaire ils contribuent à la pollution de l'air[8].
Les métaux de transition ont en général une densité ainsi qu'une température de fusion et de vaporisation élevées, sauf ceux du groupe 12, qui ont au contraire un point de fusion assez bas : le mercure est ainsi liquide au-dessus de −38,8 °C et le copernicium serait peut-être même gazeux à température ambiante. Ces propriétés proviennent de la capacité des électrons de la sous-couche d à se délocaliser dans le réseau métallique. Dans les substances métalliques, plus le nombre d'électrons partagés entre les noyaux est grand, plus grande est la cohésion du métal.
Certains métaux de transition forment de bons catalyseurs homogènes et hétérogènes (éventuellement en nanoparticules[9],[10] ou sous forme colloïdale[11]). Par exemple, le fer est un catalyseur dans le procédé Haber, le nickel et le platine sont utilisés dans l'hydrogénation des alcènes.
Le groupe du platine constitue un ensemble important de métaux de transitions aux propriétés remarquables, qui en font d'excellents catalyseurs aux applications stratégiques.
Les métaux de transition, en tant que catalyseurs contribuent à la production de sulfates dans les nuages et certains smogs (humides et hivernaux, en présence de NO2 et sans passer par la voie photochimique qui nécessite du soleil)[12].
Ils peuvent entrer dans la composition de semi-conducteurs[13],[14].
Des métaux de transitions d'origine anthropiques sont dispersés à grande échelle dans l'environnement terrestre et aquatique[15] par l'industrie, par diverses activités humaines (orpaillage par exemple), par les pots catalytiques (métaux du groupe du platine) et par les avions à réaction. Certains chélateurs se fixent préférentiellement sur certains de ces métaux, ils peuvent contribuer à soigner des intoxications ou dépolluer des sols ou sédiments[16].
Notes et références
Voir aussi
Articles connexes
Liens externes
- UICPA : Page de liens vers le tableau périodique
- UICPA : Tableau périodique officiel du 22/06/2007
Bibliographie
- Beer P.D (1998). Transition-metal receptor systems for the selective recognition and sensing of anionic guest species. Accounts of chemical research, 31(2), 71-80.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |







