Cloroformo
O cloroformo ou triclorometano (abreviado TCM) é un composto orgánico coa fórmula CHCl
3 e un solvente común. É un líquido denso, moi volátil, incoloro e de forte cheiro producido a grande escala como precursor de refrixerantes e PTFE (politetrafluoroetileno).[6] O cloroformo é un trihalometano que funciona como un potente anestésico, euforizante, ansiolítico e sedante cando é inhalado ou inxerido. O cloroformo foi utilizado como anestésico en parte do século XIX e a primeira metade do século XX.[7][8] É miscible en moitos solventes, mais só é lixeiramente soluble en auga (só 8 g/L a 20 °C).
| Cloroformo | |
|---|---|
 |  |
 | |
Outros nomes PIN:: Tricloroetano | |
| Identificadores | |
| Abreviaturas | R-20, TCM |
| Número CAS | 67-66-3 |
| PubChem | 6212 |
| ChemSpider | 5977 |
| UNII | 7V31YC746X |
| Número CE | 200-663-8 |
| Número UN | 1888 |
| KEGG | C13827 |
| ChEBI | CHEBI:35255 |
| ChEMBL | CHEMBL44618 |
| Número RTECS | FS9100000 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | CHCl3 |
| Masa molar | 119,38 g mol−1 |
| Aspecto | Líquido incoloro moi refractivo |
| Olor | Doce, mentolado, agradable |
| Densidade | 1,564 g/cm3 (−20 °C) 1,489 g/cm3 (25 °C) 1,394 g/cm3 (60 °C) |
| Punto de fusión | −635 °C; −1 111 °F; −362 K |
| Punto de ebulición | 6 115 °C; 11 039 °F; 6 388 K |
| Solubilidade en auga | 10,62 g/L (0 °C) 8,09 g/L (20 °C) 7,32 g/L (60 °C) |
| Solubilidade | Soluble en benceno Miscible en éter dietílico, aceites, ligroína, etanol, CCl4, CS2 |
| Solubilidade en acetona | ≥ 100 g/L (19 °C) |
| Solubilidade en dimetil sulfóxido | ≥ 100 g/L (19 °C) |
| Presión de vapor | 0,62 kPa (−40 °C) 7,89 kPa (0 °C) 25,9 kPa (25 °C) 313 kPa (100 °C) 2,26 MPa (200 °C) |
| kH | 3,67 L·atm/mol (24 °C) |
| Acidez (pKa) | 15,7 (20 °C) |
| Estrutura | |
| Forma da molécula | Tetraédrica |
| Momento dipolar | 1,15 D |
| Termoquímica | |
| Entalpía estándar de formación ΔfH | −134,3 kJ/mol |
| Entalpía estándar de combustión ΔcH | 473,21 kJ/mol |
| Entropía molar estándar S | 202,9 J/(mol·K) |
| Capacidade calorífica, C | 114,25 J/(mol·K) |
| Perigosidade | |
| Pictogramas GHS |    |
| Palabra sinal GHS | Danger (perigo) |
| Principais perigos | Decomponse dando o extremadamente tóxico fosxeno e cloruro de hidróxeno en presenza de luz – grupo 2B da IARC – Toxicidade reprodutiva – Toxicidade específica de órgano diana (STOT)[2][3][4] |
| NFPA 704 | |
| Punto de inflamabilidade | Non inflamable |
| LD50 | 704 mg/kg (rato, dérmico)[5] |
| Compostos relacionados | |
| Compostos relacionados | Cloroformo deuterado CDCl 3, clorometano CH 3Cl, diclorometano CH 2Cl 2,tetraclorometano CCl 4, fluoroformo CHF 3, bromoformo CHBr 3, iodoformo CHI 3, clorodifluorometano CHF 2Cl, diclorofluorometano CHFCl 2, bromodiclorometano CHCl 2Br, dibromoclorometano CHClBr 2, bromodifluorometano CHF 2Br, dibromofluorometano CHFBr 2 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Estrutura e nome
A molécula adopta unha xeometría molecular tetraédrica con simetría C3v.[9] A molécula de cloroformo pode considerarse unha molécula de metano con tres dos seus átomos de hidróxeno cambiados por tres átomos de cloro, que conserva o cuarto átomo de hidróxeno.
O nome "cloroformo" é un nome composto formado a partir de tercloruro (cloruro terciario, un tricloruro) e formilo, un nome obsoleto do radical metilideno (CH) derivado do ácido fórmico.
Distribución natural
O fluxo global total de cloroformo no medio ambiente é de aproximadamente 660 000 toneladas por ano,[10] e un 90 % das emisións son de orixe natural. Moitos tipos de algas producen cloroformo, e os fungos crese que producen cloroformo no solo.[11] Tamén se cre que os procesos abióticos contribúen á produción natural de cloroforo no solo, pero o mecanismo aínda non está claro.[12]
Como o cloroformo é un composto orgánico volátil,[13] disípase rapidamente do solo e da superficie da auga e sofre unha degradación no aire producindo fosxeno, diclorometano, cloruro de formilo, monóxido de carbono, dióxido de carbono e cloruro de hidróxeno. A súa vida media no aire oscila entre 55 e 620 días. A biodegradación na auga e o solo é lenta. O cloroformo non se bioacumula significativamente en organismos acuáticos.[14]
Historia
O cloroformo foi sintetizado independentemente por varios investigadores contra o ano 1831:
- Moldenhawer, un farmacéutico alemán de Frankfurt an der Oder, parece que conseguira producir cloroformo en 1830 ao mesturar cal clorado con etanol; porén, confundiuno con Chloräther (éter clórico, 1,2-dicloroetano).[15][16]
- Samuel Guthrie, un médico estadounidense de Sackets Harbor, Nova York, tamén parece que producir cloroformo en 1831 facendo reaccionar cal clorado con etanol, e decatouse das súas propiedades anestésicas, pero tamén pensaba que preparara éter clórico.[17][18][19]
- Justus von Liebig levou a cabo a clivaxe alcalina do cloral. Liebig afirmou incorrectamente que a fórmula empírica do cloroformo era C
2Cl
5 e nomeouno como "Chlorkohlenstoff" ("cloruro de carbono").[20][21] - Eugène Soubeiran obtivo o composto pola acción da lixivia de cloro sobre o etanol e a acetona.[22]
En 1834 o químico francés Jean-Baptiste Dumas determinou a fórmula empírica do cloroformo e deulle nome: "Así, paréceme que a substancia que analicei … ten a fórmula: C2H2Cl6.". [Nota: Os coeficientes desta fórmula empírica deberían dividirse por 2.] ... "Isto causou que lle puxese o nome "cloroformo" a esta substancia [é dicir, cloruro de formilo ou cloruro de ácido fórmico]."[23]
En 1835 Dumas preparou a substancia por clivaxe alcalina de ácido tricloroacético.
En 1842 Robert Mortimer Glover en Londres descubriu as cualidades anestésicas do cloroformo en animais de laboratorio.[24]
En 1847 o obstetra escocés James Y. Simpson foi o primeiro en demostrar as propiedades anestésicas do cloroformo en humanos, proporcionado polo farmacéutico local William Flockhart de Duncan, Flockhart e compañía,[25] e axudou a popularizalo para o seu uso en medicina.[26]
Na década de 1850 o cloroformo producíase xa comercialmente. Nas Illas Británicas producíanse unhas 750 000 doses por semana en 1895,[27] usando o procedemento de Liebig, que seguiu sendo importante ata a década de 1960. Hoxe, o cloroformo (xunto co diclorometano) prepárase exclusivamente e a escala masiva pola cloración de metano e clorometano.[6]
Produción
Industrialmente, o cloroformo prodúcese quentando unha mestura de cloro e cloruro de metilo (CH
3Cl) ou ben de metano (CH
4).[6] A 400–500 °C, ocorre unha haloxenación de radicais libres, convertendo estes precursores en compostos progresivamente máis clorados:
O cloroformo sofre unha cloración adicional rendendo tetracloruro de carbono (CCl
4):
- CHCl
3 + Cl
2 → CCl
4 + HCl
O resultado deste proceso é unha mestura de catro clorometanos, que son: clorometano, cloruro de metileno (diclorometano), triclorometano (cloroformo) e tetraclorometano (tetracloruro de carbono). Estes poden separarse por destilación.[6]
O cloroformo pode tamén producirse a pequena escala por medio dunha reacción de haloforma entre a acetona e o hipoclorito de sodio:
- 3 NaOCl + (CH
3)
2CO → CHCl
3 + 2 NaOH + CH
3COONa
Deuterocloroformo
O cloroformo deuterado é un isotopólogo do cloroformo cun só átomo de deuterio. O CDCl
3 é un solvente común usado en espectroscopia NMR. O deuterocloroformo prodúcese pola reacción da hexacloroacetona con auga pesada.[28] O proceso da haloforma está agora obsoleto para a produción de cloroformo ordinario. O deuterocloroformo pode tamén prepararse facendo reaccionar deuteróxido de sodio con hidrato de cloral.[29][30]
Formación inadvertida de cloroforomo
A reacción de haloforma pode tamén ocorrer inadvertidamente en ambientes domésticos. Limpar ou remollar en lixivia con hipoclorito xera compostos haloxenados en reaccións colaterais; o cloroforomo é o principal subproduto.[31] A solución de hipoclorito de sodio (lixivia de cloro) mesturada con líquidos comúns nas casas como acetona, metil etil cetona, etanol ou alcohol isopropílico pode producir algo de cloroformo, ademais doutros compostos, como cloroacetona ou dicloroacetona.[Cómpre referencia]
Usos
A grande escala, a reacción máis importante do cloroformo é co fluoruro de hidróxeno para dar monoclorodifluorometano (HCFC-22), un precursor na produción de politetrafluoroetileno (Teflón) e outros fluoropolímeros:[6]
- CHCl
3 + 2 HF → CHClF
2 + 2 HCl
A reacción realízase en presenza dunha cantidade catalítica de haluros de antimonio mesturados. O clorodifluorometano é despois convertido a tetrafluoroetileno, o precursor principal do Teflón.[32]
Solvente
O hidróxeno unido ao carbono na molécula de cloroforomo participa na formación de enlaces de hidróxeno,[33][34] o que fai que sexa un bo solvente para moitos materiais.
En todo o mundo o cloroformo utilízase en formulacións de pesticidas, como solvente para lípidos, goma, alcaloides, ceras, gutapercha, e resinas, como axente limpador, como fumigante de grans de cereais, en extintores de lume, e na industria do caucho.[14][35] O CDCl
3 é un solvente común usado na espectroscopia NMR.[36]
Refrixerante
O cloroformo utilízase como precursor para facer R-22 (clorodifluorometano). Isto faise ao facelo reaccionar cunha solución de ácido fluorhídrico (HF) que fluorura a molécula de CHCl
3 e libera ácido clorhídrico como subproduto.[37] Antes de que entrase en vigor o Protocolo de Montreal, a maioría do cloroformo producido en países como os Estados Unidos usábase na produción de clorodifluorometano. Porén, a súa produción permanece alta, xa que é un precursor clave do PTFE (politetrafluoroetileno).[38]
Aínda que o cloroformo ten propiedades como o seu baixo punto de ebulición e un baixo potencial de quecemento global, que é de só 31 (comparado co 1760 do R-22), as cales son propiedades atractivas para un refrixerante, hai pouca información que suxira que teña un uso amplo como refrixerante nalgún produto de consumo.[39]
Ácido de Lewis
En solventes como CCl
4 e alcanos, o cloroforomo establece enlaces de hidróxeno con diversas bases de Lewis. O HCCl
3 clasifícase como un ácido duro, e o modelo ECW sinala os seus parámetros de ácido como EA = 1,56 e CA = 0,44.
Reactivo
Como reactivo, o cloroformo serve como fonte do intermediario do diclorocarbeno CCl
2.[40] Reacciona con hidróxido de sodio acuoso, xeralmente en presenza dun catalizador de transferencia de fase, para producir diclorocarbeno, CCl
2.[41][42] Este reactivo efectúa a ortoformilación de aneis aomáticos activados, como os fenois, producindo aril aldehidos nunha reacción coñecida como reacción de Reimer–Tiemann. Alternativamente, o carbeno pode ser atrapado por un alqueno para formar un derivado do ciclopropano. Na adición de Kharasch o cloroformo forma o radical libre •CHCl
2, que se engade a alquenos.[43]
Anestésico

As cualidades anestésicas do cloroforomo foron descritas por primeira ve en 1842 nunha tese de Robert Mortimer Glover, que gañou a medalla de ouro da Sociedade Harveyana dese ano.[44][45] Glover tamén realizou experimentos con cans para probar as súas teorías, refinándoas, e presentádoas na súa tese de doutoramento na Universidade de Edinburgo no verán de 1847.
O obstetra escocés James Young Simpson foi unha das persoas ás que se lle pediu ler a mencionada tese, pero posteriormente dixo que nunca a lera e que chegara ás súas propias conclusións independentemente.[Cómpre referencia] O 4 de novembro de 1847, Simpson afirmou que descubrira as cualidades anestésicas do cloroformo en humanos. El e dous colegas entretivéronse probando os efectos de varias substancias e así revelaron o potencial que tiña o cloroforomo en procedementos médicos.[25]

Uns poucos días despois, durante un procedemento odontolóxico en Edinburgo, Francis Brodie Imlach foi a primeira persoa que usou o cloroformo cun paciente nun contexto clínico.[46]
En maio de 1848, Robert Halliday Gunning fixo unha presentción na Sociedade Médico-Cirúrxica de Edinburgo despois dunha serie de experimentos de laboratorio con coellos que confirmaron os descubrimentos de Glover e tamén refutou as pretensións de Simpson de orixinalidade. Os experimentos de laboratorio que probaron os perigos do cloroformo foron en gran medida ignorados.[47]
O uso do cloroforomo durante as operacións cirúrxicas estendeuse rapidamente en Europa; por exemplo na década de 1850 o cloroformo foi usado polo médico John Snow durante os nacementos dos dous últimos fillos da raíña Vitoria, Leopoldo e Beatriz.[48] Nos Estados Unidos o cloroforomo empezou a substituír o éter como anestésico a principios do século XX;[Cómpre referencia] e foi sendo abandonado en favor do éter ao descubrirse a súa toxicidade, especialmente a súa tendencia a causar arritmias cardíacas mortais análogas ao que hoxe se denomina "morte súbita do inhalante". Algunhas persoas usaban o cloroformo como unha droga recreativa ou para intentar suicidarse.[49] Un posible mecanismo de acción do coloroformo é que incrementa o movemento de ións potasio a través de certos tipos de canles de potasio en neuronas.[50] O cloroformo podía tamén ser mesturado con outros axentes anestésicos como o éter para facer unha mestura C.E. (cloroformo-éter), ou con éter e alcohol para facer unha mestura A.C.E. (alcohol-cloroformo-éter).[51]
En 1848 Hannah Greener, unha moza de 15 anos á que lle extirparan unha uña do pé infectada, morreu despois de que lle administraran o anestésico.[52] A súa autopsia para establecer a causa da morte realizouna John Fife axudado por Robert Mortimer Glover.[24] Varios pacientes en boas condicións físicas morreron despois de inhalalo. Porén, en 1848, John Snow desenvolveu un inhalador que regulaba a dose e así reduciuse o número de mortes.[53]
Os opoñentes e partidarios do uso do cloroformo discrepaban na cuestión de se as complicacións médicas se debían a un trastorno respiratorio ou se o cloroforomo tiña un efecto específico sobre o corazón. Entre 1864 e 1910, numerosas comisións en Gran Bretaña estudaron o cloroformo pero non chegaron a ningunha conclusión clara. Non foi ata 1911 que Levy probou en experimentos con animais que o cloroformo causa fibrilación ventricular.[Cómpre referencia] Malia isto, entre 1865 e 1920, o cloroforomo utilizouse no 80-95 % de todas as narcoses realizadas no Reino Unido e os países de fala alemá. En Alemaña, as avaliacións completas da taxa de mortalidade durante a anestesia fíxoas Gurlt entre 1890 e 1897.[Cómpre referencia] Ao mesmo tempo no Reino Unido a revista médica The Lancet levou a cabo un cuestionario avaliador[54] e compilou un informe detallando numerosas reaccións adversas aos anestésicos, incluíndo o cloroforomo.[55] En 1934, Killian xuntou todas as estatísticas compiladas ata entón e atopou que as posibilidades de sufrir complicacións mortais baixo os efectos do éter estaban entre 1:14.000 e 1:28.000, mentres que co cloroformo as posiilidades estaban entre 1:3.000 e 1:6.000.[Cómpre referencia] O aumento do uso da anestesia por gas usando óxido nitroso, a mellora dos equipos usados para administrar os anestésicos, e o descubrimento do hexobarbital en 1932 levou a un declive gradual da narcose por coloroformo.[56]
O último uso anestésico do cloroformo do que hai informes no mundo occidental data de 1987, cando o último doutor que o utilizaba se xubilou, 140 anos despois do seu primeiro uso.[57]
Uso criminal
O cloroformo utilizárono os criminais para deixar inconsciente, durmir ou mesmo asasinar as súas vítimas. Algúns exemplos son: Joseph Harris foi acusado en 1894 de usar cloroformo para roubar a persoas.[58] O asasino en serie H. H. Holmes usaba sobredoses de cloroformo para matar as súas vítimas femininas. En setembro de 1900 o cloroformo foi implicado no asasinato do home de negocios estadounidense William Marsh Rice. O cloroformo foi considerado un factor no presunto asasinato dunha muller en 1991, que foi asfixiada mentres durmía.[59] En 2002, a adolescente de 13 anos Kacie Woody foi sedada con cloroformo cando foi secuestrada e retida por David Fuller, antes de ser asasinada por un disparo.[60] Nunha sentenza de conformidade de 2007 un home confesou ter usado armas atordadoras e cloroformo para realizar ataques sexuais a menores.[61]
O uso do cloroformo como axente incapacitante foi amplamente popularizado pola literatura de ficción, ata chegar a ser case un cliché, ao ser adoptado polos autores de obras de xénero policíaco nos seus argumentos, nos cales os crimiais usaban trapos mollados en cloroformo para deixaren inconscientes as súas vítimas. Porén, é case imposible incapacitar a alguén usando cloroformo desa maneira.[62] Cómpren polo menos cinco minutos de inhalación de cloroformo para deixar unha persoa inconsciente. A maioría dos casos criminais nos que interveu o cloroformo, este era coadministrado xunto con outra droga, como alcohol ou diazepam, ou a vítima era cómplica na súa administración. Despois de que unha persoa perde a consciencia debido á inhalación de cloroformo, debe administrarse un volume continuo, e debe aguantarse o queixo da mandíbula para evitar que a lingua obstrúa as vías aéreas, un procedemento difícil, que normalmente require as destrezas dun anestesista. En 1865 como resultado directo da reputación criminal do cloroformo, a revista médica The Lancet ofreceu recoñecerlle unha "reputación científica permanente" a calquera persoa que puidese demostrar a "insensibilidade instantánea", é dicir, a perda de consciencia, dun suxeito co que se usou o cloroformo.[63]
Seguridade
Exposición
O cloroformo fórmase como subproduto da cloración da auga, xunto con outros varios subprodutos da desinfección, e está, polo tanto, presente na auga potable tratada da traída municipal e nas piscinas. Os rangos dos que se informou varían considerablemente, pero están xeralmente por debaixo dos estándares saudables actuais para os trihalometanos totais (THMs), que son de 100 μg/L.[64] Con todo, cando se considera en combinación con outros trihalometanos presentes con frecuencia na auga potable, a concentración de THMs a miúdo excede o límite recomendado de exposición.[65]
Aínda que hai poucos estudos que avaliasen os riscos que supón a exposición ao cloroformo pola auga potable por separado doutros THMs, moitos estudos mostraron que a exposición á categoría xeral dos THMs, incluíndo o cloroformo, está asociada cun incremento do risco de cancro de vexiga ou do tracto intestinal inferior.[66]
Historicamente, a exposición ao cloroformo puido ser maior, debido ao seu uso común como anestésico, como ingrediente en xaropes para a tose e como constituínte do fume do tabaco, cando se utilizara previamente o DDT como fumigante durante o cultivo da planta.[67]
Farmacoloxía
O cloroformo absórbese ben no organismo, metabolízase e elimínase rapidamente nos mamíferos despois da súa inhalación oral ou exposición dérmica. As salpicaduras accidentais nos ollos causan irritación.[14] A exposición dérmica prolongada pode orixinar o desenvolvemento de chagas como resultado a perda de lípidos da pel. A eliminación realízase principalmente polos pulmóns como cloroformo e dióxido de carbono; menos do 1 % excrétase pola urina.[35]
O cloroformo metabolízase no fígado polo encima citocromo P450, por oxidación a clorometanol e por redución ao radical libre diclorometilo. Outros metabolitos do cloroformo son o ácido clorhídrico e o diglutationil ditiocarbonato, con dióxido de carbono como produto final predominante do metabolismo.[68]
Como moitos outros anestésicos xerais e drogas sedantes-hipnóticas, o cloroformo é un modulador alostérico positivo nos receptores GABAA.[69] O cloroformo causa depresión do sistema nervioso central (SNC), producindo finalmente un coma profundo e depresión do centro respiratorio.[68] Cando se inxire, o cloroformo causa síntomas similares aos que se observan despois da inhalación. Poden aparecer doenzas graves despois da inxestión de 7,5 g. A dose oral letal media nun adulto estímase en 45 g.[14]
O uso anestésico de cloroformo foi abandonado, porque causaba mortes por insuficiencia respiratoria e arritmias cardíacas. Despois dunha anestesia inducida por cloroformo, algúns pacienes sofren náuseas, vómitos, hipertermia, ictericia, e coma debido a disfunción hepática. Nas autopsias observáronse necrose e dexeneración do fígado.[14]
O cloroformo induciu casos de tumores hepáticos en ratos e tumores renais en ratos e ratas.[14] A hepatotoxicidade e nefrotoxicidade do cloroformo pénsase que se debe principalmente ao fosxeno, un dos seus metabolitos.[68]
Conversión a fosxeno
O cloroformo convértese lentamente en presenza de luz ultravioleta e aire no gas extremadamente velenoso fosxeno (COCl
2), liberando no proceso HCl.[70]
- 2 CHCl
3 + O
2 → 2 COCl
2 + 2 HCl
Para previr accidentes, o cloroformo comercial estabilízase con etanol ou amileno, pero as mostras que se extraen ou secan xa non conteñen estabilizador. O amileno demostrou non ser efectivo, e o fosxeno pode afectar os analitos das mostras, como lípidos e ácidos nucleicos disoltos ou extraídos con cloroformo.[71] O fosxeno e o HCl poden ser retirados do cloroformo lavándoo con solucións acuosas de carbonato saturadas, como o bicarbonato de sodio. Este procedemento é simple e dá lugar a produtos non perigosos. O fosxeno reacciona coa auga para formar dióxido de carbono e HCl,[72] e o sal carbonato neutraliza o ácido resultante.[73]
Nas mostras sospeitosas pode comprobarse a presenza de fosxeno usando papel de filtro, o cal, cando se trata cun 5 % de difenilamina e 5 % de dimetilaminobenzaldehido en etanol, e despois é secado, vólvese amarelo en presenza de vapor de fosxeno.[74] Hai varios reactivos colorimétricos e fluorométricos para o fosxeno, e pode tamén cuantificarse usando espectrometría de masas.[75]
Regulación
Sospéitase que o cloroformo pode causar cancro (é dicir, é un posible carcinóxeno do grupo 2B da IARC) segundo as monografías da Axencia Internacional para a Investigación do Cancro ou IARC (polas súas siglas en inglés de International Agency for Research on Cancer).[76]
Está clasificado como substancia extremadamente perigosa en países como os Estados Unidos e está suxeito a estritas obrigacións de información polas instalacións onde o producen, almacenan ou usan en cantidades significativas.[77]
Na Unión Europea a presenza de residuos de cloroformo en alimentos (resultantes do uso veterinario) está prohibida.[78]
Biorremediación do cloroformo
Algunhas bacterias anaerobias usan o cloroformo para a respiración, o que se denomina respiración de organohaluros, converténdoo en diclorometano.[79][80]
Galería
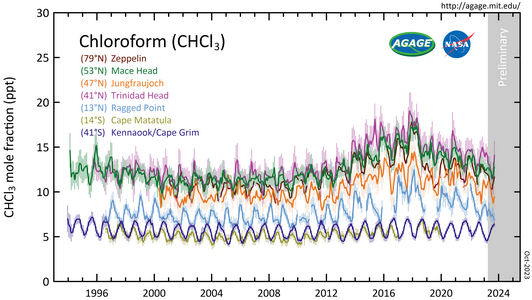
- CHCl
3 medido polo Advanced Global Atmospheric Gases Experiment (AGAGE) na baixa atmosfera (troposfera) en estacións de todo o mundo. As abundancias danse como fraccións molares medias mensuais libres de polución en partes por billón (10-12, que en inglés son parts-per-trillion, ppt).
Notas
Véxase tamén
Ligazóns externas
- Chloroform "The Molecular Lifesaver" – Artigo da Universidade de Oxford con datos sobre o cloroformo.
- Chloroform Administration – unha película curta filmada na década de 1930 sobre a aplicación de anestesia con cloroformo
- Concise International Chemical Assessment Document 58
- IARC Summaries & Evaluations: Vol. 1 (1972), Vol. 20 (1979), Suppl. 7 (1987), Vol. 73 (1999)
- International Chemical Safety Card 0027
- "NIOSH Pocket Guide to Chemical Hazards #0127". National Institute for Occupational Safety and Health (NIOSH).
- NIST Standard Reference Database