全身麻酔
全身麻酔(ぜんしんますい、英: General anesthesia)は、痛覚刺激を与えても患者が覚醒しないように、人為的に誘発される意識喪失である[1]。この効果は、静脈内または吸入の全身麻酔薬を投与することで得られ、しばしば鎮痛剤および神経筋遮断薬が併用される。手術中は自発呼吸が十分でないことが多く、気道を保護するための介入が必要となることが多い[1]。全身麻酔は一般に手術室では患者にとって耐え難い痛みを伴う外科手術を可能にするために、集中治療室や救急外来では重症患者の気管挿管や機械換気を容易にするために実施される。
| 全身麻酔 | |
|---|---|
 全身麻酔にて使われる器具の一例 | |
| MeSH | D000768 |
| MedlinePlus | 007410 |
日本では、全身麻酔の目標は「麻酔の3要素」、すなわち鎮静・鎮痛・筋弛緩とされることが多い[2][3][4]。有害反射の抑制も加えて麻酔の4要素とされることもある[5][6]が、これは元はWoodbridgeらが1957年に提唱した麻酔深度の概念に遡ることができる[7]。英語圏では、意識消失、健忘、鎮痛、自律神経系の反射消失、場合によっては骨格筋の麻痺を達成することが全体目標とされることもある。すなわち、4要素ないしは5要素となっており、鎮静において意識消失と健忘が別個の評価項目となっていることによる。
患者や処置に最適な麻酔薬の組み合わせは、麻酔科医が患者、外科医、歯科医師、または手術処置を行う他の施術者と相談しながら選択する[8]。
現在では多様な気道確保器具が存在するが、かつては全身麻酔時の気道確保は、麻酔マスクないしは気管挿管に限られ、麻酔薬も吸入麻酔薬が主であったことから、後者が気管内麻酔法(intratracheal anesthesia)[9][10][11][12]と呼ばれていたが、現在はこの名称は、ほぼ用いられない[注釈 1]。
歴史
全身麻酔の試みは、古代シュメール人[13]、バビロニア人[14]、アッシリア人[15]、エジプト人[16]、ギリシャ人、ローマ人、インド人[17]、中国人[18]の書物から、歴史的にたどることができる。2世紀から3世紀に書かれた『三国志』には、中国後漢末期に華陀が「麻沸散」という麻酔薬を用いて手術を行ったと記載されている[19]。この「麻沸散」は全身麻酔薬であろうと考えられているが、どのようなものであったかは明らかではない[20]。
中世には、東洋においてもヨーロッパにおいても科学は医学的に大きな進歩を遂げた。
ルネッサンス期には、解剖学と外科学に大きな進歩があった。しかし、このような進歩にもかかわらず、手術は依然として最後の治療法であった。手術は痛みを伴うため、多くの患者は手術を受けるよりも死を選んだ。全身麻酔の発見については、誰が最も功績を残したかについて定説は無いが、18世紀後半から19世紀初頭にかけてのいくつかの科学的発見が、近代的麻酔技術の導入と発展に不可欠であった[21]。特に薬剤投与経路としての気体の吸入の開発が重要であった[22]。
正確に確認できる全身麻酔の記録としては、文化元年10月13日(1804年11月14日)に華岡青洲が行った乳癌の手術が初出である[23]。このとき用いられた経口麻酔薬「通仙散」はチョウセンアサガオにトリカブトやトウキなどを配合した薬品であった。西洋では、1846年にアメリカでウィリアム・T・G・モートンが行ったジエチルエーテル吸入による手術が初の全身麻酔手術となる[24]。エーテルは引火性が問題であり、すぐにクロロホルムに取って代わられたが[25]、クロロホルムも毒性のために死者が相次ぎ、使われなくなるのに時間はかからなかった[25]。
19世紀後半には、近代外科学への移行を可能にする二つの大きな飛躍があった。病原菌の発見と麻酔である。病気の病原体説の理解により、外科手術における感染予防技術の開発と応用が急速に進んだのである[26][27]。防腐法(英語: antisepsis)はやがて無菌法(英語: asepsis)に変わり、外科手術の合併症と死亡率は、以前の時代よりはるかに低くなった[27]。
一方、この時期はエーテルなどの単一の揮発性麻酔薬を用いて、麻酔の4要素全てを達成する努力がなされたが、麻酔をかけるのに時間を要し、手術に必要な筋弛緩を得るには高濃度の麻酔薬が必要であった[28]。また、この吸入自体、麻酔薬の臭気のためもあり、一部の患者にとっては不快な経験であり、他の投与経路、例えば直腸や静脈から投与できる薬剤の試行錯誤が続いた[29]。
1934年に、アメリカのアーネスト・ヴォルワイラーによって開発された静脈麻酔薬チオペンタールは、現在に至るまで全身麻酔薬として使用されており[30]、WHOの必須医薬品リストにも指定されている[31]。チオペンタールなどの静脈麻酔薬によって、麻酔をかけるのに要する時間は短縮されたが、これらは呼吸抑制が強く循環抑制も強かったため、依然、死亡リスクが高かった[28]。
20世紀には、気管挿管やその他の高度な気道確保技術を日常的に使用し、局所麻酔や複数の麻酔薬を組み合わせるバランス麻酔の概念が提唱され、全身麻酔の安全性と有効性が改善された[32]。また、モニタリングの大幅な進歩や、薬物動態学的および薬力学的特性が改善された新しい麻酔薬も、この傾向に貢献した[33]。
目的
麻酔の目的は、次の4つの基本的な要素またはエンドポイント(臨床評価項目)に集約される[34][35]。一方、麻酔の3要素(英: Triad of Anesthesia)として、意識消失、鎮痛、筋弛緩[2][3][4]、これに自律神経反射抑制を加えた4要素に単純化した考え方も古くから存在する[5][6][36]。
- 鎮痛(Analgesia): 感覚の喪失、自律神経反射を鈍らせる。不十分な鎮痛は頻脈や高血圧を引き起こす[37]。
- 不動化(Immobilization): 筋弛緩とも呼ばれ、主として神経筋遮断薬による。神経筋遮断薬は神経筋接合部に作用して筋弛緩作用を発現する[38]。
- 健忘(Amnesia):術中の記憶の喪失。
- 意識消失(Unconsciousness): 一時的に意識を失うことであり、鎮静(Sedation)ないしは催眠(Hypnosis)とも称される。しかしながら、鎮静は麻酔の目的のみならず、麻酔の方法そのものを意味することがあり、催眠は催眠術のように、意識がある状態で何らかの暗示にかかることをも意味する。
生化学的作用機序

全身麻酔薬の生化学的な作用機序はよく分かっていない[39]。植物も動物同様に麻酔薬による作用をうけることは分かっている[40]。意識を失わせるために、麻酔薬は無数の作用部位を持ち、中枢神経系(CNS)に複数のレベルで作用する。全身麻酔は、大脳皮質、視床、網様体賦活系、脊髄を含む中枢神経系構成要素の機能を抑制・変化させるのが一般的である。麻酔状態に関する現在の理論では、中枢神経系における標的部位だけでなく、無意識と関連した神経ネットワークや覚醒回路も特定されており、一部の麻酔薬は特定の睡眠活性部位を活性化する可能性があることが分かっている[41]。全身麻酔に用いられる薬剤のうち、オピオイドとベンゾジアゼピンは結合する受容体が特定され、作用機序が判明しているが、他の薬剤は未解明の部分が残っている[42]。
全身麻酔は、神経信号の抑制性伝達を増強するか、あるいは興奮性伝達を減少させるという仮説が立てられた[43]。全身麻酔薬の主要な分子薬理学的標的は、GABAAとNMDAグルタミン酸受容体であると考えられている[43]。ほとんどの吸入麻酔薬はGABAAアゴニストであることが判明しているが、受容体への作用部位は不明なままである[44]。ケタミンは非競合的なNMDA受容体拮抗薬である[45]。吸入麻酔薬や静脈麻酔薬(プロポフォールやバルビツール系)は、麻酔作用を発揮するには、オピオイドやベンゾジアゼピンの数十倍から1000倍の組織内濃度を必要とする[46]。このことは、これらの麻酔薬の作用機序が特定の受容体への結合だけでは説明できない傍証となっている[47]。

吸入麻酔薬は、化学構造と特性から、細胞膜を標的とすることも示唆されているが、その正確なメカニズムは100年以上謎のままであった。2020年の研究では、吸入麻酔薬(クロロホルムとイソフルラン)が脂質ラフトへのホスホリパーゼD2の局在を乱し、シグナル伝達分子であるホスファチジン酸の産生につながることが実証された。シグナル伝達分子はカスケード反応を引き起こし、最終的にはTWIK関連K+チャネル(TREK-1)を活性化させる。ホスホリパーゼD2遺伝子欠損 (PLDnull)ミバエは麻酔抵抗性であることが示されており、この結果により、吸入麻酔薬の標的が細胞膜介在性であることが確立された[48][49]。
術前評価

予定手術の前に、麻酔科医はカルテを調べたり、患者の問診をしたりして、病歴に関する情報を入手し、周術期のリスクを判断する。問診に基づき、麻酔科医は麻酔計画を立て、手術に最適な薬剤の組み合わせと投与量を決定する。また、安全で効果的な手術を行うために、モニタリング機器を追加する必要がある場合もある。この評価で重要なのは、患者の年齢、性別、ボディマス指数(BMI)、病歴、手術歴、現在服用している薬、絶食時間などである[50][51] 。術前の徹底的かつ正確な評価は、麻酔計画の効果的な安全性を確保するために極めて重要である。例えば、アルコールやレクリエーショナルドラッグを大量に摂取している患者が、その事実を開示しなかった場合、手術中に薬物投与量が不足し、術中覚醒や術中高血圧の原因となる可能性がある[52][53]。また、一般的に使用されている薬剤は麻酔薬と相互作用する可能性があり、そのような使用状況を開示しないと、手術中のリスクが高まる可能性がある。また、最後の食事からある程度時間が経過していないと、食物の誤嚥の危険性が高まり、重篤な合併症につながる可能性がある[54]。
麻酔前の評価で重要なのは、開口状況の確認と咽頭の軟部組織の観察を含む患者の気道の評価である[55]。歯の状態や歯冠の位置を確認し、頸部の柔軟性と伸展性を観察する[56][57]。最も一般的に行われている気道評価はマランパチ分類で、口を開けて舌を出した状態で軟口蓋の構造を見ることができるかどうかで気道を評価するものである。マランパチテストだけでは精度が低いため、マランパチテストに加え、開口度、甲状頤間距離、頸部可動域、下顎骨突出などの評価も日常的に行われている。また、気道の形態異常が疑われる患者には、内視鏡検査や超音波検査で気道の評価を行った上で、気道確保を計画することもある[58]。
アメリカ麻酔科学会では全身状態を6つに分類しており、ASA-PS(ASA physical status)と呼んでいる。手術前のASA-PSと予後は相関する。
予定手術であれば十分な時間をかけた術前評価が可能だが、緊急手術の術前評価は時間的な制限が多い。
前投薬
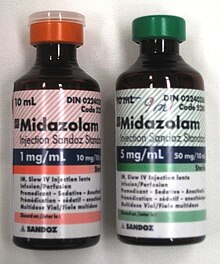
全身麻酔を行う前に、麻酔科医は麻酔の質や安全性を補ったり向上させたりするために、1種類以上の薬剤を投与することがある。これを前投薬という。前投薬の多くには弱い鎮静効果があり、手術中に使用する麻酔薬の量を減らすことができる場合が多い[59]。
海外でよく使われる前投薬にα2アドレナリン作動薬であるクロニジンがある[60][61]。術後シバリング[62]、術後の悪心・嘔吐[63]、覚醒時せん妄を軽減する[64]。2021年の無作為化比較試験では、クロニジンは就学前の子どもには抗不安作用が少なく、鎮静作用が強いことが実証された。経口クロニジンは最大効果発現には45分ほどかかる[65]。クロニジンの欠点は低血圧と徐脈であるが、高血圧と頻脈の患者には有利に働く可能性がある[66]。もう一つのα-2アドレナリン作動薬であるデクスメデトミジンは、短期間の鎮静効果(24時間以内)のためによく使用される。デクスメデトミジンとある種の非定型抗精神病薬は、非協力的な子供にも使用されることがある[67]。日本では2023年現在、クロニジン[68]もデクスメデトミジン[69]も前投薬としては適応外使用となる。
ベンゾジアゼピン系も前投薬としてよく使用される薬物である。ベンゾジアゼピン系で最もよく使用されるのはミダゾラムであり、速効性と短時間作用が特徴である。ミダゾラムは、小児の分離不安など術前不安の軽減に効果的である[70]。また、術後の悪心・嘔吐の軽減、軽度の鎮静、交感神経抑制、前向性健忘をもたらす[71]。
メラトニンは、催眠作用、抗不安作用、鎮静作用、鎮痛作用、抗けいれん作用があるため、成人および小児の麻酔前投薬として有効であることが判明している。メラトニンの前投薬後は、ミダゾラムよりも回復が早く、術後の興奮やせん妄の発生率も減少する[72]。メラトニンは、ベンゾジアゼピンと比較して、成人患者の周術期不安の軽減に同様の効果があることが示されている[73]。メラトニンも日本では前投薬は適応外使用となる。
麻酔前投薬のもう一つの例として、βアドレナリン拮抗薬の術前投与があり、これは心臓手術後の頻脈性不整脈を軽減することが示されている[74]。しかし、心臓以外の手術では、β遮断薬による有害事象の増加との関連も指摘されている。麻酔科医は、術後の悪心・嘔吐を防ぐために、オンダンセトロン、ドロペリドール、デキサメタゾンなどの制吐剤を少なくとも1種類は投与することがある[75]。NSAIDsも鎮痛前投薬として用いられることがあり、フェンタニルなどのオピオイドの必要性をしばしば減少させる。また、メトクロプラミドのような消化管運動促進剤、ファモチジンのようなヒスタミン拮抗剤も使用される[75]。
非薬物的な麻酔前介入としては、認知行動療法、音楽療法、アロマセラピー、催眠マッサージ、術前説明ビデオ、誘導イメージによるリラックス療法などがある[76]。これらの手法は、特に小児や知的障害のある患者に有効である。ビデオゲームによって、感覚刺激を最小限に抑えたり、気晴らしをすることは、全身麻酔の導入前または導入中の不安の軽減に役立つと考えられる。しかし、この種の不安の軽減に最も効果的な非薬物学的アプローチを確認するためには、より大規模で質の高い研究が必要である[77]。麻酔導入時の両親の同席は、小児の不安を軽減することが示されていない。同席を希望する親を積極的に阻止すべきではなく、同席を希望しない親を無理強いすべきではないことは、示唆されている[77]。
麻酔深度
ゲデルの麻酔深度分類は、1937年にアメリカの麻酔科医アーサー・アーネスト・ゲデルが発表したもので[78]、 麻酔の4つの段階を表している。新しい麻酔薬や麻酔導入技術により、麻酔の開始と回復がより迅速に行われるようになったが(いくつかの段階は完全にスキップされることもある)、この原則は変わっていない。
- 1期
- 1期は、導入期とも呼ばれ、導入剤を投与してから意識を失うまでの期間である。この段階で、患者は記憶喪失を伴わない鎮痛状態から記憶喪失を伴う鎮痛状態へと進行する。この時、患者は会話を続けることができ、視覚障害を訴えることがある。
- 2期
- 第2期は、興奮期またはせん妄期とも呼ばれ、意識を失った後、興奮状態やせん妄状態が顕著になる時期である。この段階では、患者の呼吸と心拍が不規則になることがある。さらに、不随意運動、嘔吐、呼吸の中断、瞳孔散大がみられることもある。痙性運動、嘔吐、不規則な呼吸の組み合わせは患者の気道を損なう可能性があるため、この段階の時間を最小限に抑え、できるだけ早く第3期に到達するためには、速効性の薬剤を用いる。
- 3期
- 第3期は外科的麻酔期とも呼ばれ、骨格筋が弛緩し、嘔吐は停止する。呼吸抑制と眼球運動の停止がこの段階の特徴である。患者は意識を失い、手術ができる状態になる。この段階は4つの局面に分けられる。
- 眼球が上転し、その後固定され、眼瞼反射と嚥下反射が失われる。まだ規則的な自発呼吸がある。
- 角膜反射と喉頭反射が失われる。
- 瞳孔反射が消失し、腹筋・肋間筋の完全弛緩が認められる。ほとんどの手術に対応できる理想的な麻酔レベル。
- 横隔膜の完全麻痺と不規則な浅い腹式呼吸が起こる[79]。
麻酔の導入
麻酔科学においてよく用いられる用語の「導入」とは、麻酔薬投与から気道確保を完了して、手術可能な状態となるまでの全身麻酔の初期段階のことを指す。全身麻酔は、通常、手術室または手術室に隣接する麻酔専用室で行われる。他に、内視鏡室、集中治療室、放射線科、循環器科、救急外来、救急車などでも行われる。このような麻酔は非手術室麻酔(Non Operating Room Anesthesia: NORA)と呼ばれ、ニーズが拡大している[80]。災害現場など、患者の救出が不可能または非現実的な場所でも行われることがある。
麻酔薬は、吸入、注射(静脈内、筋肉内、皮下)、経口、直腸など、さまざまな経路で投与されることがある。麻酔薬は循環系に入ると、中枢神経系および自律神経系にある生化学的活性部位に到達する。
ほとんどの全身麻酔は、静脈内または吸入により導入される。一般的に使用される静脈内導入剤には、プロポフォール、チオペンタールナトリウム、エトミデート、メトヘキシタール、ケタミンなどがある。吸入麻酔は、静脈内投与が困難な場合(例、小児)、気道確保が困難と予想される場合、または患者が希望する場合に選択されることがある。セボフルランは、他の薬剤に比べて気管や気管支への刺激が少ないため、吸入麻酔での導入に最もよく使用される薬剤である[81]。
導入に用いる薬剤の投与順序の一例
- 挿管中の無呼吸時間が長くなっても、血中酸素濃度に影響を与えないようにするために、肺を100%酸素で満たすために行う麻酔前の酸素吸入(前酸素化と称する。脱窒素ともいう)。
- 挿管時の鎮痛のためのレミフェンタニル
- 気管挿管のための鎮静剤としてのプロポフォール
- 開口や喉頭鏡操作を容易にするための筋弛緩薬として、ロクロニウム
- 挿管が完了したら、酸素から酸素と吸入麻酔薬の混合気体に変更する
喉頭展開と挿管は、どちらも非常に刺激が強いものである。上記の導入の過程では、これらの操作に対する血圧上昇などの反応を抑制すると同時に、挿管の間に意識がある、というような事が無いよう、昏睡に近い状態に誘導する。
導入方法

以下の4種類の方法に大別される[82][83][注釈 2]。いずれの場合も、挿管時の痛み刺激による血圧上昇や頻脈を抑制するためにオピオイドが併用されることが多い。
1. 急速導入(Rapid Induction)
2. 緩徐導入(Slow Induction)
- 吸入麻酔薬によりマスク換気で入眠させ、麻酔を深くしたあと、静脈路確保を行ってから筋弛緩薬を投与し、筋弛緩薬の効果発現までマスク換気を行ってから挿管する[87]。覚醒状態で末梢静脈カテーテルの確保が困難な小児などに用いる[88][87]。エーテルやクロロホルムが用いられていた時代は、もっぱらこの導入方法であり、歴史的には最も古い。
3. 迅速導入(Rapid sequence induction)
- 以前はCrash Inductionとも呼ばれた。緊急時の手術などで、胃内容物が多く(フルストマック)、誤嚥の危険性が高い状況で行われる導入方法で、十分な前酸素化のあと、静脈麻酔薬と筋弛緩薬を一度に投与し、マスク換気を行わずに気管挿管を行う方法[83]。挿管前後に輪状軟骨を圧迫して食道を閉鎖して胃内容物の逆流を防ぐ[89][83]。
4. 意識下挿管
意識下挿管(英: awake intubation)は、上記の3種類の導入と異なり、気管挿管を行ってから麻酔導入を行うものである。気道確保前の麻酔薬や筋弛緩薬の使用リスクが高い場合、例えば、ショック状態、フルストマック、挿管困難予想症例が対象となる[83]。
生理学的モニタリング

モニタリング機器により、全身麻酔の導入、維持、そして覚醒をコントロールすることができる。麻酔の基本的なモニタリングの基準は、アメリカ麻酔科学会が発表したガイドラインで、麻酔中に患者の酸素化、換気、循環、体温を継続的に評価する必要があると記述されている[90]。
- 連続心電図モニタ(ECGまたはEKG): 電極を患者の皮膚に貼り付けて、心拍数と心拍リズムを監視する。これは、麻酔科医が心臓の虚血の初期徴候を識別するのに役立つ場合がある。通常、不整脈はⅡ誘導、心筋虚血はⅤ5誘導でモニターする。
- 血圧モニタリング: 患者の血圧を測定する方法は2つある。まず、最も一般的なのは、非侵襲的血圧(NIBP)モニタリングである。これは、患者の腕、前腕、または脚に血圧計を装着するものである。手術中は、あらかじめ設定された一定の間隔で、機械が血圧を測定する。2つ目の方法は、侵襲的血圧(IBP)モニタリングで、血圧の一拍ごとのモニタリングが可能である。この方法は、重症の心臓疾患や肺疾患のある患者、心臓手術や移植手術などの大きな手術を受ける患者、大量の出血が予想される患者に限られる。この方法では、通常、手首(橈骨動脈)または鼠径部(大腿動脈)の動脈に、特殊なプラスチック製のカニューレを挿入する。術中の平均動脈圧が60~70mmHg未満であると、心臓以外の手術を受けた成人では心筋障害、 急性腎障害 、死亡と関連していたため、術中の低血圧は平均動脈圧<65mmHg未満の定義が頻繁に使用され、臨床における一般的な介入閾値となっている[91]。しかし、ベースラインの血圧値や自己調節の 下限にはかなりの個人差があるため、すべての患者において周術期低血圧を定義する単一の血圧閾値が存在するわけではない[91]。
- 薬剤濃度測定:麻酔器には通常、吸入麻酔薬の使用割合や呼気濃度を測定するためのモニターがある。これらのモニターには、酸素、二酸化炭素、および吸入麻酔薬(亜酸化窒素、セボフルランなど)の測定が含まれる。
- 酸素濃度計: ほとんどすべての麻酔器の回路には、患者への酸素供給が損なわれた場合に備えてアラームが搭載されている。アラームは、吸入酸素の割合が設定された閾値を下回ると作動する。
- 回路外れアラーム(または低圧アラーム): 機械換気中に麻酔器の回路内圧が、正常に陽圧換気が行われていれば到達するはずの圧力に達しないことを示す。
- カプノグラフィー: 患者の呼気の二酸化炭素の量をパーセントまたはmmHgで表示し、麻酔科医が換気の適切さを評価できるようにするものである。通常、麻酔科医はより繊細な変化を確認するためにmmHgを使用する。
- 体温測定: 低体温や発熱の判別、悪性高熱症の早期発見など、麻酔管理上重要である。詳細は後述。
- 脳波、エントロピーモニター、その他の脳波測定システム: 麻酔の深さを確認するために用いられる。これにより、術中覚醒や過剰投与の可能性を低減することができる。

気道管理
麻酔中の患者は、麻酔薬、オピオイド、筋弛緩剤の影響により、気道保護反射(咳など)、気道開存性、時には規則的な呼吸パターンが消失する。気道を確保し、呼吸を調節するために、患者が意識を失った後に何らかの呼吸チューブが挿入される。機械換気を可能にするために、気管チューブがしばしば使用されるが、麻酔マスクやラリンジアルマスクなど、呼吸を補助できる別の器具も存在する。一般に、完全な機械換気は、侵襲度の高い処置のために非常に深い全身麻酔状態を引き起こす場合、および/または重症患者や負傷した患者に対してのみ使用される。とはいえ、全身麻酔を導入すると、通常は無呼吸になり、薬物が切れて自発呼吸が始まるまで換気が必要となる。つまり、全身麻酔の導入と維持の両方に換気が必要な場合と、導入時だけに換気が必要な場合がある。しかし、人工呼吸器による機械換気は、自発呼吸の間、十分なガス交換を確保するための換気補助を行うこともできる。
全身麻酔は、患者が自発的に呼吸している状態でも行うことができ、その結果、患者自身の酸素濃度を維持することができる。よって、自発呼吸維持は特殊な状況(例:気道確保困難、非挿管下手術)において有益となることがある。自発呼吸は従来、吸入剤(ハロタンやセボフルランなど)で維持されてきたが、静脈麻酔薬(例:プロポフォール)を使用して自発呼吸を維持することも可能である。自発呼吸を維持するための静脈麻酔は、吸入麻酔薬に比べて一定の利点(喉頭反射の抑制など)があるが、慎重に滴定する必要がある。静脈麻酔と高流量鼻腔酸素を用いた自発呼吸(STRIVE HiTM)は、困難気道で閉塞している場合に使用されてきた技術である[92]。
眼球保護
全身麻酔は眼輪筋の緊張性収縮を低下させ、59%の人に兎眼(不完全な閉眼)を引き起こす[93]。さらに、涙の産生と涙液膜の安定性が低下し、角膜上皮の乾燥が起こり、リソゾームによる保護が低下する。また、ベル現象(睡眠中に眼球が上を向き、角膜を保護する現象)による保護も失われてしまう。全身麻酔中の眼球損傷の可能性を減らすために、慎重な管理が必要である[94]。全身麻酔中の眼の損傷を防ぐ方法としては、瞼をテープで閉じる、眼軟膏を使用する、特殊なデザインの眼球保護ゴーグルを使用する、などがある。
神経筋遮断

神経筋遮断薬による麻痺、すなわち一時的な筋弛緩は、現代の麻酔に不可欠な要素である。この目的で最初に使用された薬剤は1940年代に導入されたクラーレであったが、現在では副作用が少なく、一般に作用時間の短い薬剤に取って代わられている。筋弛緩によって、腹部や胸部などの主要な体腔内の手術を、深い麻酔(循環器系などへの悪影響が強い)を必要とせずに行うことが可能となり、また気管挿管も容易となる。
アセチルコリンは、神経筋接合部に存在する天然の神経伝達物質で、神経末端から放出されると筋肉を収縮させる作用がある。筋弛緩剤は、アセチルコリンが受容体に結合するのを阻害することによって作用する。呼吸筋(横隔膜と胸の肋間筋)が麻痺すると、何らかの人工呼吸が必要となる。喉頭筋も麻痺しているため、通常、気管チューブを用いて気道を確保する必要がある[95]。
運動麻痺を最も簡単にモニターできるのは、筋弛緩モニタである。この装置は、末梢神経の皮膚から短い電気パルスを断続的に送りながら、その神経に支配されている筋肉の収縮を観察するものある。筋弛緩剤の効果は、手術終了時にコリンエステラーゼ阻害薬によって元に戻される[注釈 3]ことが多く、副作用を最小限に抑えるためにムスカリン系抗コリン薬と併用投与される。現在使用されている骨格筋弛緩薬の例としては、パンクロニウム、ロクロニウム、ベクロニウム、シスアトラクリウム、アトラクリウム、ミバクリウム、サクシニルコリンがある。スガマデクスのような新しい神経筋遮断回復剤も使用できる;これは筋弛緩薬と直接結合して神経筋接合部からそれを取り除くことで効果を発揮する。スガマデクスは2015年に米国で使用が承認され、急速に普及が進んだ。2022年の研究では、スガマデクスとネオスチグミン(頻用されているアセチルコリンエステラーゼ阻害剤)は、神経筋遮断から回復作用において同様に安全である可能性が高いことが示されている[96]。
麻酔の維持
静脈内導入剤の作用時間は一般に5~10分で、その後、自然に意識が回復する[97]。手術の間、意識消失を持続させるためには、麻酔を維持する必要がある。そのためには、酸素と揮発性麻酔薬の混合ガスを注意深くコントロールして患者に吸入させるか、静脈内投与を行う(通常はプロポフォール)。吸入麻酔薬は、オピオイド(通常はフェンタニルまたはフェンタニル誘導体)系の静脈内鎮痛剤や鎮静剤(通常はプロポフォールまたはミダゾラム)などによってよく補完される。プロポフォールは全静脈麻酔(TIVA)に使用できるため、吸入薬による補完は必要ない[98]。
麻酔維持に用いる薬剤は独自の略号が麻酔記録に用いられている。例えば、"GOS"はG: Gas(笑気)、O: Oxygen(酸素)、S: Sevoflurane(セボフルラン)である[99]。2023年現在、日本で麻酔維持に保険適応があるのはプロポフォールとレミマゾラムである。全身麻酔は通常安全であると考えられているが、局所麻酔薬による味覚および/または嗅覚の変調、全身麻酔の副作用として脳卒中、神経損傷を生じた患者の報告例がある[100]。
手術が終わると、麻酔薬の投与は中止される。脳内の麻酔薬の濃度が一定以下になると、意識が回復する(手術時間にもよるが、通常1~30分以内に回復する)[101]。
1990年代、スコットランドのグラスゴーで、麻酔を維持する新しい方法が開発された[102]。標的制御注入 (TCI)と呼ばれるこの方法は、コンピュータ制御のシリンジポンプを用いて、手術中持続的にプロポフォールを注入し、揮発性麻酔薬を必要とせず、薬理学の理論により望ましい薬剤濃度を設定して、投与量をより正確に指定することができるものである[102]。利点としては、麻酔からの回復が早い、術後の悪心・嘔吐の発生が少ない、悪性高熱症の誘因がない、などが挙げられる[102]。現在、米国ではTCIは認められていないが、代わりに一定量の薬剤を供給するシリンジポンプが一般的に使用されている[103]。日本ではプロポフォールのTCIのみ、認められている。
副作用の治療や合併症の予防のために、他の薬剤が使用されることもある。高血圧の治療には降圧剤、低血圧の治療にはエフェドリンやフェニレフリン、喘息や喉頭痙攣、気管支痙攣の治療にはサルブタモール、アレルギー反応の治療にはエピネフリン[104]やジフェンヒドラミン[105]などが使用される。炎症と感染を防ぐために、グルココルチコイドと抗生物質がそれぞれ投与されることもある[106][107]。
麻酔中の体温管理
麻酔中は熱喪失の増大と熱産生の低下、および体温調節機構の閾値低下により低体温症になりやすい。周術期における低体温はよくみられる症状であるが、36℃以下になると、出血量・輸液量増加、止血・凝固系の異常、術創部感染率増加(免疫能低下)、心筋虚血発生率の有意な増加などをもたらす[108]。また、体温をモニターすることで、悪性高熱症を発症した場合、迅速に処置できる。
体温管理法
- 室温の維持:30℃以上にすると、体温低下予防に効果的だが、執刀医の不快感が増大することによる手術行為の中断や失敗の誘因になる可能性があるため、限界がある[109]。
- 輸液・輸血の加温:大量かつ急速に投与する必要がある場合に有効である。
- ブランケット: 温水ブランケットと温風ブランケットがあり、前者は身体の下に敷くものであり、仰臥位では有効だが他の手術体位では有効性が低い[109]。現在は温風ブランケットが多く用いられている。
- 呼吸ガスの加温と加湿: 人工鼻が用いられている[109]。
- 体外循環:体温を急速に変化させることができるが[109]、心臓外科手術に限られ、侵襲が大きい。
- アミノ酸輸液:異化の亢進を防ぎ、熱産生を促す[109]。
測定部位
中枢神経や重要臓器の温度(中枢温)は、体の中心部から血液を導体として運ばれ、さまざまな部位の温度変化が観察できる。いずれの部位も臓器の温度以外にさまざまな影響がある。
- 血液温:正確で感度がよいが、肺動脈カテーテルの挿入が必要で、挿入時は高度の技術が要求される[108]。
- 食道温:食道下部3分の1に留置することで、心臓の温度(血液温)ときわめて高い相関を示す[108]。
- 鼓膜温:非接触型のプローブにより非侵襲的かつ衛生的に、連続測定が可能であるが、プローブと装着部位に隙間があると、低く測定されてしまう[108]。
- 膀胱温:サーミスタつき膀胱カテーテルで測定する[108]。
- 直腸温:排便の影響で中枢温よりも低く測定される場合がある。事前絶食を行っていれば、その影響は小さい[108]。
- 口腔温:唾液の影響で中枢温よりも低く測定される場合がある[108]。
- 前額深部温:血流が豊富な頭部で衛生的に測定できるが、特殊なモニター機器が必要である[108]。
- 腋窩温:腋窩を3分以上閉鎖腔として測定する必要がある[108]。
覚醒・抜管
麻酔における覚醒 (英: emergence)とは、全身麻酔の終了後、すべての器官系が元の生理的機能に戻ることである。この段階では、覚醒時せん妄(急性精神錯乱)、失語(会話の発声または理解の障害)、感覚または運動機能の巣症状などの一時的な神経学的症状[110]を伴うことがある。血圧の上昇や低下、頻脈、その他の心不整脈などの心血管系イベントも、呼吸困難などの呼吸器系症状と同様に、全身麻酔からの覚醒時に起こりやすい。
麻酔薬を止め、意識が回復し、筋弛緩作用からの回復も十分で、一回換気量、呼吸回数、指示に従う、などの条件を満たせば気管チューブを抜くことができる。これを抜管(ばっかん)という。言葉による指示に反応し、従うことは、患者の抜管準備の評価によく利用される基準である[111]。ただし、この状態でも筋弛緩薬の効果はある程度残っているため、アセチルコリンエステラーゼ阻害薬であるネオスチグミンと、ムスカリン作用(ネオスチグミンによる徐脈、分泌物増加などの副交感神経刺激作用)を抑制するための硫酸アトロピンを投与し、筋弛緩薬のリバース(拮抗)を行う[112]。近年では選択的筋弛緩薬結合薬であるスガマデクスが用いられる事が多い。リバースを行う場合、筋弛緩薬がある程度自然に消退していないと、再筋弛緩(英: recurarization)[注釈 4]が発生するため危険である[113]。抜管後、患者を観察し問題なければ手術室から術後回復室又は病棟に帰室させる。
予想される濃度や時間を超えて意識や反応が回復しない状態は覚醒遅延(delayed emergence from anesthesia)という[114]。
術後管理

術後の痛みは、麻酔後回復室(PACU)で区域麻酔や非経口薬で管理される。患者はオピオイドのほか、非ステロイド性抗炎症薬やアセトアミノフェンなどの薬剤を投与されることもある[115]。また、患者管理鎮痛 (PCA)と呼ばれるシステムを用いて、患者自身がオピオイドを投与することもある[116]。患者がPCAのボタンを押すと、注射器が作動し、通常モルヒネ、フェンタニル、オキシコドンなどの強オピオイド(例:フェンタニル10µg)の初期設定量の「ボーラス量」を投与される。PCA装置はその後、薬物が効果を発揮し、また患者が過剰摂取するのを防ぐために、あらかじめ設定された期間「ロックアウト」すなわちボタン操作不能となる。患者が眠くなりすぎたり、鎮静状態になると、それ以上鎮痛剤を要求しなくなる。このように、持続注入法にはないフェイルセーフの側面がある。これらの薬物療法で効果的に痛みを抑えることができない場合は、神経ブロックと呼ばれる方法で神経に直接局所麻酔薬を注入することがある[117][118]。
回復室では、酸素飽和度[119][120]、心拍、呼吸[119][121]、血圧[119]、中枢温など、多くのバイタルサインをモニターする。
術後シバリングはよく見られる。提唱されている機序は、脊髄が脳よりも速い速度で回復するという観察に基づいている。この結果、間代性活動(震え)として表れる脊髄反射が抑制されなくなる。この理論は、中枢神経刺激剤であるドキサプラムが術後のシバリングを消失させるのに幾分有効であるという事実からも支持される[122]。シバリングは、不快感や痛みの悪化のほか、酸素消費量の増加、カテコールアミンの放出、低体温のリスク、乳酸アシドーシスを誘発することが分かっている[123]。シバリングを軽減するために、暖かい毛布[124][125]や、温風加温装置と呼ばれる暖められた空気を循環させるシートで患者を包むなど、様々な手法が用いられる[126][127]。外部加温装置でシバリングを軽減できない場合は、デクスメデトミジンなどの薬剤[128][129]、またはその他のα2-アゴニスト、抗コリン剤、中枢神経刺激剤、または副腎皮質ステロイドを用いてもよい[115][130]。
多くの症例において、腹部以外の手術すら、周術期に用いるオピオイドが術後イレウスの一因となり得る。アルビモパンなどのμオピオイド拮抗薬を術後すぐに投与すれば、退院時期を早めることができるが、麻痺性イレウスの発症を抑えることはできない[131]。
Enhanced Recover After Surgery (ERAS、イーラス) は、ケアの継続性を確保し、回復と周術期ケアを改善するための最新のガイドラインとコンセンサスを提供する学会である[132]。パスウェイとガイドラインの遵守は、術後の転帰の改善と医療システムのコスト削減につながることが示されている[133]。
周術期死亡
周術期死亡のほとんどは、出血、敗血症、重要臓器の機能不全など、手術による合併症に起因する。過去数十年の間に、投与された麻酔薬の麻酔関連死亡率全体は大幅に改善された。監視装置、麻酔薬の進歩、周術期の安全性に対する関心の高まりなどが、周術期死亡率低下の理由である。米国では、現在推定される麻酔関連死亡率は、人口100万人あたり年間約1.1人である。死亡率が最も高いのは、老年人口、特に85歳以上の高齢者であった[134]。2018年のレビューでは、周術期の麻酔介入と麻酔関連死亡率への影響について検討された。死亡率を低下させることが判明した介入は、薬物療法、換気、輸血、栄養、血糖コントロール、透析、医療機器などである[135]。医師から別の医師への引継ぎと、患者の死亡率との関連には従来から議論があったが、2022年の無作為化比較試験では、引き継ぎ群と対照群と比較して死亡率に有意差がないことが示された[136]。
麻酔管理に直接関連する死亡例は非常に稀であるが、胃内容物の肺誤嚥[137]、 窒息[138]、アナフィラキシーが原因となることがある[139]。これらは、麻酔関連機器の故障や、より一般的にはヒューマンエラーによって起こる可能性がある。1984年、米国で放送された麻酔事故のテレビ番組をきっかけに、米国の麻酔科医Ellison C. Pierceは、米国麻酔科学会内に麻酔患者安全・リスク管理委員会を設置した[140]。この委員会は、麻酔に関連する罹患率や死亡率の原因を突き止め、低減させることを任務としていた[140]。この委員会から生まれた「麻酔患者安全財団」(英語: Anesthesia Patient Safety Foundation (APSF))は、「いかなる患者も麻酔によって害されることのないように」という目標を掲げ、1985年に独立非営利法人として設立された[141]。
稀ではあるが、重大な全身麻酔の合併症には悪性高熱がある[142][143]。 基幹病院では、この潜在的な合併症のために、手術室の近くに緊急用の薬剤(ダントロレン)を常備すべきとされる[144]。
脚注
注釈
出典
参考文献
- Gropper, Michael A. (2020) (英語). Miller's anesthesia (Ninth ed.). Philadelphia: Elsevier. ISBN 9780323612647. OCLC 1124935549
- 森田, 潔 著、川真田 樹人 , 齋藤 繁 , 佐和 貞治 , 廣田 和美 , 溝渕 知司 編(日本語)『臨床麻酔科学書』中山書店、東京、2022年。ISBN 9784521749495。
- 日本麻酔科学会 著、日本麻酔科学会周術期管理チーム委員会 編(日本語)『周術期管理チームテキスト』(4版)公益社団法人日本麻酔科学会、神戸、2020年。ISBN 9784990526290。
- Miller, Ronald D. (2010). Miller's Anesthesia (Seventh ed.). US: Churchill Livingstone Elsevier. ISBN 978-0-443-06959-8
- 花岡, 一雄(日本語)『臨床麻酔学全書』 上、真興交易(株)医書出版部、東京、2002年。ISBN 978-4-88003-687-8。
- 諏訪邦夫『麻酔の科学』(第2版)講談社、2010年6月20日。ISBN 978-4-06-257686-4。
- 高野, 義人『STEP麻酔科』(第3版)海馬書房、2008年5月29日。ISBN 9784907704537。
- Miller, Ronald 著、武田純三 訳『ミラー麻酔科学』メディカルサイエンスインターナショナル、2007年4月1日。ISBN 9784895924658。
外部リンク
- 日本PACU研究会 術後回復室に関する学術団体
- Chloroform: The molecular lifesaver ブリストル大学の論文で、クロロホルムに関する興味深い事実が紹介されている(英語)。
- Australian & New Zealand College of Anaesthetists Monitoring Standard オーストラリア・ニュージーランド麻酔学会(ANZCA)のモニター基準(英語)
- Royal College of Anaesthetists Patient Information page 英国王立麻酔科協会の患者向けサイト(英語)