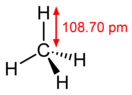Метан
Мета́н (лат. methanum; болотный газ, CH4) — простейший по составу предельный углеводород, при нормальных условиях бесцветный газ без вкуса и запаха. Малорастворим в воде, почти в два раза легче воздуха. Газ нетоксичен, но при высокой концентрации в воздухе обладает слабым наркотическим действием (ПДК 7000 мг/м3)[8] и относится к четвёртому классу токсичности[9]. Наркотическое действие метана CH4 ослабляется его малой растворимостью в воде и крови, а также химической инертностью. Имеются данные, что метан при хроническом воздействии малых концентраций в воздухе неблагоприятно влияет на центральную нервную систему[10].
| Метан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование | метан | ||
| Традиционные названия | метан, рудничный газ | ||
| Хим. формула | CH4 | ||
| Рац. формула | CH4 | ||
| Физические свойства | |||
| Молярная масса | 16,04 г/моль | ||
| Плотность | |||
| Энергия ионизации | 12,51 эВ[7] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −182,49 °C | ||
| • кипения | −161,58 °C | ||
| • разложения | выше +1000°C | ||
| • вспышки | 85,1 K, −188 °C | ||
| • самовоспламенения | +537,8 °C | ||
| Пределы взрываемости | 4,4—17,0 % | ||
| Критическая точка | |||
| • температура | 190,56 K, −82,6 °C | ||
| Энтальпия | |||
| • образования | −74 520 Дж/моль[4] | ||
| • сгорания | 35,9 МДж/м³ 50,2 МДж/кг[1] 803,2 кДж/моль | ||
| Удельная теплота испарения | 460,6 Дж/моль (при 760 мм. рт. ст.)[5] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,02 г/кг[6] | ||
| Структура | |||
| Дипольный момент | 0 Кл·м[7] | ||
| Классификация | |||
| Рег. номер CAS | 74-82-8 | ||
| PubChem | 297 | ||
| Рег. номер EINECS | 200-812-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA1490000 | ||
| ChEBI | 16183 | ||
| Номер ООН | 1971 | ||
| ChemSpider | 291 | ||
| Безопасность | |||
| Предельная концентрация | 7000 мг/м³ | ||
| ЛД50 | 13450-36780 мг/кг | ||
| Токсичность | Класс опасности по ГОСТ 12.1.007: 4-й | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При использовании в быту в метан (природный газ) обычно добавляют одоранты (обычно тиолы) — летучие вещества со специфическим «запахом газа», чтобы человек вовремя заметил аварийную утечку газа. На промышленных производствах утечки фиксируют датчики, и во многих случаях метан для лабораторий и промышленных производств поставляется без добавления одорантов.
Накапливаясь в закрытом помещении в смеси с воздухом метан становится взрывоопасен при концентрации его от 4,4 % до 17 %[11]. Наиболее взрывоопасная концентрация в смеси с воздухом 9,5 об.%. В угольных шахтах он выделяется из угольных пластов, что иногда приводит к взрывам, последствия которых могут быть катастрофическими.
Метан — третий по значимости парниковый газ в атмосфере Земли (после водяного пара и углекислого газа, его вклад в парниковый эффект оценивается 4—9 %)[12][13].
История
В ноябре 1776 года итальянский физик Алессандро Вольта обнаружил метан в болотах озера Лаго-Маджоре на границе Италии и Швейцарии. На изучение болотного газа его вдохновила статья Бенджамина Франклина о «горючем воздухе». Вольта собирал газ, выделяемый со дна болота, и в 1778 году выделил чистый метан. Также он продемонстрировал зажигание газа от электрической искры.
Сэр Гемфри Дэви в 1813 году изучал рудничный газ и показал, что он является смесью метана с небольшими количествами азота N2 и углекислого газа CO2 — то есть, что он качественно тождествен по составу болотному газу.
Современное название «метан» в 1866 году газу дал немецкий химик Август Вильгельм фон Гофман[14][15], оно образовано от слова «метанол».
Нахождение в природе
Основной компонент природного газа (77—99%), попутных нефтяных газов (31—90%), рудничного и болотного газов (отсюда произошли другие названия метана — болотный или рудничный газ). В анаэробных условиях (в болотах, переувлажнённых почвах, кишечнике жвачных животных) образуется биогенно в результате жизнедеятельности некоторых микроорганизмов.
Большие запасы метана сосредоточены в метаногидратах на дне морей и в зоне вечной мерзлоты[12][13].
Метан также был обнаружен на других планетах, включая Марс, что имеет значение для исследований в области астробиологии[16]. По современным данным, в атмосферах планет-гигантов солнечной системы в заметных концентрациях содержится метан[17].
Предположительно, на поверхности Титана в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[18]. Велика доля метановых льдов и на поверхности Седны[источник не указан 1105 дней].
В промышленности
Образуется при коксовании каменного угля, гидрировании угля, гидрогенолизе углеводородов в реакциях каталитического риформинга.
Классификация по происхождению
- абиогенный — образован в результате химических реакций неорганических соединений, например, при взаимодействии карбидов металлов с водой;
- биогенный — образован как результат химических превращений органических веществ;
- бактериальный (микробный) — образован в результате жизнедеятельности бактерий (микроорганизмов);
- термогенный — образован в ходе термохимических процессов.
Получение
Возможно получение метана за счет реакции Сабатье, за счет взаимодействия углекислого газа и водорода в присутствии катализатора при повышенной температуре и давлении:
- ∆H = −165.0 кДж/моль
В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и гидроксида кальция) или безводного гидроксида натрия с ледяной уксусной кислотой:
.
Для этой реакции важно отсутствие воды, поэтому и используется гидроксид натрия, так как он менее гигроскопичен.
Возможно получение метана сплавлением ацетата натрия с гидроксидом натрия[19]:
.
Также для лабораторного получения метана используют гидролиз карбида алюминия:
,
или некоторых металлорганических соединений (например, метилмагнийбромида).
Возможно биологическое получение метана, см. Биогаз.
Физические свойства

ВПВ — верхний предел взрываемости;
НПВ — нижний предел взрываемости;
ПК — пороговая концентрация взрываемости.
При комнатной температуре и стандартном давлении метан — бесцветный газ без запаха[20]. Знакомый запах бытового природного газа достигается специальным добавлением в газ смеси одорантов, содержащей трет-бутилтиол, в качестве меры безопасности для обнаружения аварийных утечек метана по запаху.
Метан имеет температуру кипения −164 °C при давлении в одну атмосферу[21].
Легко воспламеняется при объёмных концентрациях в воздухе от 4,4 до 17 об. % при стандартном давлении. Пределы взрываемости (воспламенения) в смесях метана с кислородом при атмосферном давлении от 4,5 до 61 oб. %.[источник не указан 184 дня]
Твёрдый метан при очень высоком давлении существует в нескольких модификациях. Известно девять таких модификаций[22].
Химические свойства
Метан — первый член гомологического ряда насыщенных углеводородов (алканов), наиболее устойчив к химическим воздействиям. Подобно другим алканам вступает в реакции радикального замещения — галогенирования, сульфохлорирования, сульфоокисления, нитрования и других, но обладает меньшей реакционной способностью по сравнению с другими алканами.
Для метана специфична реакция с парами воды — реакция парового риформинга, для которой в промышленности в качестве катализатора применяется никель, нанесённый на оксиде алюминия (Ni/Al2O3) при 800—900 °C или без применения катализатора при 1400—1600 °C. Образующийся в результате реакции синтез-газ может быть использован для последующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов, это основной экономичный способ производства водорода:
.
Горит в воздухе голубоватым пламенем, при этом выделяется энергия около 33,066 МДж на 1 м³ метана, взятого при нормальных условиях. Реакция горения метана в кислороде или воздухе:
+ 891 кДж.
Вступает с галогенами в реакции замещения, которые проходят по свободно-радикальному механизму (реакция металепсии)? например, реакции последовательного хлорирования до четырёххлористого углерода:
,
,
,
.
Выше 1400 °C разлагается по реакции:
.
Окисляется до муравьиной кислоты при 150—200 °C и давлении 30—90 атм. по цепному радикальному механизму:
.
Соединения включения
Метан образует соединения включения — газовые гидраты, широко распространённые в природе.
Применение
Метан используется в качестве топлива для печей, водонагревателей, автомобилей[23][24], турбин и др. Для хранения метана может использоваться активированный уголь.
Как основной компонент природного газа метан используется для производства электроэнергии при сжигании его в газовых турбинах или парогенераторах. По сравнению с другими видами углеводородного топлива метан производит меньше углекислого газа на единицу выделенного тепла. Теплота сгорания метана около 891 кДж/моль и ниже, чем у любого другого углеводорода. Тем не менее, он производит больше тепла на единицу массы (55,7 кДж/г), чем любое другое органическое вещество из-за относительно большого содержания водорода, что вносит вклад водорода в теплоту сгорания в размере около 55 %[25], но составляет только 25 % молекулярной массы метана.
Во многих городах метан подаётся в дома для отопления и приготовления пищи. При этом его обычно называют природным газом, содержание энергии в котором составляет 39 МДж/м3. Сжиженный природный газ (СПГ) представляет собой преимущественно метан (CH4), сжижаемый для удобства хранения и/или транспортировки.
Метан активно применяется в качестве топлива для транспортных средств. Многие страны используют метан в качестве топлива для автобусов, грузовиков и легковых автомобилей.[26] В развитых странах уже существует разветвленная инфраструктура для заправки транспортных средств метаном, что способствует распространению автомобилей, работающих на этом экологически чистом топливе.[27]
Жидкий метан, в сочетании с жидким кислородом, рассматривается в качестве перспективного ракетного топлива[28][29] и используется в таких двигателях, как РД-0162, BE-4[30] и Raptor. Метан имеет преимущества перед керосином в том, что он:
- даёт больший удельный импульс[31];
- оставляет меньше продуктов сгорания на внутренних частях ракетных двигателей[30];
- позволяет легче освободить полости двигателя от остатков топлива[32].
Это уменьшает сложность повторного использования ракет[30][33].
Метан используется в качестве сырья в органическом синтезе, в том числе для производства метанола.
Физиологическое действие
Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан не оказывает и не ядовит (из-за малой растворимости метана в воде и плазме крови и присущей парафинам химической инертности). Погибнуть человеку в воздухе с высокой концентрацией метана можно только от недостатка кислорода в воздухе. Так, при содержании в воздухе 25—30 % метана появляются первые признаки удушья (учащение пульса, увеличение объёма дыхания, нарушение координации тонких мышечных движений и т. д.). Более высокие концентрации метана в воздухе вызывают у человека кислородное голодание — головную боль, одышку, — симптомы, характерные для горной болезни.
Так как метан легче воздуха, он не скапливается в проветриваемых подземных сооружениях. Поэтому случаи гибели людей от удушья при вдыхании смеси метана с воздухом весьма редки.
Первая помощь при тяжёлом удушье: удаление пострадавшего из вредной атмосферы. При отсутствии дыхания немедленно (до прихода врача) искусственное дыхание изо рта в рот. При отсутствии пульса — непрямой массаж сердца.
Хроническое действие метана
У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в незначительных количествах метан и другие газообразные парафиновые углеводороды, описаны заметные сдвиги со стороны вегетативной нервной системы (положительный глазосердечный рефлекс, резко выраженная атропиновая проба, гипотония) из-за очень слабого наркотического действия этих веществ, сходного с наркотическим действием диэтилового эфира.
Биологическая роль
Показано, что эндогенный метан способен вырабатываться не только метаногенной микрофлорой кишечника, но и клетками эукариот, и что его образование значительно возрастает при экспериментальном вызывании клеточной гипоксии, например, при нарушении работы митохондрий при помощи отравления организма экспериментального животного азидом натрия, известным митохондриальным ядом. Высказывается предположение, что образование метана клетками эукариот, в частности животных, может быть внутриклеточным или межклеточным сигналом испытываемой клетками гипоксии[34].
Также показано увеличение образования метана клетками животных и растений под влиянием различных стрессовых факторов, например, бактериальной эндотоксемии или её имитации введением бактериального липополисахарида, хотя, возможно, этот эффект наблюдается не у всех видов животных (в эксперименте исследователи получили его у мышей, но не получили у крыс)[35]. Возможно, что образование метана клетками животных в подобных стрессовых условиях играет роль одного из стрессовых сигналов.
Предполагается также, что метан, выделяемый кишечной микрофлорой человека и не усваиваемый организмом человека (он не метаболизируется и частично удаляется вместе с кишечными газами, частично всасывается и удаляется при дыхании через лёгкие), не является «нейтральным» побочным продуктом метаболизма бактерий, а принимает участие в регуляции перистальтики кишечника, а его избыток может вызывать не только вздутие живота, отрыжку, повышенное газообразование и боли в животе, но и функциональные запоры[36].
Метан и экология

Является парниковым газом, более сильным в этом отношении, чем углекислый газ, из-за наличия глубоких колебательно-вращательных полос поглощения его молекул в инфракрасном спектре. Если степень воздействия углекислого газа на климат условно принять за единицу, то парниковая активность того же молярного объёма метана составит 21—25 единиц[38][39]. Однако время жизни метана в атмосфере невелико (от нескольких месяцев до нескольких лет), поскольку он окисляется кислородом до углекислого газа в тропосфере под действием грозовых разрядов и в стратосфере под действием УФ-С излучения Солнца.
С 1750 года концентрация метана в атмосфере Земли увеличилась примерно на 150 %, и на её долю приходится 20 % от общего радиационного воздействия всех долгоживущих и глобально смешанных парниковых газов[40].
Примечания
Литература
- Львов М. Д. Болотный газ или метан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.