Pirol
Pirol je heterociklično aromatično organsko jedinjenje. To je petočlani prsten sa formulom C4H4NH.[5][6] On je bezbojna isparljiva tečnost koja potamni nakon izlaganja vazduhu. Supstituisani derivati se takođe nazivaju pirolima, npr., N-metilpirol, C4H4NCH3. Porfobilinogen, trisupstituisani pirol, je biosintetički prekurzor mnogih prirodnih proizvoda kao što je hem.[7]
| Pirol | |||
|---|---|---|---|
 |  | ||
 |  | ||
| IUPAC ime |
| ||
| Identifikacija | |||
| CAS registarski broj | 109-97-7 | ||
| PubChem[1][2] | 8027 | ||
| ChemSpider[3] | 7736 | ||
| UNII | 86S1ZD6L2C | ||
| EINECS broj | |||
| UN broj | 1992, 1993 | ||
| ChEBI | 19203 | ||
| ChEMBL[4] | CHEMBL16225 | ||
| RTECS registarski broj toksičnosti | UX9275000 | ||
| Bajlštajn | 1159 | ||
| Gmelin Referenca | 1705 | ||
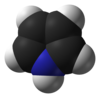
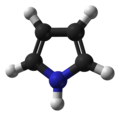
| Jmol-3D slike | Slika 1 Slika 2 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C4H5N | ||
| Molarna masa | 67.09 g mol−1 | ||
| Gustina | 0.967 g cm-3 | ||
| Tačka topljenja | −23 °C, 250 K, -9 °F | ||
| Tačka ključanja | 129-131 °C, 402-404 K, 264-268 °F | ||
| Napon pare | 7 mmHg at 23 °C | ||
| Viskoznost | 0.001225 Pa s | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH | 108.2 kJ mol-1 (gas) | ||
| Std entalpija sagorevanja ΔcH | 2242 kJ mol-1 | ||
| Specifični toplotni kapacitet, C | 1.903 J k-1 mol k-1 | ||
| Opasnost | |||
| NFPA 704 | |||
| Tačka paljenja | 33.33 °C | ||
| Tačka spontanog paljenja | 550 °C | ||
| Eksplozivni limiti | 3.1-14.8% | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Osobine
Pirol ima veoma nisku baznost u poređenju sa konvencionalnim aminima i nekim drugim aromatičnim jedinjenjima kao što je piridin. Ova umanjena baznost je posledica delokalizacije slobodnog para elektrona atoma azota u aromatičnom prstenu. Pirol je veoma slaba baza sa pKaH vrednošću od oko −4. Protonacija dovodi do gubitka aromatičnosti, i stoga nije spontana.
Kao i mnogi drugi amini, pirol potamni pri izlaganju vazduhu i svetlosti, i neohodno je da se destiliše neposredno pre upotrebe.[8]
Sinteza
Pirol se industrijski priprema tretmanom furana sa amonijakom u prisustvu čvrstog kiselog katalizatora.[9]
Jedan sintetički put pirola je dekarboksilacija amonijum mukata, amonijumove soli galaktozne kiseline. So se tipično zagreva pod destilacionom uslovima sa glicerolom kao rastvaračom.[10]
Supstituisani piroli
Mnogi metodi postoje za organsku sintezu derivata piola. Klasične „imenovane reakcije“ su Knorova sinteza pirola, Hantzschova sinteza pirola, i Pal-Knorova sinteza.
Početni materijali Piloti-Robinsonove sinteze pirola su 2 ekvivalenta aldehida i hidrazin.[11][12] Proizvod je pirol sa specifičnim supstituentima u pozicijama 3 i 4. Aldehid reaguje sa diaminom da formira intermedijar di-imin (R–C=N−N=C–R), koji sa hlorovodoničnom kiselinom zatvara prsten i gubi amonijak.
U jednoj modifikaciji, propionaldehid se tretira prvo sa hidrazinom, a onda sa benzoil hloridom na visokim temperaturama i uz pomoć mikrotalasnog ozračivanja:[13]
U drugom stupnju, dolazi do [3,3]sigmatropne reakcije između dva intermedijara.
Pirol može da bude polimerizovan u polipirol.
Reaktivnost
NH proton pirola je umereno kiseo sa pKa vrednošću od 16.5. Pirol se može deprotonovati sa jakim bazama kao što je butil litijum i natrijum hidrid. Rezultirajući alkalni pirolid je nukleofilan. Treatiranje te konjugovane base sa elektrofilima kao što je metil jodid daje N-metilpirol.
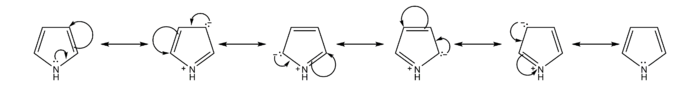
Rezonantni oblici pirola daju uvid u reaktivnost ovog jedinjenja. Poput furana i tiofena, pirol je reaktivniji od benzena u elektrofilnoj aromatičnoj supstituciji, jer ima sposobnost stabilizacije pozitivno naelektrisanih karbokatjonskih intermedijara.
Pirol podleže elektrofilnoj aromatičnoj supstituciji predominantno u 2 i 5 pozicijama. Dve takve reakcije od posebnog značaja za formiranje funkcionalizovanih pirola su Manichova reakcija i Vilsmeier-Hakova reakcija,[14] obe od kojih su kompatibilne sa mnoštvom pirolnih supstrata.
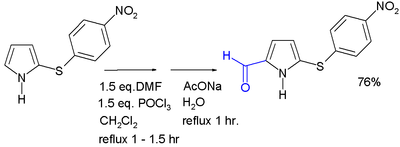
Formilacija derivata pirola[14])
Vidi još
Literatura
- Armarego, Wilfred, L.F.; Chai, Christina, L.L. (2003). Purification of Laboratory Chemicals (5th izd.). Elsevier. str. 346.
- Loudon, Marc G. (2002). „Chemistry of Naphthalene and the Aromatic Heterocycles.”. Organic Chemistry (Fourth izd.). New York: Oxford University Press. str. 1135-1136. ISBN 978-0-19-511999-2.