Toluen
Toluen (toluol) je čista u vodi nerastvorna tečnost sa tipičnim mirisom rastvarača. Hemijski on je mono-substituisani derivat benzena, i.e. jedan atom vodonika benzenje zamenjen CH3 grupom.[6]
| Toluene | |||
|---|---|---|---|
 |  | ||
| IUPAC ime |
| ||
| Drugi nazivi | fenilmetan toluol Anisen | ||
| Identifikacija | |||
| CAS registarski broj | 108-88-3 | ||
| PubChem[1][2] | 1140 | ||
| ChemSpider[3] | 1108 | ||
| UNII | 3FPU23BG52 | ||
| DrugBank | DB01900 | ||
| KEGG[4] | |||
| ChEBI | 17578 | ||
| ChEMBL[5] | CHEMBL9113 | ||
| RTECS registarski broj toksičnosti | XS5250000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C7H8 or C6H5CH3 | ||
| Molarna masa | 92.14 g/mol | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 0.8669 g/mL (20 °C) | ||
| Tačka topljenja | −93 °C, 180 K | ||
| Tačka ključanja | 110.6 °C, 383.8 K | ||
| Rastvorljivost u vodi | 0.47 g/L (20–25 °C) | ||
| Indeks prelamanja (nD) | 1.497 (20 °C) | ||
| Viskoznost | 0.590 cP na 20 °C | ||
| Struktura | |||
| Dipolni moment | 0.36 D | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | SIRI.org | ||
| Opasnost u toku rada | veoma zapaljiv | ||
| NFPA 704 | |||
| R-oznake | R11, R38, R48/20, R63, R65, R67 | ||
| S-oznake | S2, S36/37, S29, S46, S62 | ||
| Tačka paljenja | 4 °C (39 °F) | ||
| Srodna jedinjenja | |||
| Srodna aromatični ugljovodonici | benzen ksilen naftalen | ||
| Srodna jedinjenja | metilcikloheksan | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
On je aromatični ugljovodonik koji je širokoj upotrebi kao industrijska sirovina i rastvarač. Poput drugih rastvarača, toluen se u nekim slučajevima takođe koristi kao inhalirajući lek zbog svojih opojnih svojstava; međutim, to može potencijalno da prouzrokuje ozbiljne neurološke povrede.[7][8] Toluen je važan organski rastvarač, ali isto tako ima sposobnost rastvaranja brojnih neorganskih hemikalija kao što je sumpor.[9]
Istorija
Toluen je prvi put dobijen 1844. godine putem suve destilacije iz tolubalzama. Otkrio ga je francuski hemičar Henri Etien Sant-Klara Devil. Iz toluena je 1861. hemičar Josef Vilbrand dobio TNT (trinitrotoluen), mada ne potpuno hemijski čist.
Hemijske osobine
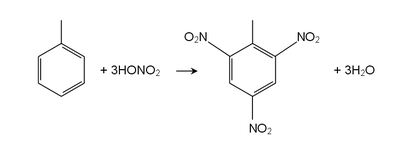
Toluen reaguje kao normalan aromatičan ugljovodonik u pogledu elektrofilne aromatične supstitucije.[10][11][12] Metilna grupa ga čini oko 25 puta reaktivnijim od benzena u takivm reakcijama. On podleže sulfonaciji i daje p-toluenesulfonsku kiselinu, i hlorinaciji sa Cl2 u prisustvu FeCl3 i daje orto i para izomere hlorotoluena. On podleže nitraciji čime nastaju orto i para nitrotoluenski izomeri, ali ako se zagreje daje dinitrotoluen i ultimatno eksploziv trinitrotoluen (TNT).
Sa drugim reagensima metil bočni lanac toluena može da reaguje, podležući oksidaciji. Reakcija sa kalijum permanganatom i razblaženom kiselinom (npr. sumpornom kiselinom) ili kalijum permanganatom sa koncentrovanom sumpornom kiselinom, proizvodi benzojevu kiselinu, dok reakcija sa hromil hloridom daje benzaldehid (Etardova reakcija). Halogenacija se može izvesti pod uslovima slobodnih radikala. Na primer, N-bromosukcinimid (NBS) zagrevan sa toluenom u prisustvu AIBN dovodi do benzil bromida. Toluen se takože može tretirati sa elementarnim bromom u prisustvu UV svetla (direktna sunčeva svetlost) da proizvede benzil bromid. Toluen se isto tako može brominisati tretiranjem sa HBr i H2O2 u prisustvu svetla [13].
Katalitička hidrogenacija toluena do metilcikloheksana zahteva visok pritisak vodonika do bi se završila, zbog stabilnosti aromatičnog sistema. pKa je aproksimativno 45.
Literatura
Spoljašnje veze
- ATSDR
- Rastvorljivost Arhivirano 2007-09-28 na Wayback Machine-u
- Tehnička specifikacija naftnog toluena Arhivirano 2012-04-06 na Wayback Machine-u