Аспарагін
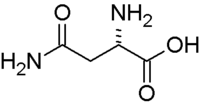
Аспарагі́н (прийняті скорочення: Асн, Asn, N) — амід аспарагінової кислоти (2-аміно-бутанамід-4-ова кислота), одна із двадцяти амінокислот, що входять до складу білків. У мРНК аспарагін кодується триплетами нуклеотидів AAU і AAC. Ця амінокислота бере участь у синтезі сечовини й піримідинових основ і переамінуванні амінокислот.[2]
| Аспарагін | |
|---|---|
 | |
| Ідентифікатори | |
| Номер CAS | 3130-87-8 |
| Номер EINECS | 221-521-1 |
| KEGG | C16438 |
| ChEBI | 22653 |
| SMILES | C(C(C(=O)O)N)C(=O)N[1] |
| InChI | InChI=1S/C4H8N2O3/c5-2(4(8)9)1-3(6)7/h2H,1,5H2,(H2,6,7)(H,8,9) |
| Номер Бельштейна | 1723525 |
| Номер Гмеліна | 3334 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Із двадцяти амінокислот, що кодуються генетичним кодом, аспарагін був відкритий першим у 1806 році. Його назва походить від слова asparagus, оскільки його виділили із спаржі (Asparagus officinalis)[3].
Аспарагін не є незамінною амінокислотою для людини, він може бути синтезований із глутаміну і аспарагінової кислоти у реакції, каталізованій ферментом аспарагінсинтазою.
Рівень аспарагінсинтази дуже низький у ракових клітинах гострого лімфобластного лейкозу, через що вони не ростуть без аспрагіну. Це дозволяє використовувати фермент аспарагіназу, що розщеплює аспарагін у сироватці крові до аспарагінової кислоти і аміаку, для знешкодження цих клітин. Така терапія госторого лімфобластного лейкозу успішно використовується вже близько 40 років[4].
Під час приготування їжі, при нагріванні може відбуватися реакція між аспарагіном і редукованими цукрами, внаслідок якої в їжі з'являється акриламід. Так акриламід утворюється в смаженій картоплі, чипсах і смажених тостах з хлібу.
Історія відкриття
Аспарагін вперше виділили в 1806 році французькі хіміки Луї Ніколя Воклен та П'єр-Жан Робіке зі соку спаржі (лат. Asparagus), на честь якої і назвали сполуку. Це була перша амінокислота, яку вченим вдалося виділити.
У 1809, Pierre Jean Robiquet виділив з кореня локриці речовину, яку охарактерихував, як дуже схожу на аспарагін. Plisson у 1828 виявив, що ця речовина насправді також була аспарагіном.
Структурна функція аспарагіну в білках
За рахунок того, що бічний ланцюг аспарагіну може утворювати водневі зв'язки, ця амінокислота бере участь в утворенні вторинної структури білків. Наприклад, її часто виявляють на початку альфа-спіралей, а також у бета-складчатих листах.
Аспарагін також є амінокислотою, по якій відбувається модифікація білків шляхом N-глікозилювання. До цієї амінокислоти приєднується вуглеводний ланцюг. Зазвичай вуглеводний ланцюг може бути приєднаним до залишків аспарагіну, якщо останній знаходиться на С-кінці поруч з послідовністю Х-серін або Х-треонін, де Х- будь-яка аміноксилота, за винятком проліну.
Примітки
Джерела
- АСПАРАГІН [Архівовано 10 березня 2016 у Wayback Machine.] Фармацевтична енциклопедія
 | Це незавершена стаття з біохімії. Ви можете допомогти проєкту, виправивши або дописавши її. |