Нітрили
Нітри́ли — клас органічних сполук, які мають у своїй структурі функціональну групу C≡N. В цій групі атоми вуглецю та азоту зв'язані потрійним зв'язком. Щоб показати присутність нітрильної групи в молекулі використовують префікс ціано-. Інколи групу -CN називають ціанідною або ціаногрупою, а сполуки, де вона міститься, — ціанідами.
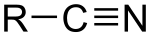
Нітрили можуть утворювати дуже токсичний іон CN−.
Історія
Першу сполуку гомологічного ряду нітрилів — нітрил мурашиної кислоти — вперше синтезував Карл Вільгельм Шеєле в 1782 році[1]. У 1811 році Жозеф Луї Гей-Люссак зумів синтезувати летку і дуже отруйну чисту кислоту. Нітрили аренових кислот вперше синтезували Фрідріх Велер і Юстус фон Лібіх, але зважаючи на малі виходи синтезів не було досліджено фізико-хімічних властивостей і не запропоновано будь-якої структурної формули. Теофіл-Джулез Пелоуз у 1834 році синтезував пропіоновий нітрил, назвавши його етером пропіонового спирту і синильної кислоти.[2] Приготування бензонітрилу Германом Фелінгом у 1844 році шляхом нагрівання бензоату амонію, стало першим методом, який дозволив отримувати достатні для проведення хімічного аналізу кількості речовин. Він підтвердив структуру сполуки, порівнюючи свої результати з відомим на той час синтезом синильної кислоти, шляхом нагрівання форміату амонію. Для відкритої речовини він застосував термін нітрил, який дав назву цілій групі сполук[3].
Нітрили містяться в ряді рослинних та тваринних джерел. Зокрема їх зустрічають у фруктах, особливо в мигдалі.
Понад 120 природних нітрилів міститься в землі і в морі.
Отримання
Нітрили можна отримати органічним синтезом, за допомогою таких методів:
- Реакція нуклеофільного аліфатичного заміщення алкілгалогенідів метал ціанідами. Це синтез нітрилів Колбе. Арил нітрили готуються синтезом Розенмунда фон Брауна.
- Реакція дегідратації первинних амідів. При проведенні цієї реакції утворюються численні проміжні речовини. Етилдихлорофосфат та 1,8-Діазобіцикло[5.4.0]ундец-7-ен одні з багатьох на шляху перетворення бензаміду у бензонітрил[4]:
- Реакція дегідратації вторинних амідів (дегідратація амідів фон Брауна)
- Реакція дегідратації альдоксиму з тріетиламіном/діоксидом сірки чи цеолітами.
- Синтез за участю альдегіду з гідроксиламіном та сульфатом натрію.

- В одну стадію[5] ароматичний чи аліфатичний альдегід реагує з гідроксиламіном та безводним сульфатом натрію в сухому середовищі, при короткотривалому мікрохвильовому опроміненню.
- Взаємодія метал ціанідів з альдегідами (ціаногідринова реакція).
- З арилкарбоксильних кислот (нітрильний синтез Летта).
- Ароматичні нітрили можна отримати з діазосполук реакцією Зандмеєра.
- З алкенів і алкінів гідроціануванням.
- В промисловості ціанідну групу отримують з ціаніду диетилалюмінію Et2AlCN, який одержують з триетилалюмінію та HCN[6].
- Ціанід-іони полегшують сполучення дибромідів. Реакція α,α'-дибромоадипінової кислоти з ціанідом натрію в етанолі в результаті дає ціаноциклобутан[7].
Хімічні властивості
Нітрильні групи при відповідних умовах можуть вступати в різні реакції. Нітрильну групу можна гідролізувати, відновити чи відщепити від сполуки у вигляді ціанід-іону.
- Гідроліз нітрилів RCN протікає у кілька стадій в присутності кислоти чи основи з утворенням карбоксиламідів RC(=O)NH2, а згодом карбонових кислот. Гідроліз нітрилів вважається одним із найкращих методів одержання карбонових кислот. Однак ця реакція, каталізована основою або кислотою, має певні недоліки та/або перешкоди при приготуванні амідів. Головна перешкода полягає в кінцевій нейтралізації, як кислоти, так і основи, яка спричиняє потужне солеутворення з нестійким продуктом розкладу і забруднення кінцевого продукту. Також є такі обмеження:
- Реакція каталізована основою. Кінетичні вивчення дозволили оцінити порівняльні швидкості гідратації кожної стадії реакції і, як типовий приклад, констант швидкості гідролізу, каталізованого гідроксид-іоном, ацетонітрилу та ацетаміду, які становлять 1,6·10-6 і 7,4·10-5 відповідно. Порівняння цих двох значень показало, що друга стадія гідролізу, каталізованого основою, проходить із більшою швидкістю ніж перша, і реакція радше проходитиме до кінцевого продукту гідратації (солі карбонової кислоти), ніж зупиниться на стадії утворення аміду. Це наводить на думку, що аміди, отримані реакцією, каталізованою основою, будуть забруднені карбоновими кислотами і їх можна виділити тільки в невеликих кількостях.
- Реакції каталізовані кислотами. Використання розчинів сильних кислот вимагає ретельного контролю температури та співвідношень реагентів для запобігання утворення полімерів, які підвищують екзотермічний характер гідролізу[10].
- У реакції відновлення нітрил реагує з воднем в присутності нікелевого каталізатора. Продуктом цієї реакції є амін.
- У реакціях нуклеофільного приєднання нітрил є електрофілом:
- з цинковмісними органічними речовинами в реакції Блеізе;
- та зі спиртами в реакції Піннера.
- також, в реакції амінсаркозіну з ціанамідом, яка дає креатин[11]
- Нітрили реагують в ацилюванні Фріделя-Крафтса в реакції Гоубена — Гоеша до кетонів.
- В реакції відновного деціанування нітрильна група заміщується протоном[12].
- Нітрили самовільно реагують у присутності основ у реакції Торпе в нуклеофільному приєднанню.
- В металоорганічній хімії нітрили відомі приєднанням до алкенів в карбоціануванні[13]:
Органічні ціанаміди
Ціанаміди — це N-ціано сполуки з загальною будовою R1R2N-CN і пов'язані з неорганічним джерелом ціанамідом. Для прикладу дивіться: реакція фон Брауна.
Вплив на живі організми
Нітрили — токсичні речовини, механізм дії яких пов'язаний зі здатністю порушувати функцію ферменту цитохромоксидази і які стримують процес перенесення кисню з крові до клітин організму. Отруєння може відбутися при вдиханні парів, при потраплянні в шлунково-кишковий тракт або через шкіру в організм.
Див. також
Примітки
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0



