سيليكون
السيليكون [ملاحظة 1] هو عنصر كيميائي رمزه Si وعدده الذرّي 14؛ يقع ضمن عناصر الدورة الثالثة وفي المرتبة الثانية في المجموعة الرابعة عشرة (المجموعة الرابعة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري. يُصنَّف السيليكون من أشباه الفلزّات، ويوجد في الشروط القياسية على شكل صلب بلّوري هشّ ذي بريق معدني رمادي مزرق. السيليكون رباعيّ التكافؤ، وهو ضعيف النشاط الكيميائي نسبياً، لكنّه يمتاز بألفته الكيميائية الكبيرة تجاه الأكسجين.
| |||||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| رمادي له بريق أزرق الخطوط الطيفية للسيليكون | |||||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | سيليكون، 14، Si | ||||||||||||||||||||||||||||||
| تصنيف العنصر | شبه فلز | ||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14، 3، p | ||||||||||||||||||||||||||||||
| الكتلة الذرية | 28.0855 غ·مول−1 | ||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ne] 3s2 3p2] | ||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 4 (صورة) | ||||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 2.3290 غ·سم−3 | ||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 2.57 غ·سم−3 | ||||||||||||||||||||||||||||||
| نقطة الانصهار | 1687 ك، 1414 °س، 2577 °ف | ||||||||||||||||||||||||||||||
| نقطة الغليان | 3538 ك، 3265 °س، 5909 °ف | ||||||||||||||||||||||||||||||
| حرارة الانصهار | 50.21 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||
| حرارة التبخر | 359 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 19.789 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 3 , 2 , 1[1] -1, -2, -3, -4 (أكسيد مذبذب) | ||||||||||||||||||||||||||||||
| الكهرسلبية | 1.90 (مقياس باولنغ) | ||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 786.5 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||
| الثاني: 1577.1 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||
| الثالث: 3231.6 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||
| نصف قطر ذري | 111 بيكومتر | ||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 111 بيكومتر | ||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 210 بيكومتر | ||||||||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||||||||
| البنية البلورية | بنية الألماس المكعبة | ||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[2] | ||||||||||||||||||||||||||||||
| مقاومة كهربائية | 103 [3]أوم·متر (20 °س) | ||||||||||||||||||||||||||||||
| الناقلية الحرارية | 149 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||||
| التمدد الحراري | 2.6 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 8433 متر/ثانية (20 °س) | ||||||||||||||||||||||||||||||
| معامل يونغ | 185[3] غيغاباسكال | ||||||||||||||||||||||||||||||
| معامل القص | 52[3] غيغاباسكال | ||||||||||||||||||||||||||||||
| معامل الحجم | 100 غيغاباسكال | ||||||||||||||||||||||||||||||
| نسبة بواسون | 0.28[3] | ||||||||||||||||||||||||||||||
| صلادة موس | 7 | ||||||||||||||||||||||||||||||
| رقم CAS | 7440-21-3 | ||||||||||||||||||||||||||||||
| طاقة فجوة النطاق عند 300 كلفن | 1.12 eV | ||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر السيليكون | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
كان يونس ياكوب بيرسيليوس أوّل من وصف هذا العنصر بشكله النقيّ على نحوٍ مفصّل، وذلك سنة 1823. يأتي السيليكون في المرتبة الثامنة وفقاً لترتيب وفرة العناصر الكيميائية في الكون على أساس الكتلة؛ ولكنّه نادراً ما يوجد في الأرض بشكله النقيّ الحرّ. إذ يوجد السيليكون في الطبيعة بشكلٍ سائدٍ على شكل ثنائي أكسيد السيليكون، وهو المكوّن الرئيسي للرمل؛ كما تنتشر السيليكات بشكلٍ كبيرٍ أيضاً في العديد من المعادن في القشرة الأرضية. تتألّف قرابة 90% من القشرة الأرضية من معادن السيليكات، ممّا يجعل السيليكون ثاني أكثر العناصر الكيميائية وفرةً في القشرة الأرضية (قرابة 28% بالنسبة إلى الكتلة) بعد الأكسجين.[4]
يُستخدَم معظم السيليكون تجارياً على شكل سيليكات دون الحاجة إلى عزل السيليكون بشكله الحرّ، وتتضمّن الأمثلة على هذه الاستخدامات دخوله على شكل رمل أو صلصال أو صخر في مجال الإنشاءات البنائية. كما تُستخدَم السيليكات في الأسمنت البورتلاندي من أجل الملاط والزخارف الجصّية؛ كما تُمزَج مع الرمل والحصى لتحضير الخرسانة؛ وتدخل أيضاً في تركيب الخزف والبورسلان؛ وكذلك في تركيب أنواع مختلفة من الزجاج، مثل زجاج الصودا والجير. هناك المزيد من مركّبات السيليكون الأخرى، مثل كربيد السيليكون، والتي تُستخدَم في تصنيع المواد الساحجة والمواد السيراميكية عالية المتانة. بالإضافة إلى ذلك فإنّ السيليكون هو أساس البوليميرات واسعة الانتشار التي تدعى بالسيليكونات.
لعنصر السيليكون تأثير كبير على اقتصاد العالم الحديث منذ أواخر القرن العشرين إلى أوائل القرن الحادي والعشرين، ممّا أدّى إلى وصف تلك الفترة باسم «العصر السيليكوني» (وهو مرادف لمُسمّيَات أخرى أكثر انتشاراً مثل عصر المعلومات). إذ أنّ السيليكون الحرّ مرتفع النقاوة أساسي في صناعة أشباه الموصلات والترانزستورات وشرائح الدارات المتكاملة؛ والتي هي المكوّنات الأساسية في صناعة الأجهزة الإلكترونية مثل الحواسيب والهواتف المحمولة. للسيليكون العنصري الحرّ أيضاً تطبيقات في مجال تنقية الفولاذ وفي صبّ الألومنيوم، كما يُستخدَم لتحضير الكيماويات النقيّة الدقيقة (غالباً لصناعة السيليكا المُدَخّنة).
لا يُعَدّ السيليكون العنصري الحرّ سامّاً بالنسبة للإنسان؛ وهو هامّ على شكل سيليكات بالنسبة لهيكل جسم الإنسان. تحتاج الحيوانات إلى كمّيّات قليلة من السيليكون؛[5] مع ذلك، فإنّ العديد من الإسفجنيّات والكائنات الحيّة الدقيقة مثل الدياتومات والشعوعيات تحتاج للسيليكون كي تصنع هياكلها. كما يتوضّع السيليكون في العديد من أنسجة النباتات.[6]
التاريخ
نظراً لوفرة مركّبات السيليكون الطبيعية في القشرة الأرضية فقد استُخدَم السيليكون منذ التاريخ القديم على شكل رمل وسيليكات في العديد من تطبيقات الحياة اليومية. فقد كان المرو (الكوارتز) معروفاً للعديد من الحضارات القديمة مثل حضارتي مصر والصين القديمَتين، وكذلك حضارة الفينيقيين، عندما استخدم في صناعة الأواني والحلي، وكذلك الزجاج. كما استخدمت السيليكات المختلفة منذ القدم في تحضير الملاط أثناء إنشاء المساكن البشرية الأولى.[7]
الاكتشاف وأصل التسمية

خمّن أنطوان لافوازييه سنة 1787 أنّ السيليكا قد تكون أكسيداً لعنصر كيميائي أساسي؛[8] إلّا أنّ الألفة الكيميائية المرتفعة للسيليكون تجاه الأكسجين مرتفعة بشكل كبير، فلم يتمكّن بواسطة الوسائل المتاحة لديه آنذاك من اختزال الأكسيد وعزل هذا العنصر على شكله الحرّ.[9] ثمّ توالت المحاولات بهدف الحصول عليه، ومنها محاولة همفري ديفي سنة 1808، والتي قام حينها باقتراح تسمية «سيليسيوم silicium» لهذا العنصر، وذلك من الكلمة اللاتينية «silicis» بمعنى حجر الصوان، مع إضافة اللاحقة «إيوم ium-» للاسم، إذ اعتقد أنّه من الفلزّات.[10] لا تزال هذه التسمية معتمدة كاسم للعنصر في بعض اللغات، مثل الألمانية «Silizium» والتركية «silisyum» والكتالونية «silici». أمّا في بعض اللغات الأخرى فتُستخدَم ترجمة اقتراضية للجذر اللاتيني للإشارة إلى حجر الصوان، كما في الروسية والفنلندية والتشيكية.[11] أمّا تسمية «سيليكون» فقد اقترحها الكيميائي الإسكتلندي توماس تومسون سنة 1817؛ فحافظ على الأصل اللغوي الذي استخدمه ديفي في تسميته، ولكنه أضاف اللاحقة «أون on-»، لاعتقاده أنّ السيليكون هو من اللافلزات، على غرار البورون والكربون.[12]
يُعتَقد أنّ السيليكون اللابلّوري كان قد حُضّر من قبل لوي جوزيف غي ـ لوساك ولوي جاك تينار سنة 1811، وذلك من خلال تسخين فلز البوتاسيوم مع رباعي فلوريد السيليكون؛ لكنّهما لم يقوما بتنقية الناتج أو وصفه بدقّة أو بتمييزه على أنّه عنصر كيميائي جديد.[13] تمكّن يونس ياكوب بيرسيليوس من تحضير السيليكون اللابلّوري سنة 1823، وذلك باستخدام طريقة شبيهة تقريباً بالطريقة التي اتّبعها غي-لوساك، وذلك باختزال سداسي فلوروسيليكات البوتاسيوم بمصهور البوتاسيوم، ولكنّه قام بالتنقية بإعادة غسل الناتج لعدّة مرّات؛[14] ولذلك فإنّ الفضل في اكتشاف هذا العنصر يُنسَب إليه.[15][16] وفي السنة ذاتها تمكّن بيرسيليوس من تحضير رباعي كلوريد السيليكون؛ في حين أنّ مركّب رباعي فلوريد السيليكون كان معروفاً ومُحَضّراً من ذي قبل، إذ تمكّن كارل فلهلم شيله من إنجاز ذلك سنة 1771 حين قام بحلّ السيليكا في حمض الهيدروفلوريك.[9]
لم يُحضَّر الشكل البلّوري من السيليكون إلّا بعد مضي 31 سنة، حين تمكّن هنري إتيان سانت كلير ديفيل من فعل ذلك أثناء تجاربه لتحضير الألومنيوم؛[17][18] وذلك بالتحليل الكهربائي لمزيج من كلوريد الصوديوم وكلوريد الألومنيوم المُشوّب بقرابة 10% من السيليكون، فحصل على شكل بلّوري غير نقي من السيليكون قرابة سنة 1854.[19] طُوّرت لاحقاً طرق أكثر اقتصادية من أجل عزل متآصلات هذا العنصر؛ كما استمرّت الأبحاث في كيمياء السيليكون، فاكتشف فريدرش فولر مركّبات هيدريد السيليكون المتطايرة، واصطنع ثلاثي كلورو السيلان سنة 1857، ثمّ مركّب السيلان سنة 1858.[20] كما قام شارل فريدل وجيمس كرافتس سنة 1863 بتحضير أوّل مركّب سيليكون عضوي، وهو رباعي إيثيل السيلان. في أوائل القرن العشرين تمكّن العلماء من إجراء دراسات أوسع على مركّبات السيليكون لمعرفة خواصها، فكرّس ألفرد شتوك أبحاثه لدراسة مركّبات السيلانات؛[20] في حين تخصّص فريدريك كيبنغ بدراسة مركّبات السيليكون العضوية.[9]
ساهم التطوّر في مختلف مناحي العلوم في زيادة فهم كيمياء السيليكون، فنجح وليام لورنس براغ بفضل أعماله على دراسة البلّورات بالأشعّة السينية في شرح بنية السيليكات؛ كما ساعد لينوس باولنغ في تقدّم كيمياء البلّورات، وفيكتور غولدشميت في تطوير مفاهيم الجيوكيمياء. شهد أواسط القرن العشرين تطوّر المعارف الصناعية فيما يخصّ السيلوكسانات والبوليميرات السيليكونية المرنة. في أواخر القرن العشرين جرى التمكّن من فهم البنية البلّورية للسيليسيدات، بالإضافة إلى فهم المبدأ الفيزيائي عند إشابة أشباه الموصلات.[9]
أشباه الموصلات السيليكونية
لم يتضمّن أوّل جهاز شبه موصل عنصر السيليكون؛ لأنّه كان مصنوعاً من الغالينا (زرنيخيد الرصاص)، بما في ذلك المكشاف البلّوري الذي اخترعه كارل فرديناند براون سنة 1874، والآخر الذي اخترعه جاجاديش تشاندرا بوس سنة 1901.[21][22] أمّا أوّل جهاز شبه موصل مصنوع من السيليكون فكان من اختراع غرينليف ويتتير بيكارد سنة 1906.[22] في سنة 1940 اكتشف راسل أُول وصلة الموجب والسالب [ملاحظة 2] والتأثير الضوئي الجهدي في السيليكون؛ وفي سنة 1941 جرى تطوير التقنيات لإنتاج بلّورات أحادية مفردة من السيليكون والجرمانيوم لأغراض عسكرية أثناء الحرب العالمية الثانية.[21] في سنة 1947 قادت أبحاث وليام شوكلي وجون باردين ووالتر براتين إلى تصنيع أوّل ترانزستور، والذي كان يعمل على مبدأ التلامس النقطي؛ ممّا أدّى إلى حصولهم على جائزة نوبل في الفيزياء؛ لكنّه كان مصنوعاً من الجرمانيوم.[23] لاحقاً وفي سنة 1954 تمكّن موريس تاننباوم [ملاحظة 3] من تصنيع أوّل ترانزستور ثنائي القطب من السيليكون في مختبرات بل.[24] في سنة 1955 وفي مختبرات بل أيضاً اكتشف كلّ من كارل فروش ولينوكلن ديريك [ملاحظة 4]، أنّه يمكن لثنائي أكسيد السيليكون أن ينمو على السيليكون؛[25] ثمّ اقترحا لاحقاً أنّه يمكن بذلك حجب أسطح السيليكون أثناء عمليّات الانتشار الجزيئي.[26]؛
في السنوات الأولى في صناعة أشباه الموصلات وحتى نهايات خمسينيات القرن العشرين كان الجرمانيوم هو العنصر السائد في تركيب الترانزستورات وأجهزة أشباه الموصلات الأخرى؛ وذلك نظراً للاعتقاد أنّ أداء الجرمانيوم أفضل من غيره بسبب قدرته على إظهار خواص أفضل فيما يتعلّق بحركية الإلكترون.[27][28] لم يكن أداء الترانزستورات المصنوعة من السيليكون مرضياً في البدايات بسبب محدودية الموصلية الكهربائية، وذلك نظراً لعدم استقرار الحالات السطحية الإلكترونية كمومياً،[29] إذ أن الإلكترونات كانت تحتجز بسبب الروابط المتدلية الناشئة عند السطح.[30]

حدثت قفزة نوعية في صناعة أشباه الموصلات السيليكونية عندما تمكّن المهندس محمد عطا الله من تطوير عملية التخميل السطحي بواسطة الأكسدة الحرارية في مختبرات بل في أواخر خمسينيات القرن العشرين،[28][30][31] عندما اكتشف أنّ تشكيل طبقة من أكسيد السيليكون على سطح السيليكون حرارياً قلّل بشكل كبير من تركيز السويات الإلكترونية عليه،[31] ممّا أدّى إلى زيادة الاستقرار الإلكتروني لأسطح السيليكون.[32] نشر عطا الله نتائج أبحاثه بين سنتي 1957 و1958؛[33][34] وكان لذلك تأثير كبير على صناعة أشباه الموصلات السيليكونية،[26] فقد تفوّق السيليكون بذلك على الجرمانيوم؛ ، ومهّد الطريق لحدوث ثورة السيليكون؛[28][29][35] ولقد تمثّل ذلك لاحقاً في اختراعه لترانزستور موسفت[ملاحظة 5] مع زميله داون كانغ سنة 1959؛[29] بالإضافة إلى فتح الباب إلى حدوث تطور في صناعة أشباه الموصلات السيليكونية مثل التقنية السطحية التي طوّرها جان هورني في شركة فيرتشايلد لأشباه الموصلات [ملاحظة 6] سنة 1958؛ وكذلك لاختراع الدارة المتكاملة من قبل روبرت نويس سنة 1959.[34][35][36] تطوّر الأمر لاحقاً لاعتماد شكل موحّد في إدماج رقائق السيليكون في تصنيع عناصر أشباه الموصلات في الدارات المتكاملة.[37][38]
العصر السيليكوني
يشير مصطلح «العصر السيليكوني» (أو عصر السيليكون) إلى الفترة الزمنية أواخر القرن العشرين وأوائل القرن الحادي والعشرين؛[29][39][40] وذلك نظراً لكون السيليكون العنصر المهيمن والسائد في عصر المعلومات، وذلك بشكل مشابه لتسميات عصور اقترنت بالمواد السائدة حينها، مثل العصر الحجري والعصر البرونزي والعصر الحديدي في نظام العصور الثلاث الموافق.[29] أدّى اختراع الموسفت إلى إطلاق شرارة الثورة الرقمية وثورة المعلومات؛[29][39][41] كما مكّن صغر حجمه من زيادة الإنتاج بشكل أسي،[42] ودخول الترانزستور في مختلف مناحي الحياة اليومية.[37] كما ازداد عدد الشركات المختصّة في تقنيات أشباه الموصلات بشكل كبير، فأُطلِقَت تسميات حاوية على لفظ السيليكون للإشارة إلى تجمّعها، وأشهر مثال على ذلك هو وادي السيليكون في ولاية كاليفورنيا الأمريكية.[43]
الوفرة الطبيعية

يأتي السيليكون في المرتبة الثامنة تبعاً لترتيب وفرة العناصر الكيميائية في الكون؛[44] أمّا في كوكب الأرض فيشكّل السيليكون 27.7% من وزن القشرة الأرضية، وهو يأتي بذلك في المرتبة الثانية بعد الأكسجين (45.5% وزناً).[45] وينتشر السيليكون بشكل كبير على هيئة ثنائي أكسيد السيليكون، إن كان على هيئة الرمل، أو على شكل معادن، والتي يًصنّف بعضها ضمن الأحجار الكريمة مثل المرو (الكوارتز)، أو الجمشت (الأماثيست)، أو العقيق، أو اليشب، أو الأوبال. ينتشر السيليكون أيضاً في القشرة الأرضية على شكل معادن السيليكات المختلفة، والتي تدخل في تركيب الصخور، مثل الميكا والأسبست والصلصال والفلسبار والحجر الرملي. يمكن أن يُعثَر على السيليكون أحياناً على شكل عنصر طبيعي حرّ في عدّة أماكن من العالم.[46][47][48]
يدخل السيليكون أيضاً في تركيب الطبقات الأعمق، حيث جرى التباين أثناء نشوء كوكب الأرض؛ فتحوي نواة الأرض على التركيب التقريبي Fe25Ni2Co0.1S3؛ أمّا الوشاح فيتألّف بشكل أعظمي من أكاسيد كثيفة ومن معادن السيليكات مثل الأوليفين؛ أمّا المعادن السيليكونية الأخفّ مثل الألومينوسيليكات فهي تدخل في تركيب القشرة.[49] إنّ تبلور الصخور النارية من الصهارة (الماغما) يعتمد على عددٍ من العوامل، منها التركيب الكيميائي للصهارة، ومعدّل التبرّد، والخواص الذاتية المميّزة للمعادن الداخلة في تركيب تلك الصخور ويشمل ذلك طاقة الشبكة البلورية ونقطة الانصهار ودرجة تعقّد البنية البلورية. عندما تتبرّد الصهارة فإنّ الأوليفين هو أوّل ما يتشكّل، يتبعه البيروكسين والأمفيبول وميكا البيوتيت والأورثوكلاس وميكا المسكوفيت والمرو (الكوارتز) والزيوليت، ثم أخيراً المعادن الهيدروحرارية. يُبدي هذا التتابع نزعةً باتجاه تعقّد بنية وحدات السيليكات إبّان التبرّد، كما يبدي أيضاً دخول أنيونات الفلوريد بالإضافة إلى الأكاسيد في البنية؛ علاوةً على ذلك فإنّ التحوّل الحاصل عند درجات حرارة وضغوط مرتفعة يؤدّي إلى حدوث تنوّع أكبر من معادن السيليكات.[49]
تحوي المحيطات كمّيّة معتبرة من السيليكون، وذلك غالباً على شكل حمض السيليسيك؛ والذي ينشأ عبر ما يُعرَف باسم «دورة السيليكا»، وفيها تتفاعل معادن السيليكات، مثل سيليكات الكالسيوم، بشكل مستمرّ مع حمض الكربونيك المنحلّ في مياه المحيطات، ليتشكّل في البداية ميتّا حمض السيليسيك غير المنحلّ:
والذي يتفاعل مع حمض الكربونيك لاحقاً ليشكّل أورثو حمض السيليسيك المنحلّ:
يتفكّك حمض السيليسيك ليعطي ثنائي أكسيد السيليكون والماء، ثم يتفاعل أكسيد الكالسيوم مع ثنائي أكسيد السيليكون لتنغلق الدورة بتشكّل سيليكات الكالسيوم؛ مع العلم أن انغلاق هذه الدورة يتطلّب مرور عدّة ملايين من السنين:
هناك أربعة مصادر لتدفّق السيليكون إلى المحيطات، وتتضمّن التجوية الكيميائية للصخور على اليابسة وكذلك النقل عبر الأنهار، وانحلال الرواسب البرية، بالإضافة إلى التفاعل بين البازلت المغمور وبين التيارات الحرمائية. تتداخل مصادر السيليكون تلك مع الدورة الحيوية الجيوكيميائية ضمن المحيطات.[50] إنّ قرابة ربع كمّيّة غبار الرمال المهبوب إلى المحيطات هو على شكل جسيمات دقيقة من السيليكون، وتقدّر تلك الكمّيّة بين 80-240 ميغاطن. ولكن تلك النسبة تبقى أقلّ من كمّيّة تدفّق السيليكون إلى المحيطات عبر النقل النهري.[51] تأتي كمّيّات الغبار الرملي إلى القسم الشمالي من المحيط الأطلسي والمحيط الهادي من الصحراء الكبرى وصحراء جوبي، على الترتيب.[50]
السيليكا
السيليكا هي الاسم الشائع لمركّب ثنائي أكسيد السيليكون SiO2، وهي توجد في الطبيعة في عدّة ترتيبات بلّورية مختلفة، وأكثرها شيوعاً نمط الكوارتز (المرو)، وهو مكوّن رئيسي في العديد من الصخور مثل الغرانيت والحجر الرملي. يوجد الكوارتز في الشكل النقي على هيئة الكوارتز الشفاف (البلّور الصخري) [ملاحظة 7]، أمّا الأشكال غير النقية فهي تعرَف تحت أسماء الكوارتز الوردي [ملاحظة 8] والكوارتز الدخاني (أو الموريون) [ملاحظة 9] والجمشت (الأميثيست) [ملاحظة 10] والسترين [ملاحظة 11]. توجد أنواع أخرى معروفة ضعيفة التبلور للكوارتز مثل العقيق بأصنافه من العقيق الأبيض والعقيق الأحمر (الينع) والعقيق اليماني، وكذلك اليشب والكريسوبراس وحجر الدم (الهليوتروب) [ملاحظة 12] وحجر الصوان. توجد هناك تحويرات أخرى لثنائي أكسيد السيليكون في عددٍ من المعادن، والتي تتضمّن التريديميت والكريستوباليت، بالإضافة إلى معادن أخرى أقلّ شهرة مثل الكوزيت والستيشوفيت. توجد السيليكا أيضاً على شكل تراب ناعم، فهي المكوّن الرئيسي في تراب المشطورات (الدياتوميت)، كما توجد على شكل مزجّج في معدن التكتيت وحجر السبج (الأوبسديان) [ملاحظة 13]، وعلى شكل نادر في معدن الليتشاتيليريت. هناك أنماط مصطنعة أيضاً من السيليكا، مثل الكيتيت. كما يتألّف الأوبال من تكتّلات بلّورية معقّدة من ثنائي أكسيد السيليكون المُميَّه جزئياً.[52]
- الكوارتز (المرو)
- العقيق
- التريديميت
- الكريستوباليت
- الكوزيت
معادن السيليكات
إنّ قرابة 95% من صخور القشرة الأرضية مكونة من السيليكا أو معادن السيليكات أو الألومينوسيليكات، وهذا ينعكس على كون عناصر الأكسجين والسيليكون والألومنيوم الأكثر وفرةً في القشرة الأرضية، على الترتيب.[53] يمكن لمعادن السيليكات والألومينوسيليكات أن تتباين تبعاً للبنية وعند قياس اتحادية العناصر، وبذلك يمكن تصنيفها اعتماداً على مبادئ بنيوية عامة. يكون لتكرار وحدات {SiO4} رباعية السطوح الأمر المشترك بين جميع تلك المركّبات، وذلك إمّا على شكل بنىً منفصلة بحدّ ذاتها، أو مشتركة مع بعضها ضمن وحدات أكبر بالاشتراك بذرّات الأكسجين الموجودة على الرؤوس.[ar 1] بالتالي يمكن تقسيم السيليكات إلى نيزوسيليكات [ملاحظة 14]، وهي ذات وحدات {SiO4} متمايزة، ولا تشترك بذرّات أكسجين؛ وإلى سوروسيليكات [ملاحظة 15]، وهي ذات وحدات {Si2O7} متمايزة، وتشترك بذرّة أكسجين واحدة؛ وإلى سيليكات حلقية (سيكلوسيليكات) [ملاحظة 16]، وهي ذات بنى حلقية مغلقة؛ وإلى إينوسيليكات [ملاحظة 17]، وهي ذات بنية حلقية مستمرة أو على شكل شريطي، وتشترك بذرّتي أكسجين؛ وإلى فيلوسيليكات [ملاحظة 18] وهي ذات بنى صفائحية مستمرة، وتشترك بثلاث ذرّات أكسجين؛ وإلى تكتوسيليكات [ملاحظة 19]، وهي ذات هياكل ثلاثية الأبعاد مستمرّة، وتشترك بأربع ذرّات أكسجين.[53]

تنتمي مركّبات الأورثوسيليكات [ملاحظة 20]، والتي تحمل الصيغة العامة M2SiO4 من فصيلة النيزوسيليكات، وهي تختلف بعدد المواقع التناسقية حسب الفلزّ المرافق M، ففي أوروثوسيليكات البيريليوم (الفيناكيت) هناك أربع مواقع تناسقية؛ أمّا باقي الفلزّات، مثل المغنيسيوم والمنغنيز والحديد والزنك، فهناك ستّة مواقع تناسقية، كما في الزبرجد الزيتوني (الأوليفين)؛ في حين أنّ الزركونيوم يتطلّب ثمانية مواقع تناسقية كما هو الحال في الزركون ZrSiO4، وذلك بسبب كبر نصف القطر الأيوني (84 بيكومتر) لأيون الزركونيوم الرباعي.[53] أمّا مركّبات الميتاسيليكات السلسلية
∞{2−
3SiO} فهي تتشكّل من تشارك زوايا سلسلة لامتناهية من رباعيات السطوح {SiO4}؛ ولكن تظهر هناك تباينات نظراً لاختلاف المسافات المتكرّرة للتشكيل الهندسي على طول خطّ رباعيات السطوح. ولكن أكثر مسافة تكرار شيوعاً هي 2، كما هو الحال في معادن البيروكسين، على الرغم من أنّ مسافات تكرار من 1 أو 3 أو 4 أو 5 أو 6 أو 7 أو 9 هي معروفة أيضاً. يمكن لتلك السلاسل أن تتشابك مع بعضها لتشكّل سلاسل مزدوجة أو شرائط، كما هو الحال في معادن الأسبست، والتي تتضمّن أيضاً سلاسل متكرّرة من حلقات رباعية السطوح.[53]
إنّ السيليكات الطبقية، مثل معادن الصلصال والميكا، هي شائعة جداً، وهي غالباً ما تتشكّل من التشابك الأفقي لسلاسل الميتاسيليكات [ملاحظة 21]، أو من التكاثف المستوي للوحدات الأصغر. مثال على ذلك هو معدن الكاولينيت [Al2(OH)4Si2O5]، والذي يمكن أن تحدث فيه استبدالات مختلفة، بأن يَحلّ أنيون الفلوريد مكان الهيدروكسيل، أو كاتيون المغنيسيوم الثنائي مكان الألومنيوم الثلاثي، وغير ذلك. من جهة أخرى، فإنّه عادةً ما يكون الهيكل ثلاثي الأبعاد من الألومينوسليكات معقّداً جدّاً، ويمكن أن يُبَسّط فهمها انطلاقاً من بنية SiO2 ثلاثية الأبعاد، ثم استبدال نصف ذرات السيليكون الرباعي IVSi بذرّات ألومنيوم ثلاثي IIIAl، ممّا يتطلّب وجود كاتيونات إضافية مقابلة لتعديل الشحنة الكهربائية. تتضمّن الأمثلة عليها كلّ من معادن الفلسبار (وهي أكثر صنف من المعادن انتشاراً على الأرض) والزيوليت، وكذلك صبغة اللازورد.[53]
الإنتاج

يمكن أن يُنتَج السيليكون بدرجات نقاوة مختلفة، وذلك حسب مجال التطبيق اللاحق له؛ فيُميّز بين درجة النقاوة التعدينية (98–99 %)[ملاحظة 22]؛ ودرجة النقاوة الشمسية [ملاحظة 23] (للاستخدام في الخلايا الشمسية يجب أن تكون نسبة الشوائب أقلّ من 0.01%)؛ ودرجة النقاوة الإلكترونية [ملاحظة 24] (نسبة الشوائب أقلّ من جزء واحد في 1010 جزء). تستخدم درجة النقاوة الإلكترونية في صناعة أشباه الموصلات؛ وفي بعض الحالات الخاصّة ينبغي أن تكون نسبة الشوائب أقلّ من جزء واحد في 1210 جزء.[54] .
السيليكون الخام
يُنتَج السيليكون بنقاوة تتراوح بين 96–99% من اختزال الكوارتزيت أو الرمل باستخدام فحم الكوك النقيّ،[ar 2] وذلك داخل فرن القوس الكهربائي عند درجات حرارة تصل إلى قرابة 2000 °س، مع وجود زيادة من ثنائي أكسيد السيليكون SiO2 من أجل إيقاف كربيد السيليكون SiC من التجمّع والتكتّل:[54]
يُعرَف هذا التفاعل باسم «الاختزال الكربوحراري» لثنائي أكسيد السيليكون، وهو عادةً ما يجرى بوجود خردة الحديد مع وجود كمّيّات ضئيلة من الفوسفور والكبريت، ممّا يؤدّي إلى الحصول على سبيكة الفرّوسيليكون.[54] وهي سبيكة مكوّنة من الحديد والسيليكون بنسب متفاوتة، وتعدّ الشكل الرئيس الذي يُنتَج ويُسوَّق فيه السيليكون، لأنها تشكّل قرابة 80% من الإنتاج العالمي له.

تعدّ الصين الرائدة في إنتاج السيليكون على هذا الشكل، وذلك بطاقة إنتاج تصل إلى 4.6 مليون طنّ سنوياً (ما يعادل ثلثي الإنتاج العالمي)؛ تليها روسيا (610 آلاف طنّ)، ثمّ النرويج (330 ألف طنّ)، ثمّ البرازيل (240 ألف طنّ)، ثمّ الولايات المتحدة الأمريكية (170 ألف طنّ)؛ وذلك وفق بيانات سنة 2011.[55] يُستحصَل على السيليكون وفق هذه الأساليب بدرجة نقاوة تعدينية؛ ويُستخدَم بشكل أساسي في صناعة الحديد والفولاذ؛[54] وكذلك في إنتاج السيلانات وفق عملية مولر-روتشو، والتي تُستخدَم في تحضير السيليكونات.[56]
تتضمّن الأساليب الأخرى لإنتاج السيليكون بدرجة نقاوة تعدينية كلّ من عملية «الاختزال الألومينوحراري»، والتي يستخدم فيها الألومنيوم لاختزال ثنائي أكسيد السيليكون:[57]
وكذلك إجراء عملية تفكك حراري لمركّب السيلان أو رباعي يوديد السيليكون؛ أو اختزال سداسي فلوروسيليكات الصوديوم باستخدام فلزّ الصوديوم.
سيليكون الخلايا الشمسية
تتطلّب صناعة الخلايا الشمسية أن يكون السيليكون بدرجة نقاوة أعلى من 99.99%؛ يمكن الوصول إلى تلك النسبة عن طريق اختزال رباعي كلوريد السيليكون أو ثلاثي كلورو السيلان. يمكن الحصول على تلك المركّبات الكلورية من السيليكون بمعالجة السيليكون الخام ذي درجة النقاوة التعدينية بغاز كلوريد الهيدروجين عند درجات حرارة تتراوح بين 300–350 °س، داخل مفاعل فرشة مُمَيّعة:
تعدّ المركّبات الكلورية للسيليكون من المركّبات المتطايرة، بالتالي يمكن تنقيتها بتكرار عملية التقطير بالتجزئة؛ ثمّ بإجراء عملية تفكيك حراري لتلك المركّبات النقية عند درجات حرارة تتراوح بين 1000–1200 °س؛[58] أو بإجراء عملية اختزال حراري باستخدام بخار الزنك عالي النقاوة عند درجات حرارة قرابة 950 °س.[59]
يمكن إجراء عملية استحصال السيليكون دون الحاجة إلى استخدام المشتقّات الكلورية وذلك وفق عملية تفكك حراري لمركّب السيلان:[60]
سيليكون شبه الموصلات

ينبغي أن يكون السيليكون المستخدم في هندسة الإلكترونيات الدقيقة ذا نقاوة مرتفعة للغاية (درجة النقاوة الإلكترونية)؛ فعلى سبيل المثال تُسوِّق شركة شين-إتسو للكيماويات اليابانية لبلّورات مخلقة أحادية من السيليكون بنقاوة 99.999999999%.[61] للوصول إلى درجة النقاوة المرتفعة جدّاً هذه يُعالَج السيليكون الخامّ المتوفّر على شكل كتل إسفنجية من عمليات التحضير السابقة وفق أساليب خاصّة من أجل تشكيل بلّورات أحادية مفردة أسطوانية الشكل وفق عملية تشوخرالسكي؛ أو أن تخضع لعملية تنقية لاحقة وفق أسلوب الصهر النطاقي.
وفق عملية تشوخرالسكي يؤخَذ سيليكون الخلايا الشمسية ويُصهَر في بواتق من الكوارتز النقي؛ ثم توضَع نواة تبلور من بلّورة سيليكون مرتفع النقاوة في المصهور ثم تُدوّر وتُسحَب إلى الأعلى ببطء، وبذلك يتبلور السيليكون على هيئة بلّورة أحادية منفردة، وتبقى الشوائب في المصهور الموجود في البوتقة. يعتمد المبدأ الفيزيائي لعملية التنقية هذه على انخفاض نقطة التجمّد، وعلى ميل المواد للتبلور على شكل نقي. أمّا في أسلوب الصهر النطاقي فيُستخدَم التسخين بالحثّ الكهرومغناطيسي لتسخين السيليكون وصهره، ثمّ بتمرير بلورة مخلقة أحادية من السيليكون على تماس مباشر على سطح المصهور، ممّا يؤدّي إلى هجرة الشوائب إلى الطور السائل، ويبقى السيليكون بدرجة نقاوة مرتفعة. يُسوّق الشكل النهائي من السيليكون مرتفع النقاوة على شكل رقائق [ملاحظة 25].
يُستخدَم السيليكون بدرجة النقاوة الإلكترونية في صناعة المعالجات ووسائط تخزين البيانات والترانزستورات وغيرها. من أجل استخدامه في تلك التطبيقات الإلكترونية ينبغي أن يتمتّع السيليكون بخواص شبه موصلة، ولذلك فإنّه يُشاب بذرّات عناصر أخرى ملائمة مثل الإنديوم أو الإثمد أو الزرنيخ أو البورون أو الفوسفور؛ ممّا يؤدّي إلى نشوء ظاهرة وصلة الموجب والسالب، ممّا يؤدي بالتالي إلى إمكانية التحكّم الإلكتروني، وهذا ما يجعله ملائماً لتصنيع عناصر أشباه الموصلات. يمكن أن يُحوّل السيليكون اللابلوري بواسطة ليزر إكسيمر إلى سيليكون متعدّد التبلور، وذلك له أهمية في صناعة ترانزستور الغشاء الرقيق على سبيل المثال.
التحضير المخبري
يمكن الحصول على السيليكون مخبرياً من اختزال ثنائي أكسيد السيليكون أو رباعي فلوريد السيليكون باستخدام فلزّات المغنيسيوم أو الألومنيوم:
كما يمكن الحصول على السيليكون اللابلوري من السيليسيدات:
النظائر
يتكوّن السيليكون المتوفّر طبيعياً من 3 نظائر مستقرة ألا وهي سيليكون-28 28Si (وفرة طبيعية 92.23%)، وسيليكون-29 29Si (وفرة طبيعية 4.67%)، وسيليكون-30 30Si (وفرة طبيعية 3.10%).[62] ومن بين هذه النظائر، فإنّ السيليكون-29 29Si هو ما يستخدم في الرنين النووي المغناطيسي والرنين المغناطيسي الإلكتروني؛[63] لأنّه الوحيد الذي لديه مغزل نووي (I = 12).[54] تُنتَج هذه النظائر الثلاثة جميعها في المستعرات الأعظمية من النوع Ia؛[64][65] وذلك من خلال عملية احتراق الأكسجين؛ كما يُنتَج النظير 28Si في عملية ألفا، ولذلك فهو الأكثر وفرة. تُعرَف عملية اندماج نوى السيليكون-28 28Si مع جسيمات ألفا أثناء عمليات إعادة الترتيب المرافقة للانحلال الضوئي في النجوم باسم «عملية احتراق السيليكون»، وهي المرحلة الأخيرة في تفاعلات الانصهار النجمي قبل الانهيار السريع والانفجار السريع لتلك النجوم لتصبح مستعرات أعظمية من النوع 2.[66]
هناك عشرون نظيراً مشعّاً للسيليكون، وأكثرها استقراراً هو السيليكون-32 32Si، ويبلغ عمر النصف له 153 سنة؛ والسيليكون-31 31Si، والذي يبلغ عمر النصف له 157.3 دقيقة.[62] إنّ جميع النظائر المشعّة المتبقيّة لا يتجاوز لها عمر النصف السبع ثوان، ومعظم أعمار النصف تلك أقلّ من عُشر الثانية.[62] يوجد هناك مصاوغ نووي وحيد للسيليكون (34mSi)، ويبلغ عمر النصف له أقل من 210 نانوثانية.[62] يخضع النظير 32Si لاضمحلال بيتا ضعيف الشدّة إلى فوسفور-32 32P، ومنه إلى النظير المستقرّ كبريت-32 32S. يمكن أن ينتج النظير سيليكون-31 31Si من التنشيط النيوتروني للسيليكون الطبيعي، وهذا ما يجعله مفيداً في مجال التحليل الكمي، إذ يمكن الكشف عنه بسهولة من اضمحلال بيتّا النمطي إلى النظير فوسفور-31 31P، ويحمل الإلكترون المنبعث طاقة مقدارها 1.48 ميغا إلكترون فولت.[54] يتراوح متوسط عدد الكتلة لنظائر السيليكون بين 22 إلى 44؛[62] ونمط الاضمحلال المشترك للنظائر التي أعداد كتلتها أقلّ من السيليكون-28 هو نمط β+، مشكّلاً في المقام الأول نظائر الألومنيوم (13 بروتون) كنواتج اضمحلال.[62] أمّا نمط التحلّل الأكثر شيوعًا للنظائر التي أعداد كتلتها أكبر من السيليكون-30 فهو β−، وفيه تتشكّل في المقام الأول نظائر الفوسفور (15 بروتون) كنواتج اضمحلال.[62]
يمكن للسيليكون أن يصل إلى المحيطات عبر المياه الجوفية والنقل النهري. تتوفر الواردات الضخمة من المياه الجوفية على تركيب نظائري مميّز عن واردات النقل النهري؛ ويساهم ذلك التباين النظائري بين المياه الجوفية ومياه النقل البحري في حدوث اختلاف في قيم النظير سيليكون-30 30Si، وذلك يستخدم كمقياس للنشاط الجيولوجي في المحيطات.[67]
الخواص الفيزيائية

يوجد السيليكون في الشروط القياسية من الضغط ودرجة الحرارة على شكل صلب رمادي ذي بريق أزرق، وهو يُصنّف ضمن أشباه الفلزات. يظهر السيليكون خاصّية التمدّد الحراري السلبي مثل الماء، أي أن كثافته في الطور السائل أعلى بقرابة 10-11% من قيمتها في الطور الصلب.
البنية الذرية
لذرّة السيليكون أربعة عشر إلكتروناً؛ وهي تكون في الحالة القاعية ذات توزيع إلكتروني على الشكل Ne] 3s2 3p2]. إذاً توجد أربعة إلكترونات تكافؤ في الغلاف الإلكتروني الخارجي، بالتالي بإمكان ذرّة السيليكون أن تحقّق قاعدة الثمانيات وأن تتبنّى الترتيب الإلكتروني المستقرّ للآرغون بتشكيل أربع روابط تساهمية لتعطي مركّبات كيميائية على النمط SiX4، والتي يكون لها بنية جزيئية رباعية السطوح ذات تهجين مداري من النمط sp3، تحتلّ فيها ذرّة السيليكون المركز، والذرّات الأربع الأخرى على قمم رباعي السطوح.[68] تبلغ قيم أوّل أربع طاقات تأين للسيليكون 786.3 و 1576.5 و 3228.3 و 4354.4 كيلوجول/مول، على الترتيب. تعدّ تلك القيم مرتفعة بالشكل الكافي لاستثناء احتمالية أن تكون كيمياء هذا العنصر ذات سمة أيونية؛ إذ تهيمن عليها السمة التساهمية بالفعل. بالنظر إلى الاتجاهات الدورية فإنّ نصف قطر ذرّة السيليكون في روابطها التساهمية الأحادية (117.6 بيكومتر) يقع وسطاً بين تلك القيم الموافقة لذرّة الكربون (77.2 بيكومتر) ولذرّة الجرمانيوم (122.3 بيكومتر)؛ في حين أنّ القيمة الافتراضية لنصف القطر الأيوني لذرّة السيليكون قد تكون قرابة 40 بيكومتر.[69]

البنية البلورية
يتبلور السيليكون في الشروط القياسية على شكل بنية تساهمية ضخمة على هيئة شبكة بلّورية ثلاثية الأبعاد لها بنية الألماس المكعّبة، ممّا يفسّر الارتفاع النسبي لنقطة الانصهار (1414 °س)، إذ يتطلّب تكسير هذه الروابط التساهمية وتحطيمها الكثير من الطاقة. لا توجد متآصلات من السيليكون عند الضغوط العادية؛ إلّا أنّه يتبنّى أشكالاً بلّورية مختلفة عند ضغوط مرتفعة؛ إذ تؤدّي زيادة الضغط إلى زيادة العدد التناسقي، ممّا يولّد متآصلاً ذا تعبئة متراصّة عند قرابة 40 غيغاباسكال. يغلي السيليكون عند 3265 °س، ورغم الارتفاع النسبي لتلك القيمة فإنها تبقى أقلّ من قيمة نقطة تسامي مجانسه الكربون (3642 °س)؛ كما أنّ للسيليكون حرارة تبخّر أقلّ من الكربون، وذلك يتوافق مع حقيقة أنّ الرابطة Si–Si أضعف من الرابطة C–C.[70] بيّنت الأبحاث أنّه بالإمكان إنشاء بنية من رقائق السيليسين بشكل مشابه للغرافين.[71][72]
الخواص الإلكترونية
ينتمي السيليكون إلى أشباه الموصلات، وتنخفض المقاومية مع ارتفاع درجة الحرارة، ويعود ذلك بسبب وجود فجوة نطاق طاقية صغيرة (1.107 إلكترون فولت) بين أعلى المستويات الطاقية المشغولة بالإلكترونات (نطاق التكافؤ) وبين أخفض المستويات الطاقية غير المشغولة بالإلكترونات (نطاق التوصيل). يقع مستوى فيرمي للسيليكون في منتصف المسافة تقريباً بين نطاقي التكافؤ والتوصيل، بالتالي فإنّ السيليكون النقي هو من المواد العازلة عند درجة حرارة الغرفة. بالمقابل، تؤدّي إشابة السيليكون بعنصر من مجموعة النتروجين (نكتوجين) مثل الفوسفور أو الزرنيخ أو الإثمد إلى توفير إلكترون فائض لكلّ ذرّة شائبة، ممّا يسهّل إثارة الإلكترونات إلى نطاق التوصيل إمّا بأسلوب حراري أو ضوئي، وذلك يولّد شبه موصل من النوع N. بشكل مشابه، فإنّ إشابة السيليكون بعنصر من مجموعة البورون مثل البورون أو الألومنيوم أو الغاليوم تؤدّي إلى توفير مستويات مستقبلة قادرة على التقاط واحتجاز الإلكترونات التي يمكن أن تثار من نطاق التوصيل الممتلئ، ممّا يولّد شبه موصل من النوع p.[ar 3][70] يؤدّي وصل سيليكون من النوع N مع سيليكون من النوع p إلى تشكيل وصلة الموجب والسالب، والتي تقوم بعمل ثنائي المساري، والذي ينظّم تدفّق الإلكترونات باتجاه واحد.[70]
الخواص الكيميائية
| X = | C | Si | H | F | Cl | Br | I | O– | N< |
|---|---|---|---|---|---|---|---|---|---|
| C–X | 368 | 360 | 435 | 453 | 351 | 293 | 216 | ~360 | ~305 |
| Si–X | 360 | 340 | 393 | 565 | 381 | 310 | 234 | 452 | 322 |
إنّ كتل السيليكون البلّوري عادةَ ما تكون خاملة، ولكنّها تصبح ذات نشاط كيميائي أكبر مع ارتفاع درجة الحرارة. وكما هو الحال مع جاره الألومنيوم فإنّ السيليكون يشكّل طبقة رقيقة سطحية من ثنائي أكسيد السيليكون SiO2 والتي تقيه من الأكسدة وتقوم بدور مخمّل. لذلك فإنّ السيليكون لا يتفاعل بشكل ملموس مع أكسجين الهواء عند درجات حرارة دون 900 °س، ولكن عند درجات حرارة أعلى من ذلك يزداد تشكّل طبقة برّاقة من ثنائي الأكسيد بشكل سريع بين درجتي 950 °س و 1160 °س؛ وعند الوصول إلى درجة الحرارة 1400 °س يمكن للنتروجين أن يتفاعل مع السيليكون ليشكّل مجموعة من النتريدات مثل SiN و Si3N4. يمكن للسيليكون أن يتفاعل مع بخار الكبريت عند الدرجة 600 °س، وبخار الفوسفور عند الدرجة 1000 °س. بالرغم من ذلك لا تستطيع طبقة الأكسيد تلك أن تمنع التفاعل مع الهالوجينات، فالفلور يهاجم السيليكون بعنف عند درجة حرارة الغرفة، أمّا الكلور فيقوم بذلك عند الدرجة 300 °س، في حين أنّ البروم واليود يهاجمان السيليكون عند الدرجة 500 °س. لا يتفاعل السيليكون مع أغلب الأحماض الممدّدة، ولكنه يتأكسد ويتعقّد مع مزائج حمض الهيدروفلوريك الحاوية على الكلور أو حمض النتريك ليشكّل الفلوروسيليكات الموافقة. من جهةٍ أخرى فإنّ السيليكون ينحلّ في محاليل القلويات الساخنة ليشكّل السيليكات الموافقة.[74] عند درجات حرارة مرتفعة يتفاعل السيليكون مع هاليدات الألكيل باستخدام النحاس حفّازاً من أجل الحصول على كلوريدات السيليكون العضوية، والتي تعدّ مواداً أوّلية لتحضير البوليميرات السيليكونية. عند انصهاره يصبح السيليكون ذا نشاط كيميائي وتفاعلية كبيرة للغاية، وهو يشكّل سبائك مع أغلب الفلزّات ليشكّل السيليسيدات الموافقة؛ كما أنّه قادر بتلك الحالة المنصهرة على أن يختزل أغلب أكاسيد الفلزّات، لأنّ الحرارة القياسية لتكوين ثنائي أكسيد السيليكون كبيرة. ولذلك الأمر فإنّ الحاويات المخصّصة لمصهور السيليكون ينبغي أن تكون مصنوعة من مواد حرارية خاملة مثل ثنائي اكسيد الزركونيوم، أو البوريدات اللافلزّية.[75]
يعدّ التناسق رباعي السطوح الطابع البنائي الرئيسي في كيمياء السيليكون، كما هو الحال في كيمياء الكربون. ولكنّ المدارات 3p هي أكثر انتشاراً من مدارات 2p، بالتالي فهي لا تتهجّن بشكل مثالي مع مدارات 3s؛ بالتالي فإن كيمياء السيليكون ومجانساته الأثقل في المجموعة الرابعة عشرة تظهر اختلافاً واضحاً عن كيمياء الكربون.[76] فعلى سبيل المثال، تبلغ قيمة كهرسلبية السيليكون مقدار 1.90، وهي أقلّ بكثير من الكربون (2.55)، لأنّ إلكترونات التكافؤ في السيليكون هي أبعد عن النواة من تلك التي للكربون، وبالتالي تكون قوى التجاذب الكهربائية الساكنة مع النواة أضعف. يؤدّي التطابق الضعيف لمدارات 3p إلى ميل أقلّ للسيليكون كي يشكّل سلاسل طويلة من روابط Si–Si بالمقارنة مع الكربون، وذلك يعكس حقيقة كون الرابطة Si–Si أضعف من نظيرتها C–C.[77] إذ أنّ متوسّط طاقة رابطة Si–Si يبلغ تقريباً 226 كيلوجول/مول، بالمقارنة مع 356 كيلوجول/مول بالنسبة للرابطة C–C.[78] وذلك يؤدّي أيضاً إلى ضعف ميل السيليكون إلى تشكيل روابط مضاعفة بين ذرّاته. بالتالي فهناك تباين واضح بين كيمياء السيليكون والكربون، وخاصّةً في مجال الكيمياء العضوية للكربون؛ كما أنّ معادن السيليكات ذات بنية معقّدة لا تُرى في أكاسيد الكربون.[9]
من جهةٍ أخرى، يؤدّي وجود عقد قطرية في مدارات 3p عند السيليكون إلى زيادة احتمالية فرط التكافؤ، وذلك يشاهد في مشتقّات السيليكون خماسية وسداسية التناسق، وذلك في الأنيونين -SiX5 و 2-SiF6، على الترتيب.[79][77] يؤدّي ازدياد الفجوة الطاقية بين المدارات s والمدارات p نزولاً في مجموعة الكربون، فإنّ ثباتية واستقرار الحالة ثنائية التكافؤ تزداد أيضاً، وذلك من الكربون إلى الرصاص، كما تزداد الصفة الفلزّية للعناصر.[9] بناءً على ذلك، فإنّه لا يوجد للسيليكون إلّا البعض القليل من المركّبات ثنائية التكافؤ، وهي غير مستقرّة؛ كما أنّ السيليكون يبدي بعض السمات الفلزّية الأوّلية، وخاصّةً في سلوك مركّباته الأكسجينية، وكذلك في تفاعله مع الأحماض والقواعد (رغم صعوبتها)؛ بالتالي فإنه يصنّف ضمن أشباه الفلزّات أكثر من كونه لا فلزّاً.[77] يشبه السيليكون الجرمانيوم في سلوكه أكثر من الكربون، ويتعزّز هذا التشابه بانكماش المدارات d في الجرمانيوم، ممّا يؤدّي إلى تقارب في حجم الذرة فيه بالنسبة للسيليكون، وذلك بشكل أكبر ممّا يوحيه الاتجاه الدوري.[69]، ولكن بالرغم من ذلك توجد اختلافات جوهرية بين هذين العنصرين، بسبب استقرار التكافؤ الثنائي في الجرمانيوم، وذلك لسمته الفلزّية الأوضح؛ بالإضافة إلى ذلك فإنّ ضعف الرابطة Ge–O بالمقارنة مع Si–O يؤدّي إلى غياب السلاسل البوليميرية عند الجرمانيوم كما هو الحال في البوليميرات السيليكونية.[78]
المركبات الكيميائية
يشكل السيليكون عدداً معتبراً من المركّبات الكيميائية، والتي يكون فيها السيليكون رباعي التكافؤ بشكل شبه سائد. يغلب على كيمياء السيليكون الارتباط الوثيق مع ذرّة الأكسجين، فمركّباته الأكسجينية هي الأكثر انتشاراً.
السيليسيدات
هناك عددٌ كبير من سيليسيدات الفلزّات المعروفة، والتي يطغى عليها سمة عدم وجود تركيب كيميائي بسيط استناداً على التكافؤ وعلى قياس اتحادية العناصر وكذلك على نوع الرابطة الكيميائية. فهناك عددٌ من الصيغ المختلفة التي توجد عليها السيليسيدات مثل M6Si و M5Si و M4Si و M15Si4 و M3Si و M5Si2 و M2Si و M5Si3 و M3Si2 و MSi, M2Si3 و MSi2 و MSi3 و MSi6. تكون السيليسيدات في بنيتها أقرب للبوريدات من الكربيدات، وذلك مثال على العلاقة القطرية بين الكربون والبورون. تكون الحرارة القياسية للتكوين في السيليسيدات مقاربة للبوريدات والكربيدات الموافقة، ولكنها تنصهر عادةً عند درجات حرارة أخفض.[80]
عادةً ما تُحضَّر السيليسيدات من التفاعل المباشر بين العناصر المكوّنة، فعلى سبيل المثال تتفاعل عناصر الفلزّات القلوية والفلزّات القلوية الترابية مع السيليكون أو ثنائي أكسيد السيليكون لتعطي السيليسيدات الموافقة عند درجات حرارة مرتفعة؛ ويغلب عليها الصفة التساهمية، إذ أنّه من الصعب عزل أنيونات للسيليكون مع تلك العناصر مرتفعة الكهرجابية، ويكون الارتباط على شكل أنيونات 4-Si4 والمتساوية إلكترونياً مع الفوسفور الأبيض P4.[80][81]
السيلانات
السيلانات هي سلسلة متجانسة من المركّبات الكيميائية المكوّنة من السيليكون والهيدروجين، ولها الصيغة العامة SinH2n + 2، ويعرف منها سلاسل متفرّعة وغير متفرّعة حتى قيمة تصل من n=8؛ كما أن المركّبات الحلقية على الشكل Si5H10 و Si6H12 معروفة أيضاً. أشهر تلك المركّبات هي أحادي السيلان SiH4 وثنائي السيلان Si2H6، واللذان يوجدان في الطور الغازي، أمّا ثلاثي السيلان Si3H8 والسيلانات العليا فهي توجد في الطور السائل في الشروط القياسية.
كان ألفرد شتوك من الرائدين في دراسة هذه المركّبات؛[20][82][83] وهي يمكن أن تُحضَّر انطلاقاً من سيليسيد المغنيسيوم، كما يمكن أن تُحضَّر من اختزال السيلانات المستبدلة باستخدام مختزل قويّ مثل هيدريد ألومنيوم الليثيوم في وسط من الإيثر عند درجات حرارة منخفضة. يمكن الحصول على السيلانات المستبدلة من تفاعل الأحماض الهالوجينية مع السيليكون بوجود حفّاز من النحاس.[20] عند وجود مستبدلات عضوية مناسبة يمكن للسيلانات أن تعطي بولي سيلانات مستقرّة.[84]
ثنائي أكسيد السيليكون
توجد تحويرات متنوّعة من ثنائي أكسيد السيليكون، الذي يعرف بالاسم الشائع «السيليكا»، في الطبيعة، وهو يدخل في تركيب العديد من المعادن والصخور. تكون أغلب الأشكال البلورية للسيليكا مرتّبة على هيئة رباعيات سطوح متّصلة مع بعضها على شكل سلاسل طويلة جدّاً من {SiO4} تتّصل مع بعضها برؤوسها. وفق هذا الترتيب تحتلّ ذرّة السيليكون المركز، وعلى الرؤوس تتوضّع ذرّات الأكسجين، حيث تتّصل كلّ ذرّة أكسجين بذرّتي سيليكون. يعدّ النمط البلّوري من الشكل ألفا-كوارتز [ملاحظة 26]، من الأنماط المستقرّة ديناميكياً حرارياً عند درجة حرارة الغرفة، وتكون رباعيات السطوح فيها متّصلة ببعضها على شكل سلاسل حلزونية متداخلة، مع وجود طولان مختلفان للرابطة Si–O هما 159.7 و 161.7 بيكومتر؛ أمّا زاوية الرابطة Si–O–Si فتبلغ 144°. يمكن أن تكون جهة الدوران في تلك الترتيبات الحلزونية إمّا يمينية أو يسارية، ولذلك فإنّ بلّورات ألفا-كوارتز ذات فعالية ضوئية. عند الدرجة 537 °س يتغيّر الترتيب بسرعة وبشكل عكوس إلى النمط بيتا-كوارتز [ملاحظة 27] المشابه، والذي تختلف فيه مقدار الزاوية Si–O–Si لتصبح 155°، مع الاحتفاظ بالقساوة. يؤدّي التسخين إلى 867 °س إلى تحوّل طوري آخر إلى بيتا-تريديميت [ملاحظة 28]، والذي تتكسر فيه بعض روابط Si–O ممّا يسمح لرباعيات السطوح {SiO4} أن تشكّل بنية مفتوحة وأقل تراصّاً. يعدّ هذا التحوّل بطيئاً، وعندما يُترَك ليبرد إلى قرابة 120 °س، فإنّه يتحوّل بسرعة وبشكل عكوس إلى بنية ألفا-تريديميت [ملاحظة 29]، الشبيهة ببنية الكوارتز. يتحوّل البيتا-تريديميت إلى الشكل المكعّب من بيتا-كريستوباليت [ملاحظة 30] عند قرابة 1470 °س، والتي توجد بشكل شبه مستقرّ تحت درجة حرارة التحوّل الطوري، وتتحوّل عند التبريد ما بين 200–280 °س إلى النمط ألفا-كريستوباليت [ملاحظة 31] عند حدوث انزياحات صغيرة للذرّات. ينصهر البيتا-كريستوباليت عند الدرجة 1713 °س، ويؤدّي التبريد حينها إلى حدوث تزجيج للسيليكا. تبقى رباعيات السطوح {SiO4} في السيليكا المزجّجة متّصلة مع بعضها برؤوسها، ولكن مع ضياع تناظر ودورية الترتيب البلّوري. بسبب التحوّل البطيء بين هذه الأنماط المذكورة، فإنّه من الممكن للتسخين السريع أن يصهر ألفا-الكوارتز (1550 °س) أو البيتا-تريديميت (1703 °س)؛ من جهةٍ أخرى تغلي السيليكا عند قرابة الدرجة 2800 °س.[52]
إنّ ثنائي أكسيد السيليكون شبه خاملة كيميائياً، وهو لا يهاجَم من أيّ حمض ما عدا حمض الهيدروفلوريك؛ ولكنّه بالمقابل ينحلّ ببطء في المحاليل القلوية المركّزة، ولكن عملية الانحلال في مصهور الهيدروكسيدات أو الكربونات القلوية تكون أسرع، ممّا يشكّل سيليكات الفلزّات الموافقة. يعدّ الفلور الوحيد من بين العناصر القادر على مهاجمة السيليكا عند درجة حرارة الغرفة ليشكّل رباعي فلوريد السيليكون، يستطيع الهيدروجين والكربون التفاعل مع السيليكا، ولكن عند درجات حرارة تتجاوز 1000 °س.[52]
الأحماض السيليسية
تؤدّي إضافة الماء إلى السيليكا إلى انخفاض نقطة انصهارها بقرابة 800 °س، وذلك بسبب حدوث خلخلة جزئية في البنية، فتحلّ روابط Si–OH مكان Si–O–Si في البنية. يؤدّي زيادة تركيز الماء إلى تشكيل هلام السيليكا (السيليكا جل) [ملاحظة 32]، بالإضافة إلى مستعلقات غروانية مميّهة أخرى للسيليكا. إذ توجد العديد من الهيدرات التي تتشكّل في المحاليل الممدّدة، والتي سرعان ما تترسّب وتتكثّف وتتشابك لتعطي العديد من الأحماض السيليسية المبلمرة، فتكون الصيغة العامّة لوحدة التكرار على الشكل [SiOx(OH)4−2x]، وهذا السلوك مشابه لما لعناصر البورون والألومنيوم على سبيل المثال. بالتالي، فعلى الرغم من التمكّن من تحديد بنية بعض الأحماض السيليسية في المحاليل الممدّدة، مثل حمض أورثو السيليسيكSi(OH)4 وحمض ميتا السيليسيك SiO(OH)2، فإنّه لم يتمكّن من عزلها في الحالة الصلبة.[52]
مركبات لاعضوية أخرى
يتشكّل ثنائي كبريتيد السيليكون من حرق السيليكون في الكبريت الغازي عند الدرجة 100 °س؛ ويؤدي تسامي المركّب الناتج SiS2 في وسط من النتروجين إلى الحصول على ألياف طويلة بيضاء ومرنة شبيهة بشكلها بالأسبست، وببنيتها بالسيليكا-W، ولكن يفتقد SiS2 التنوّع في البنى الذي يمتلكه SiO2، وهو يتحلمه إلى السيليكا وكبريتيد الهيدروجين. كما يتفاعل بسهولة مع الأمونيا السائلة ليشكّل مركّب إيميدي NH4SH.[85]
وهو يتفاعل مع كبريتيدات الصوديوم والمغنيسيوم والألومنيوم والحديد ليشكّل مركّبات الثيوسيليكات [ملاحظة 33] الموافقة؛ في حين يعطي التفاعل مع الإيثانول إلى الحصول على رباعي إيثيل أورثو السيليكات وكبريتيد الهيدروجين. يؤدّي تفاعل كبريتيد الهيدروجين مع رباعي هاليدات السيليكون إلى الحصول على ثيوهاليدات [ملاحظة 34] السيليكون المختلفة.[85] يمكن الحصول على نتريد السيليكون Si3N4 من التفاعل المباشر بين السيليكون والنتروجين فوق الدرجة 1300 °س، ولكن يمكن الحصول على هذا المركّب بأسلوب أفضل من تسخين السيليكا مع الفحم في جوّ من غازي النتروجين والهيدروجين عند الدرجة 1500 °س. يعدّ مركّب نتريد السيليكون من المواد السيراميكية وهي مادّة خاملة كيميائياً وحرارياً، كما أنّها كثيفة وذات صلادة مرتفعة (9 على مقياس موس). من المواد الحرارية المشابهة مركّب Si2N2O، والذي يتشكّل من تسخين السيليكون والسيليكا عند الدرجة 1450 °س في جوّ من الآرغون حاوٍ على 5% من النتروجين. تتكوّن البنية من تناوب ذرّات السيليكون رباعي التناسق مع النتروجين ثلاثي التناسق في شبكة سداسية متراصّة ومتشابكة مع بعضها البعض بروابط Si–O–Si غير خطّية.[85]
يعطي تفاعل هاليدات السيليل مع الأمونيا أو مشتقّات ألكيل الأمونيا في الطور الغازي أو في وسط من محلول إيثانولي نواتج مختلفة من مركّبات سيليلاميد [ملاحظة 35] المتطايرة، وهي مجانسات سيليكونية للأمينات.[85]

جرى تحضير العديد من تلك المركّبات، ولكن الأنواع الكيميائية الحاوية على الرابطة SiH–NH غير مستقرّة عند درجة حرارة الغرفة. كما جرى تحضير مناظرات سيليكونية للإيمينات حاوية على الرابطة المزدوجة Si=N، ولكنّها غير مستقرّة أيضاً.[85]
حُضّر مركّب كربيد السيليكون SiC لأوّل مرة سنة 1891 من الكيميائي إدوارد غودريتش أتشيسون، الذي أطلق عليه اسم كربوروندوم [ملاحظة 36]، وأسّس شركة لإنتاجه.[86] يوجد من كربيد السيليكون أكثر من 250 شكل بلّوري.[87] ما يميّز تعدّد الأشكال في كربيد السيليكون هو وجود عائلة كبيرة من البنى البلّورية المتشابهة، والتي تكون فيها التحويرات بسيطة، فيكون التشابه على بُعدَين اثنين ويختلف في البعد الثالث. بالتالي يمكن النظر إليها على أنها طبقات مكدّسة في تتابع معيّن.[88] يعدّ كربيد السيليكون أكثر مركّب ثنائي للسيليكون ثابت حرارياً، وهو يبدي مظاهر التفكّك بفقدان السيليكون عند درجات حرارة قرابة 2700 °س. إلّا أنّ ثباتيته الكيميائية أقلّ من الحرارية وخاصّةً عند درجات الحرارية المرتفعة، إذ يؤدّي إزالة طبقة ثنائي أكسيد السيليكون الواقية عليه بالتفاعل مع مصهور الهيدروكسيدات أو الكربونات إلى أكسدته تلقائياً؛ كما أنه يُهاجَم من غاز الكلور عند الدرجة 1000 °س ليشكّل الكلوريدات الموافقة.[89]
مركبات السيليكون العضوية

بسبب التقارب في قوة الرابطة الكيميائية بين Si–C و C–C، فإن مركّبات السيليكون العضوية غالباً ما تكون مستقرّة كيميائياً وحرارياً. فعلى سبيل المثال يمكن أن يُقطّر مركّب SiPh4 (رباعي فينيل السيلان} [ملاحظة 37]) في الهواء حتى بالقرب من نقطة غليانه (428 °س)، وكذلك الأمر مع مشتقّاته Ph3SiCl و Ph2SiCl2، التي تغلي عند 378 °س و305 °س، على الترتيب. وبشكل أبعد من ذلك، هناك تشابه إلى حدّ ما بين كيمياء الكربون العضوية وكيمياء السيليكون تبعاً للقدرة على تشكيل سلاسل طويلة وروابط مضاعفة.[89] ولكن من جهة أخرى هناك اختلافات بسبب كهرجابية السيليكون بالمقارنة مع الكربون، فالرابطة Si–F أقوى من نظيرتها C–F، في حين أن الرابطة C–H أقوى بكثير من Si–H؛ كما أن ارتفاع كهرجابية السيليكون يجعل من قطبية الرابطة Si–H معكوسة بالنسبة للرابطة C–H، فالفرق في الكهرسلبية في الأخيرة هي +0.45 (هيدروجين-كربون)، في حين يبلغ الفرق في Si–H مقدار −0.2 (هيدروجين-سيليكون).بالإضافة إلى ذلك فإنّ السيليكون قادر على التوسّع في ثمانيته الإلكترونية أثناء تشكيل الروابط بشكل لا يوجد في الكربون، وبالتالي هناك بعض التفاعلات السيليكونية العضوية التي لا يوجد مناظر في كيمياء الكربون العضوية.[90]

يمكن الحصول على مركّبات السيليكون العضوية مخبرياً بإجراء تفاعل إضافة سيليل (سيللة [ملاحظة 38]) للمركّبات العضوية من تفاعل كلوريد ثلاثي ميثيل السيليل أو رباعي كلوريد السيليكون مع مركب ليثيوم عضوي أو كاشف غرينيار (مركّب مغنيسيوم عضوي) أو مركّب ألومنيوم عضوي. كما تُحضّر تلك المركّبات مخبرياً من تفاعل إضافة سيليل هيدروجينية [ملاحظة 39]، والذي يتضمّن إضافة الرابطة Si–H إلى رابطة C=C المضاعفة. أمّا صناعياً فيُستحصَل على مركّبات السيليكون العضوية من التفاعل المباشر بين هاليدات الألكيل أو الأريل مع السيليكون بوجود فلز النحاس حفّازاً للعملية.[89] من الأمثلة على المجموعات العضوية السيليكونية واسعة الاستخدام مجموعة ثلاثي ميثيل السيليل، والتي تستخدم مجموعة حماية في التفاعلات العضوية. هناك العديد من المشتقّات الكلوريدية الحاوية على ميثيل السيلان، مثل ميثيل ثلاثي كلورو السيلان أو ثنائي ميثيل ثنائي كلورو السيلان أو كلورو ثنائي ميثيل السيلان. من مجموعات السيليكون العضوية أيضاً كلّ من سيليل الإيثر والسيلوكسان والتريفلات. أمّا من المركّبات المعروفة رباعي ميثيل السيلان، والذي يستخدم مادّة مقياسية من أجل تعيير الانزياح الكيميائي في مطيافية الرنين المغناطيسي النووي. كما يعدّ مركّب تريفلات ثلاثي ميثيل السيليل من أحماض لويس القويّة جدّاً، ويستخدم من أجل تحويل مركّبات الكربونيل إلى أسيتال وإيثر سيليلي إينولي، واللذان يتفاعلان مع بعضهما بشكلٍ مناظر للتفاعل الألدولي.[90]
الدور الحيوي

على الرغم من توفّر السيليكات بشكلٍ كبير في القشرة الأرضية، إلّا أنّ هناك عددٌ قليلٌ نسبياً من الكائنات الحيّة القادرة على استخدامه والاستفادة منه حيوياً. من بين هذه الاستثناءات تندرج كلّ من كائنات الدياتوم [ملاحظة 40] والشعوعيات [ملاحظة 41] وكذلك نوع خاصّ من الإسفنجيات السيليسية [ملاحظة 42] والتي تستخدم «السيليكا ذات الأصل الحيوي» [ملاحظة 43] كدعامات بنيوية لهياكلها. وُجدَ أيضاً أنّ إضافة الأورثوسيليكات إلى علف العجول يزيد من نسبة الكولاجين في جلدها وغضاريفها.[91]
عند النباتات
في خلايا النباتات الأكثر تقدّماً فتوجد جسيمات سيليكا النبات [ملاحظة 44]، وهي جسيمات مجهرية صلبة، والتي تكون ضرورية للنمو في بعض النباتات مثل الأرز.[92][93][94] كما وجد أنّ السيليكون يحسّن من متانة الجدار الخلوي ومن الخواص الدعامية الهيكلية في بعض النباتات الأخرى.[95] تدرس الجمعية الأمريكية لموظفي مراقبة غذاء النبات [ملاحظة 45] إدراج السيليكون ضمن المواد المفيدة للنباتات.[96][97]
عند الكائنات البحرية
تستخدم كائنات الدياتوم السيليكونَ ذا الأصل الحيوي؛[98] والذي يُمتصّ بواسطة «بروتين نقل السيليكون» [ملاحظة 46] من أجل استخدامه بشكل أساسي في دعم هياكل الجدار الخلوي على هيئة محارات دياتومية. يدخل السيليكون إلى المحيطات بشكل منحلّ على هيئة حمض السيليسيك أو سيليكات.[99] تعدّ الدياتومات من المستهلكين الرئيسيّين لهذا النوع من السيليكون، وتساهم بشكل كبير في التأثير على تركيز السيليكون في المحيطات، ويعدّ السيليكون بذلك شكلاً من أشكال المغذّيات، فيزيد بذلك أعداد الكائنات الدياتومية في المستويات العليا الضحلة،[99] وذلك يؤثّر بالنهاية على تركيز السيليكون في المستويات الأعمق في المحيطات.[100] تدعى ظاهرة حركة السيليكون بين المستويات متفاوتة العمق في المحيطات باسم «الثلج البحري» [ملاحظة 47]؛ وهي تتضمّن الانتقال السفلي للدقائق المعلقة من المواد العضوية مع مزيج المواد العضوية المنحلّة.[101] بالتالي فإنّ هذه الظاهرة تؤثّر في النهاية على تركيز المغذّيات في المستويات العميقة في المحيطات.[102]
تعدّ الكائنات الدياتومية من العوالق النباتية في المناطق الساحلية، وهي تساهم في إنتاج السيليكون ذي الأصل الحيوي؛ أمّا في المحيطات المفتوحة، فإنّ للدياتومات دورٌ أقلّ في إنتاج السيليكا. من جهةٍ أخرى، تساهم الدياتومات في الدوّامات المحيطية في شمالي المحيطين الأطلسي والهادي بنسبة 5-7% من الإنتاج السنوي العالمي للسيليكا؛ أمّا الأقسام الجنوبية من المحيطات فهي تعطي قرابة ثلث الإنتاج السنوي العالمي من السيليكا ذات الأصل الحيوي؛[50] وذلك التباين يظهر الانقسام في الحركة الجيوكيميائية الحيوية بين القسمين الشمالي والجنوبي لتلك المحيطات.[103]
عند البشر
هناك بعض الدلائل التي تشير إلى أنّ السيليكون قد يكون ضرورياً لصحّة الأظافر والشعر والعظام وأنسجة الجلد عند الإنسان؛[ar 4][104] فعلى سبيل المثال، فقد أظهرت بعض الدراسات أنّ النساء في مرحلة ما قبل انقطاع الطمث اللواتي لديهنّ حمية غذائية مرتفعة المحتوى من السيليكون يكون لديهنّ كثافة عظام أكبر، وأن المكمّلات الغذائية الحاوية على السيليكون يمكن أن تزيد من حجم العظام وكثافتها في المرضى الذين يعانون من هشاشة العظام.[105] يُحتاج إلى السيليكون من أجل اصطناع الإيلاستين والكولاجين، واللذان يدخلان في تركيب الشريان الأبهر في جسم الإنسان؛[106] ولذلك يصنّف السيليكون من البعض على أنّه من العناصر المغذّية.[5] بالرغم من ذلك، فإنّه من الصعب البرهان على اضطرار جسم الإنسان له، بسبب أنّ السيليكون متوفّر جدّاً، ومن الصعب لذلك فحص الأعراض الناجمة عن نقص وعوز هذا العنصر.[107]
الاستخدامات
إنّ الاستخدام الأكبر والأهمّ للسيليكون النقيّ هو دخوله في صناعة أشباه الموصلات وعناصرها ومكوّناتها المختلفة. أمّا أغلب السيليكون المستخدَم صناعياً فهو إمّا على شكل غير نقي أو على شكل مركّباته الكيميائية واسعة الانتشار مثل السيليكات أو السيليكا، والتي تجد تطبيقات مباشرة لها، خاصّةً في مجال مواد البناء والإنشاءات المختلفة، مثل الأسمنت البورتلاندي والملاط والخزف والزخارف الجصية وزجاج الصودا والجير، وكذلك الخرسانة والطوب الحراري؛ بالإضافة إلى الألياف الزجاجية والصوف الزجاجي.[108]
الصناعات الإلكترونية


تتطلّب الصناعات الإلكترونية أن يكون السيليكون ذا نقاوة مرتقعة جدّاً، وأن يكون السيليكون على هيئة بلّورة أحادية مفردة، والنقطة الأخيرة يمكن تحقيقها بواسطة عملية تشوخرالسكي، والتي يمكن من خلالها الحصول على رقائق سيليكون، والتي تستهلك في صناعة أشباه الموصلات وفي الصناعات الإلكترونية، وكذلك في تطبيقات الألواح الضوئية المختلفة.[109] يتّسم السيليكون النقي بأنّه شبه موصل ذاتي، ممّا يعني أنه وعلى العكس من الفلزّات قادر على نقل التيّار بواسطة الثغرات الإلكترونية والإلكترونات المتحرّرة من الذرّات بواسطة الحرارة، لذلك تزداد موصليته الكهربائية بازدياد درجة الحرارة. كما أنّ للسيليكون النقي من جهةٍ أخرى مقاومية كهربائية مرتفعة كي يستخدم مكوّناً في الدارات الكهربائية، لذلك فإنّه عادةً ما يشاب بتراكيز صغيرة من عناصر كيميائية معيّنة، ممّا يزيد من الموصلية الكهربائية، وتسهّل من التحكّم بعدد ونوع حاملات الشحنة الكهربائية. يعدّ هذا التحكّم ضرورياً في صناعة الترانزستورات والخلايا الشمسية ومكاشيف وعناصر أشباه الموصلات المستخدمة في الصناعات الإلكترونية.[110] يستفاد أيضاً من الخواص البصرية للسيليكون النقيّ في مجال أبحاث الليزر.[111]
تُستخدَم رقاقات من بلّورات السيليكون الأحادية في الدارات المتكاملة الشائعة، والتي تكون معزولة عن بعضها البعض بسبب وجود طبقة رقيقة عازلة من ثنائي أكسيد السيليكون، والتي تضاف إمّا بأسلوب الأكسدة الحرارية، أو بالأكسدة الموضعية للسيليكون [ملاحظة 48]. ما يجعل السيليكون ملائماً للصناعات الإلكترونية هو مقاومته لدرجات الحرارة المرتفعة، والفعالية الكهربائية الكبيرة من دون حدوث انهيار انهماري، وهو انهيار إلكتروني يحدث بسبب ارتفاع الحرارة، التي تسبب ازدياد عدد الإلكترونات والثغرات الإلكترونية، ممّا يؤدّي إلى ازدياد كمّيّة التيّار، ممّا يزيد من الحرارة، وهكذا دواليك. بالإضافة إلى ذلك، فإنّ طبقة الأكسيد العازلة تلك هي غير منحلّة في الماء، ممّا يمنح السيليكون أفضلية على الجرمانيوم في صناعة الإلكترونيات.[112][ar 5]
إنّ عملية تصنيع بلّورات السيليكون الأحادية مرتفعة الثمن، وهي غالباً ما تستخدم من أجل إنتاج الدارات المتكاملة؛ أمّا من أجل التطبيقات الإلكترونية الأخرى التي لا تتطلّب أن يكون السيليكون ذا نقاوة مرتفعة جدّاً فيمكن استخدام أنواع أخرى من السيليكون النقي، والتي تتضمّن نوعًا من أنواع السيليكون اللابلوري المهدرج [ملاحظة 49]، وكذلك السيليكون ذو النقاوة التعدينية المحسنة [ملاحظة 50]، وذلك في مجال تصنيع بكرة-إلى-بكرة [ملاحظة 51] المستخدم للتطبيقات منخفضة التكلفة مثل صناعة شاشات العرض البلّوري السائل والخلايا الشمسية. يزداد نموّ سوق السيليكون منخفض النقاوة بشكل أكبر من بلّورات السيليكون الأحادية مرتفعة النقاوة، فوفق إحصاءات سنة 2013، كان من المتوقّع أن يصل إنتاج السيليكون متعدّد التبلور المستخدم في صناعة الخلايا الشمسية إلى قرابة 200 ألف طنّ سنوياً، في حين أنّ بلّورات السيليكون الأحادية كان من المتوقع لها أن تصل إلى أقلّ من 50 ألف طنّ سنوياً.[113]
النقاط الكمومية
يستحصل على النقاط الكمومية من السيليكون من خلال عملية المعالجة الحرارية لمركّب هيدروجين سيلسيسكيوكسان [ملاحظة 52] ممّا يحولّه إلى بلّورات نانوية يتراوح أبعادها من عدة نانومترات إلى عدّة ميكرونات، وهي تبدي خواصاً ضيائية معتمدة على حجم الجسيمات.[114][115] تظهر البلورات النانوية انزياحات ستوكس كبيرة، محوّلةً الفوتونات في مجال فوق البنفسجي إلى فوتونات في المجال المرئي أو تحت الأحمر ممّا يمكّن من استخدامها في أجهزة عرض النقط الكمومية والمركّزات الشمسية الضيائية. ما يجعل السيليكون مفضّلاً على الكادميوم أو الإنديوم في مجال النقط الكمومية هو عدم سمّيّته ولطبيعته اللافلزية.[116][117][118] تُستخدَم النقط الكمومية من السيليكون أيضاً في مجال التحسّس للمواد الكيميائية الخطرة؛ إذ تتحسّس النقط الكمومية عبر حدوث استخماد لتألّقها عند وجود تلك المواد.[119][120] يحدث الكشف بعدّة أساليب مثل انتقالات الإلكترون البينية وانتقال الطاقة برنين فورستر والتيّارات الضوئية.[121][122]
السبائك
يُضاف السيليكون على هيئة فروسيليكون إلى مصهور الحديد الصبّ؛ ويستهلك هذا التطبيق قرابة 80% من الإنتاج العالمي للسيليكون. يساعد السيليكون على تحسين الأداء في صبّ المقاطع الرقيقة، ويعمل على منع تشكّل السمنتيت؛ كما يعمل على التقاط الأكسجين مما يُسهل التحكّمبالمحتوى الكربوني؛ كما يعدّ مكوّناً أساسياً في الفولاذ الكهربائي محسّناً من خواصه المقاومية والمغناطيسية الحديدية. يضاف السيليكون ذو النقاوة التعدينية من أجل تحضير سبائك مع عناصر أخرى مثل الألومنيوم في سبيكة سيلومين، المستخدمة بشكل واسع في صناعة المركبات، وذلك نظراً لخواصّها الميكانيكية المميّزة.[113][123]
البوليميرات السيليكونية
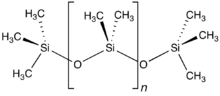
يمكن أن تعدّ السيليكونات مناظرةً للسيليكات، لأنَّ مجموعات الميثيل في السيليكونات متساوية إلكترونياً مع مجموعات −O في السيليكات.[89] تتميّز البوليميرات السيليكونية بثباتيتها الحرارية، وبمقاومتها للأكسدة، كما أنّها عازلة تجاه الماء، ولها العديد من الخواص المفيدة الأخرى، مثل العزل الكهربائي وعدم الالتصاق وعدم تشكيل رغوة؛ كما أنّها مقاومة للأشعّة فوق البنفسجية وللتآكل، بالإضافة إلى خمولها الكيميائي.[89]
تستخدم البوليميرات السيليكونية في تصنيع المواد المقاومة للماء، وفي عمليات الصبّ والقولبة، وفي صناعة مانعات التسرب وشحوم وشموع التزليق، وفي سد الشقوق (الجلفطة). تستخدم السيليكونات في بعض الأحيان في مجال زرع الثدي والعدسات اللاصقة وفي صناعة المتفجّرات والتقانة النارية.[124] يمكن أن يُحضّر المعجون السيليكوني [ملاحظة 53] بإضافة حمض البوريك إلى زيت السيليكون.[125]
المخاطر
يمكن التعرّض للسيليكون العنصري في أماكن العمل، حيث يمثّل خطراً في حال استنشاق غباره؛[126] كما يعدّ مهيّجاً في حال ابتلاعه أو تماسّه مع الجلد أو العين. وضعت إدارة السلامة والصحّة المهنية الأمريكية [ملاحظة 54] حدّ التعرّض المسموح من السيليكون في أماكن العمل في يوم عمل مكوّن من ثمان ساعات بمقدار 15 مغ/م3 في حال التعرّض الإجمالي، وبمقدار 5 مغ/م3 في حال التعرّض التنفّسي. أمّا المعهد الوطني للسلامة والصحّة المهنية الأمريكي [ملاحظة 55] فوضع حدّ التعرّض الموصى به من السيليكون في أماكن العمل في يوم عمل مكوّن من ثمان ساعات بمقدار 10 مغ/م3 في حال التعرّض الإجمالي، وبمقدار 5 مغ/م3 في حال التعرّض التنفسّي.[127] قد يؤدّي استنشاق غبار بلّورات السيليكا إلى السحار السيليسي، وهو مرض من أمراض الرئة المهنية.[128]
طالع أيضاً
هوامش
المراجع
باللغة العربية
بلغات أجنبية
المعلومات الكاملة للمراجع
- Clayden، Jonathan؛ Greeves، Nick؛ Warren، Stuart (2012). Organic Chemistry (ط. 2nd). Oxford University Press. ISBN:978-0-19-927029-3.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- King، R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN:978-0-471-18602-1.
- Zulehner، Werner؛ Neuer، Bernd؛ Rau، Gerhard (2005)، "Silicon"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a23_721


























