عنصر كيميائي
العنصر الكيميائي هو مادة كيميائية لا يمكن تجزئتها، خالصة متكونة من ذرة وحيدة فريدة من نوعها،[2] يميزها العدد الذري وهو عدد بروتونات نواة الذرة. يندرج كل عنصر تحت تصنيف: فلز أو شبه فلز أو لافلز. وتنظم العناصر في الجدول الدوري. وسواء كانت تلك المادة قليلة أو كثيرة، وأطلق على كل عنصر اسم (ورمز) يعرف به ويتميز بخاصية خاصة به. وتم اكتشاف معظم العناصر، فمنها يتكون كل مافي الوجود من نجوم وومجرات وكواكب وأرض وجبال، ونبات، حيوان، وإنسان. ومنها ماهو مستقر ثابت لا يتغير ومنها ماهو غير مستقر، بل يتحول من عنصر إلى آخر بسبب نشاطه الإشعاعي.
| صنف فرعي من | |
|---|---|
| جزء من | |
| الأسباب | |
| يدرسه | |
| النقيض | |
| صنف بنيوي لـ | |
| تصنيف للتصنيفات التي تحمل هذا الاسم |
طبقا لنظرية الانفجار العظيم بدأ الكون بغازي الهيدروجين والهيليوم، وتجمعت تلك الغازات في تجمعات كثيرة فشكلت نجوما وتجمعات نجوم في مجرات. ارتفعت درجة حرارة النجوم الابتدائية منذ نحو 13 مليار سنة فيجري في باطنها تفاعلات نووية واندماجات نووية.[3]
يؤدي الاندماج النووي إلى التحام نوايا عنصري الهيدروجين والهيليوم الخفيفين، فتكون منهما عناصرا أخرى كتلتها أكبر. فبينما تبلغ كتلة الهيدروجين 1 وحدة ذرية والهيليوم 4 وحدات ذرية، تنشأ بتلاحمها المتتالي في النجوم والشمس العناصر الأخرى «وتطبخ»، فيتكوّن الكربون (12 وحدة ذرية) والأكسجين (16 وحدة ذرية)، والصوديوم (23 وحدة ذرية)، وهكذا حتى اليورانيوم (238 وحدة نووية).
لا توجد في الطبيعة عناصر أثقل من اليورانيوم (عدده الذري 92، وكتلته الذرية 238 وحدة ذرية) بسبب عدم استقراره، فهو يتحلل بالإشعاع وينشأ منه بعد ذلك الرصاص وهو عنصر مستقر لا ينقسم ولا يشع [العدد الذري يعادل عدد البروتونات في النواة، والكتلة النوية تعادل عدد البروتونات والنيوترونات فيها]. ولكن استطاع الفزيائيون تركيب عناصرا أثقل من اليورانيوم بواسطة تسليط النيوترونات عليها فتمتصها ويتكون منها عناصر أثقل من 238 وحدة ذرية، مثل البلوتونيوم والأمريسيوم والأينشتاينيوم ولكنها لا تبقى على حالها فسرعان ما تتحلل إلى عناصر أخف منها فتكون مستقرة.
في القِدم

- عرف روبرت بويل في 1661، أن هناك أكثر من مجرد أربعة عناصر.
- عرفت بعد ذلك عناصر أخرى وأعطيت في 1789 تسمية «عناصر الكيمياء» أنطوان لافوازييه، الذي يحتوي على ثلاثة وثلاثون عنصرا،
- وفي عام 1818، عرفة «[يونس ياكوب برتسيليوس]» الأوزان الذرية لخمسة وأربعين عنصر، * وعرف «ديميتري مندلييف مع مطلع القرن العشرين أن العنصر هو مادة نقية لا يمكن أن تكون متحللة في أي مادة. بعبارة أخرى، العنصر لا يمكن أن يتحول إلى عنصر آخر بواسطة تفاعلات كيميائية (ملحوظة: يمكن تحول عنصر إلى عنصر آخر فقط بالتفاعل النووي، وهي تفاعلات فيزيائية وليست كيميائية.)
- وعرف اكتشاف الكيميائي هنري موزلي في عام 1913 أن الأساس في تعريف العنصر المادي هو العدد الذري لذرة، عندما أصبح متفهما بأن الوزن الذري هو مجموع كتل البروتونات والنيوترونات المتمركزة في نواة الذرة. أدت تلك المعلومات في النهاية إلى التعريف الحالي للعنصر،
 | استناداً إلى العدد الذري (عدد البروتونات في نواة الذرة). استخدام الأرقام الذرية، بدلاً من الأوزان الذرية، للتمييز بين العناصر، |  |
- حاليا تعرف الاتحاد الدولي للكيمياء البحتة والتطبيقية العنصر، إذا بقي لنظير مشع مدة أطول من10−14 ثانية بحيث تستطيع خلالها النواة تشكيل سحابة إلكترونية.
- قبل عام 1914، كانت تعرف العناصر اثنين وسبعين، فقط.
- اكتشف العنصر 101 ثم سمي مندليفيوم تكريما للكيميائي منديلييف. وهو أول من قام بترتيب العناصر بطريقة دورية في الجدول الدوري بحسب خواصها الكيميائية.
- في الآونة الأخيرة، وذكر التقرير التوليفي للعنصر 118 (عدد البروتونات في النواة) في تشرين الأول/أكتوبر 2006 م.
- وذكر التقرير التوليفي لعنصر 117 (عدد البروتونات في النواة الذرية) في نيسان/أبريل 2010 م.
(ملحوظة: ينما يحدد العدد الذري (عدد البروتونات) نوع العنصر، يحد مجموع البروتونات والنيوترونات الكتلة الذرية. في العادة يساوي عدد النيوترونات عدد البروتونات في النواة الذرية، ولكن في العناصر الثقيلة يزداد عدد النيوترونات عن عدد البروتونات).
مراحل التعرف على العناصر المختلفة
- قبل القرن الماضي، وفي مختلف الثقافات والعصور القديمة، كانت هناك عشر مواد مألوفة من العناصر الكيميائية وهي:
الكربون، النحاس، الذهب، الحديد، الرصاص، الزئبق، الفضة،الكبريت، القصدير والزنك.
- ثلاث مواد إضافية أيضا كعناصر وهي:
- وعرفت معظم ما تبقى من العناصر الموجودة في الطبيعة قبل عام 1900، بما في ذلك:
- ثم عرفت معظم العناصر النادرة، مثل:
سيريوم لانثانوم، غادولينيوم ونيوديميوم.
- ثم اكتشاف العنصر المشع البولونيوم (العدد الذري 84) واليورانيوم (العدد الذري 92).
- ثم اكتشاف العنصر كوبرنيسيوم رقم 112 في عام 2009، والرمز الذري 'Cn' له.
- ثم العنصر الأثقل الذي يعتقد أنه قد تم تركيبه حتى الآن العنصر 118، أوغانيسون، يوم 9 أكتوبر 2006، في مختبرات فليروف للتفاعلات النووية في دوبنا، روسيا.
- ثم العنصر رقم 117 عنصرا آخر تم ادعاء وجوده إلى أن اكتشف، في عام 2009 وقامت منظمة الاتحاد الدولي للكيمياء البحتة والتطبيقية بالاعتراف رسميا بالعنصر فليروفيوم وليفرموريوم، والعناصر التالية العنصر رقم 114 و116، في يونيو 2011.
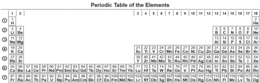
الجدول الدوري
إن هذا الجدول الذي نراه اليوم لا يختلف كثيرا عن الجدول الدوري الذي قام ببنائه ديمتري ماندليف عام 1869 والذي كان يحوي آنذاك على 63 عنصرا فقط دون أن يعلم شيئا عن مبنى الذرة وما تحويه من جسيمات. ذلك الجدول الذي لخص المعلومات المتوفرة آنذاك عن الخصائص الكيميائية للعناصر، مثل التكافؤ والعناصر النبيلة.
وقد كان ماندليف يمارس لعبة الورق «السوليتير» في سفراته الطويلة مما أوحى له أن يكرس لكل عنصر بطاقة تحوي اسمه وصفاته. وبذا فقد جمع 63 بطاقة بعدد العناصر المعروفة في ذلك الوقت. وحاول ترتيبها بشتى الطرق إلا أنه لم ينجح في ذلك سوى في شهر شباط من عام 1869، حيث رتب العناصر حسب أوزانها الذرية بحيث كوّن جدولا من أعمدة وأسطر. في الأعمدة تتواجد العناصر ذات الصفات المتشابهة من وجهة التكافؤ وهي تكون ما يدعى بالعائلات. أما في الأسطر فالعناصر مرتبة بحيث تتدرج أوزانها تدريجيا.
كيف نجح ماندليف في مهمته في حين فشل أخرون؟ ولماذا ارتبط الجدول الدوري باسمه وليس باسم لوثر ماير ألمانيا الذي نشر جدولا مشابها في نفس الفترة؟؟أن السبب في ذلك يعود أساسا إلى نجاح ماندليف في التنبؤ بوجود عناصر لم تكن معروفة آنذاك. لذا فقد أبقى عددا من الخانات فارغة في جدوله مع تحديد صفاتها. أولى توقعاته تحققت حينما اُكْتُشِف الغاليوم عام 1875.الخطأ الوحيد الذي وقع فيه ماندليف هو ترتيب العناصر حسب أوزانها الذرية (الكتلة الذرية) وليس حسب أعدادها الذرية (عدد البروتونات). ولحسن حظه فإنه في معظم الحالات تزيد الأوزان الذرية بزيادة الأعداد الذرية.
قائمة بأسماء العناصر المعروفة الآن والبالغ عددها ‹118›

- يتضمن الجدول التالي فرز العناصر المعروفة البالغ عددها 118.
- ويرد في هذا الجدول كل من العدد الذري للعنصر والاسم ورمز وخصائصه الطبيعية والكيميائية.
- ويتضمن الجدول القياسات على العناصر (الصلبة أو السائلة أو الغازية) من قبل المنظمة الدولية(STP)[هل المصدر موثوق به؟].
- ويتضمن أيضا الخصائص الرئيسية ونظائر العنصر، هل هي مستقرة أم غير مستقرة طبيعيا، والمصنعة تكنولوجيا، أي التي لا توجد بشكل طبيعي في الطبيعة.
- ويصف ملخص خصائص العناصر باستخدام الفئات العريضة المقدمة عادة في جداول الدوري: أكتينيدات، فلز قلوي فلز قلوي ترابي، الهالوجين، لانثانيدات، والفلزات، أشباه فلزات، الغازات الخاملة، لافلزات والمعادن الانتقالية
| العدد الذري | الاسم | الرمز | المجموعة | الدورة | التجمع | الحالة | الاكتشاف | الوصف |
|---|---|---|---|---|---|---|---|---|
| 1 | الهيدروجين | H | 1 | 1 | s | غاز | طبيعي | لا فلز |
| 2 | الهيليوم | He | 18 | 1 | s | غاز | طبيعي | غاز نبيل |
| 3 | الليثيوم | Li | 1 | 2 | s | صلب | طبيعي | فلز قلوي |
| 4 | البريليوم | Be | 2 | 2 | s | صلب | طبيعي | فلز قلوي |
| 5 | البورون | B | 13 | 2 | p | صلب | طبيعي | شبه فلز |
| 6 | الكربون | C | 14 | 2 | p | صلب | طبيعي | لا فلز |
| 7 | النيتروجين | N | 15 | 2 | p | غاز | طبيعي | لا فلز |
| 8 | الأكسجين | O | 16 | 2 | p | غاز | طبيعي | لا فلز |
| 9 | الفلور | F | 17 | 2 | p | غاز | طبيعي | هالوجيني |
| 10 | النيون | Ne | 18 | 2 | p | غاز | طبيعي | غاز نبيل |
| 11 | الصوديوم | Na | 1 | 3 | s | صلب | طبيعي | فلز قلوي |
| 12 | الماجنيسيوم | Mg | 2 | 3 | s | صلب | طبيعي | فلز قلوي |
| 13 | الألمينيوم | Al | 13 | 3 | p | صلب | طبيعي | فلز |
| 14 | السيليكون | Si | 14 | 3 | p | صلب | طبيعي | شبه فلز |
| 15 | الفوسفور | P | 15 | 3 | p | صلب | طبيعي | لا فلز |
| 16 | الكبريت | S | 16 | 3 | p | صلب | طبيعي | لا فلز |
| 17 | الكلور | Cl | 17 | 3 | p | غاز | طبيعي | هالوجيني |
| 18 | أرغون | Ar | 18 | 3 | p | غاز | طبيعي | غاز نبيل |
| 19 | البوتاسيوم | K | 1 | 4 | s | صلب | طبيعي | فلز قلوي |
| 20 | الكالسيوم | Ca | 2 | 4 | s | صلب | طبيعي | فلز قلوي |
| 21 | السكانديوم | Sc | 3 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 22 | التيتانيوم | Ti | 4 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 23 | فاناديوم | V | 5 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 24 | الكروم | Cr | 6 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 25 | المنجنيز | Mn | 7 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 26 | الحديد | Fe | 8 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 27 | الكوبالت | Co | 9 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 28 | النيكل | Ni | 10 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 29 | النحاس | Cu | 11 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 30 | الزنك | Zn | 12 | 4 | d | صلب | طبيعي | فلز انتقالي |
| 31 | الجاليوم | Ga | 13 | 4 | p | صلب | طبيعي | فلز |
| 32 | جيرمانيوم | Ge | 14 | 4 | p | صلب | طبيعي | شبه فلز |
| 33 | زرنيخ | As | 15 | 4 | p | صلب | طبيعي | شبه فلز |
| 34 | سيلينيوم | Se | 16 | 4 | p | صلب | طبيعي | لا فلز |
| 35 | البروم | Br | 17 | 4 | p | سائل | طبيعي | هالوجيني |
| 36 | الكريبتون | Kr | 18 | 4 | p | غاز | طبيعي | غاز نبيل |
| 37 | الروبيديوم | Rb | 1 | 5 | s | صلب | طبيعي | فلز قلوي |
| 38 | سترونشيوم | Sr | 2 | 5 | s | صلب | طبيعي | فلز قلوي |
| 39 | إتريوم | Y | 3 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 40 | زركونيوم | Zr | 4 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 41 | النيوبيوم | Nb | 5 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 42 | موليبدنوم | Mo | 6 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 43 | تكنيشيوم | Tc | 7 | 5 | d | صلب | عابر / وقتي | فلز انتقالي |
| 44 | الروثينيوم | Ru | 8 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 45 | الروديوم | Rh | 9 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 46 | بالاديوم | Pd | 10 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 47 | الفضة | Ag | 11 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 48 | كادميوم | Cd | 12 | 5 | d | صلب | طبيعي | فلز انتقالي |
| 49 | الإنديوم | In | 13 | 5 | p | صلب | طبيعي | فلز |
| 50 | قصدير | Sn | 14 | 5 | p | صلب | طبيعي | فلز |
| 51 | إثمد | Sb | 15 | 5 | p | صلب | طبيعي | شبه فلز |
| 52 | تيلوريوم | Te | 16 | 5 | p | صلب | طبيعي | شبه فلز |
| 53 | يود | I | 17 | 5 | p | صلب | طبيعي | هالوجيني |
| 54 | زينون | Xe | 18 | 5 | p | غاز | طبيعي | غاز نبيل |
| 55 | سيزيوم | Cs | 1 | 6 | s | صلب | طبيعي | فلز قلوي |
| 56 | باريوم | Ba | 2 | 6 | s | صلب | طبيعي | فلز قلوي |
| 57 | لانثانوم | La | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 58 | سيريوم | Ce | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 59 | براسوديميوم | Pr | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 60 | نيوديميوم | Nd | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 61 | بروميثيوم | Pm | 3 | 6 | f | صلب | عابر / وقتي | لانثانيد |
| 62 | ساماريوم | Sm | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 63 | يوروبيوم | Eu | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 64 | جادولينيوم | Gd | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 65 | تيربيوم | Tb | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 66 | ديسبروسيوم | Dy | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 67 | هولميوم | Ho | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 68 | إربيوم | Er | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 69 | ثوليوم | Tm | 3 | 6 | f | صلب | طبيعي | لانثانيد |
| 70 | إتيربيوم | Yb | 3 | 6 | f | صلب | أساسي | لانثانيد |
| 71 | لوتيشيوم | Lu | 3 | 6 | d | صلب | أساسي | لانثانيد |
| 72 | هافنيوم | Hf | 4 | 6 | d | صلب | أساسي | فلز انتقالي |
| 73 | تانتالوم | Ta | 5 | 6 | d | صلب | أساسي | فلز انتقالي |
| 74 | تنجستن | W | 6 | 6 | d | صلب | أساسي | فلز انتقالي |
| 75 | رينيوم | Re | 7 | 6 | d | صلب | أساسي | فلز انتقالي |
| 76 | أوزميوم | Os | 8 | 6 | d | صلب | أساسي | فلز انتقالي |
| 77 | إريديوم | Ir | 9 | 6 | d | صلب | أساسي | فلز انتقالي |
| 78 | بلاتين | Pt | 10 | 6 | d | صلب | أساسي | فلز انتقالي |
| 79 | ذهب | Au | 11 | 6 | d | صلب | أساسي | فلز انتقالي |
| 80 | زئبق | Hg | 12 | 6 | d | سائل | أساسي | عنصر انتقالي |
| 81 | ثاليوم | Tl | 13 | 6 | p | صلب | أساسي | فلز |
| 82 | رصاص | Pb | 14 | 6 | p | صلب | أساسي | فلز |
| 83 | بزموت | Bi | 15 | 6 | p | صلب | أساسي | فلز |
| 84 | بولونيوم | Po | 16 | 6 | p | صلب | عابر | شبه فلزي |
| 85 | أستاتين | At | 17 | 6 | p | صلب | عابر | هالوجين |
| 86 | رادون | Rn | 18 | 6 | p | غاز | عابر | غاز نبيل |
| 87 | فرانسيوم | Fr | 1 | 7 | s | صلب | عابر | فلز قلوي |
| 88 | راديوم | Ra | 2 | 7 | s | صلب | عابر | فلز قلوي أرضي |
| 89 | أكتينيوم | Ac | 3 | 7 | f | صلب | عابر | أكتينيد |
| 90 | ثوريوم | Th | 3 | 7 | f | صلب | أساسي | أكتينيد |
| 91 | بروتكتينيوم | Pa | 3 | 7 | f | صلب | عابر | أكتينيد |
| 92 | يورانيوم | U | 3 | 7 | f | صلب | أساسي | أكتينيد |
| 93 | نبتونيوم | Np | 3 | 7 | f | صلب | عابر | أكتينيد |
| 94 | بلوتونيوم | Pu | 3 | 7 | f | صلب | أساسي | أكتينيد |
| 95 | أمريسيوم | Am | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 96 | كوريوم | Cm | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 97 | بركيليوم | Bk | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 98 | كاليفورنيوم | Cf | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 99 | أينشتاينيوم | Es | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 100 | فرميوم | Fm | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 101 | مندليفيوم | Md | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 102 | نوبليوم | No | 3 | 7 | f | صلب | مصطنع | أكتينيد |
| 103 | لورنسيوم | Lr | 3 | 7 | d | صلب | مصطنع | أكتينيد |
| 104 | رذرفورديوم | Rf | 4 | 7 | d | مصطنع | فلز انتقالي | |
| 105 | دوبنيوم | Db | 5 | 7 | d | مصطنع | فلز انتقالي | |
| 106 | سيبورغيوم | Sg | 6 | 7 | d | مصطنع | فلز انتقالي | |
| 107 | بوريوم | Bh | 7 | 7 | d | مصطنع | فلز انتقالي | |
| 108 | هاسيوم | Hs | 8 | 7 | d | مصطنع | فلز انتقالي | |
| 109 | مايتنريوم | Mt | 9 | 7 | d | مصطنع | ||
| 110 | دارمشتاتيوم | Ds | 10 | 7 | d | مصطنع | ||
| 111 | رونتجينيوم | Rg | 11 | 7 | d | مصطنع | ||
| 112 | كوبرنيسيوم | Cn | 12 | 7 | d | مصطنع | فلز انتقالي | |
| 113 | (نيهونيوم) | Nh | 13 | 7 | p | مصطنع | ||
| 114 | (فليروفيوم) | Fl | 14 | 7 | p | مصطنع | ||
| 115 | (موسكوفيوم) | Mc | 15 | 7 | p | مصطنع | ||
| 116 | (ليفرموريوم) | Lv | 16 | 7 | p | مصطنع | ||
| 117 | (تينيسين) | Ts | 17 | 7 | p | مصطنع | ||
| 118 | (أوغانيسون) | Og | 18 | 7 | p | مصطنع |