فلور
الفلور هو عنصر كيميائي رمزه F وعدده الذرّي 9، ويكون على هيئة غاز ثنائي الذرة F2 له لون أصفر شاحب في الظروف القياسيّة من الضغط ودرجة الحرارة، وهو غاز سام ذو تأثير سلبي على الكائنات الحيّة. يقع عنصر الفلور على رأس مجموعة الهالوجينات في الجدول الدوري، وهو ذو نشاط كيميائي كبير، إذ أنّه أكثر عناصر الجدول الدوري كهرسلبية، ويشكّل مركّبات كيميائية مع أغلبها، حتى مع بعض الغازات النبيلة؛ وتسمّى أملاح عنصر الفلور باسم الفلوريدات.
| ||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
غاز أصفر شاحب اللون الفلور السائل عند درجات حرارة منخفضة جداً. | ||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||
| الاسم، العدد، الرمز | فلور، 9، F | |||||||||||||||||||||
| تصنيف العنصر | هالوجين | |||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 17، 2، p | |||||||||||||||||||||
| الكتلة الذرية | 18.9984032 غ·مول−1 | |||||||||||||||||||||
| توزيع إلكتروني | 1s2 2s2 2p5 | |||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 7 (صورة) | |||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||
| الطور | غاز | |||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كيلوباسكال) 1.7 غ/ل | |||||||||||||||||||||
| كثافة السائل عند نقطة الغليان | 1.505 [1] غ·سم−3 | |||||||||||||||||||||
| نقطة الانصهار | 53.53 ك، −219.62 [2] °س | |||||||||||||||||||||
| نقطة الغليان | 85.03 ك، −188.12 [2] °س | |||||||||||||||||||||
| نقطة ثلاثية | 53.48 كلفن (-220°س)، 90 [2] كيلوباسكال | |||||||||||||||||||||
| النقطة الحرجة | 144.13 [2] ك، 5.172 [2] ميغاباسكال | |||||||||||||||||||||
| حرارة الانصهار | F2) 0.510) كيلوجول·مول−1 | |||||||||||||||||||||
| حرارة التبخر | F2) 6.51) [3] كيلوجول·مول−1 | |||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (F2) 31.304 [1] جول·مول−1·كلفن−1 | |||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||
| ||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||
| أرقام الأكسدة | −1 (يؤكسد الأكسجين) | |||||||||||||||||||||
| الكهرسلبية | 3.98 [4] (مقياس باولنغ) | |||||||||||||||||||||
| طاقات التأين | الأول: 1681.0 [5] كيلوجول·مول−1 | |||||||||||||||||||||
| الثاني: 3374.2 [5] كيلوجول·مول−1 | ||||||||||||||||||||||
| الثالث: 6050.4 [5] كيلوجول·مول−1 | ||||||||||||||||||||||
| نصف قطر تساهمي | 64 [6] بيكومتر | |||||||||||||||||||||
| نصف قطر فان دير فالس | 135 [7] بيكومتر | |||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||
| البنية البلورية | نظام بلوري مكعب | |||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة [8][9] | |||||||||||||||||||||
| الناقلية الحرارية | 25.9 [10] ميلي واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||
| رقم CAS | 7782-41-4 [4] | |||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||
| المقالة الرئيسية: نظائر الفلور | ||||||||||||||||||||||
| ||||||||||||||||||||||
يقع عنصر الفلور في المرتبة 13 من بين العناصر الكيميائية بالنسبة لوفرته في كوكب الأرض، وفي المرتبة 24 بالنسبة لوفرته في الكون. يعدّ معدن الفلوريت مصدر التعدين الأساسي للفلور، إذ يستحصل عليه من خلال عملية التحليل الكهربائي؛ ومن المعادن الحاوية على عنصر الفلور أيضاً معدن الكريوليت النادر، والذي يستخدم في علم الفلزات كصهيرة من أجل تخفيض نقطة انصهار الفلزّات أثناء التعدين. يستطيع الفلور تشكيل عدد كبير من الفلوريدات اللاعضوية والعضوية، والتي لها العديد من التطبيقات الصناعية المهمّة.
تعدّ الفلوريدات العضوية من المواد الثابتة ضد التحلّل الحيوي لذلك تصنّف ضمن الغازات الدفيئة التي تسبّب الاحتباس الحراري. بالمقابل يفيد أيون الفلوريد في مقاومة نخر الأسنان، لذلك يضاف بكمّيّات قليلة إلى تركيب معاجين الأسنان بالإضافة إلى ملح الطعام وماء الشرب في بعض البلدان.
التاريخ وأصل التسمية

الاكتشافات الأولية
في سنة 1529 وصف عالم التعدين غيورغيوس أغريكولا معدن الفلوريت كمادّة مضافة ملائمة أثناء صهر الفلزّات، إذ تعمل على تخفيض نقطة انصهارها أثناء المعالجة.[11][12] ولتمييز تلك الخاصّية أطلق أغريكولا الكلمة اللاتينية فلوريس fluorés (والتي تعني الجريان) على صخور الفلوريت. تطوّر الاسم لاحقاً إلى فلورسبار fluorspar وبعد ذلك إلى فلوريت fluorite.[13][14][15] عُرف فيما بعد أنّ تركيب الفلوريت هو من فلوريد الكالسيوم CaF2.[16]
استُخدم حمض الهيدروفلوريك منذ أواسط القرن السابع عشر في تنميش الزجاج (معالجته بالحمض)،[16][17] وكان أندرياس سيغيسموند مارغراف أوّل من وصف تلك العملية بشكل مفصّل سنة 1764 عندما قام بتسخين الفلوريت مع حمض الكبريتيك ممّا أدّى إلى تخريش الإناء الزجاجي الحاوي على المزيج.[18][19] كرّر العالم كارل فلهلم شيله التجربة سنة 1771 وقام بتسميّة الناتج الحمضي باسم fluss-spats-syran (حمض الفلورسبار).[19][20] وفي سنة 1810 اقترح الفيزيائي أندريه ماري أمبير ارتباط الهيدروجين مع عنصر مشابه للكلور في تركيب حمض الهيدروفلوريك،[21] أمّا همفري ديفي فاقترح تسميّة ذلك العنصر - غير المعروف آنذاك - باسم fluorine وذلك من حمض الفلوريك. وبذلك استعملت كلمة فلور لوصف هذا العنصر في العديد من اللغات الأوروبيّة مع بعض التحويرات البسيطة، في حين أنّ اللغة اليونانية والروسية وبعض اللغات الأخرى تستعمل اسم فتور وتحويرات لها، وذلك من الإغريقية φθόριος فثوريوس بمعنى مدمّر أو مخرّش.[22][23] كرمز موحّد للعنصر استخدم حرف F لذلك، مع العلم أن الرمز Fl استعمل في النشرات العلمية الأولى في الماضي.[24]
عزل العنصر
كانت التجارب الأولية على الفلور ومركّباته خطيرة إلى درجة أنّ العديد من علماء القرن التاسع عشر الذين أجروا تجاربهم على ذلك العنصر أُطلق عليهم اسم ضحايا الفلور، وذلك بعد التجارب غير الناجحة وغير الموفّقة باستخدام حمض الهيدروفلوريك، ومن بين هؤلاء العلماء كل من ديفي وغي ـ لوساك وتينار ومواسان.[16][25] تمحورت تجارب الفصل على التحليل الكهربائي للفلوريدات، ولكن ما أعاق عزل عنصر الفلور هو كونه عالي التخريش إلى حدّ كبير، وذلك لكلّ من العنصر بحدّ ذاته أو فلوريد الهيدروجين، بالإضافة إلى عدم وجود كهرل مناسب لإجراء عمليّة العزل.[16][25] اقترح إدموند فريمي أنّ التحليل الكهربائي لحمض هيدروفلوريك النقي وسيلة مناسبة للحصول على الفلور، وقام بتصميم طريقة لإنتاج عيّنات خاليّة من الماء (لامائيّة) من بيفلوريد البوتاسيوم؛ لكنّه وجد أنّ فلوريد الهيدروجين الجافّ لا ينقل التيّار الكهربائي.[16][25][26]
تابع هنري مواسان، والذي كان طالباً سابقاً لفيرمي، التجارب في هذا السياق، واكتشف بعد محاولات كثيرة والعديد من التجارب المضنية أنّ مزيجاً من بيفلوريد البوتاسيوم وفلوريد الهيدروجين الجاف يكون ناقلاً للتيّار، ممّا يمكّن من إجراء التحليل الكهربائي. من أجل تجنّب حدوث عمليّة تآكل سريعة لقطب البلاتين في خليته الكهركيميائية قام مواسان بتبريدها إلى درجات حرارة منخفضة، كما قام باستعمال أقطاب من الإريديوم،[25][27] ممّا مكّنه سنة 1886 من عزل الفلور لأول مرة.[26][28] قبل شهرين من وفاته استلم مواسان جائزة نوبل في الكيمياء سنة 1906 كتقدير لأبحاثه عن هذا العنصر.[29]
- هنري مواسان
- رسم لجهاز مواسان يعود إلى سنة 1887
استخدامات لاحقة

أجرت شركة فرجدير، والتي كانت تابعة لشركة جنرال موتورز (GM)، تجاربها على استخدام مركّبات كلوروفلوروكربون كمثلِّجات وذلك في أواخر عقد 1920، وكنتيجة لذلك قام مشروع مشترك بين GM ودو بونت سنة 1930 من أجل تسويق تلك المركّبات التي عرفت باسم فريون، وخاصة فريون-12. مع تزايد الطلب على هذه المركّبات قامت شركة دو بونت بشراء حقوق الإنتاج وطوّرت العديد من مركّبات الفريون الأخرى.[19][30][31][32] اكتشف بولي رباعي فلورو الإيثيلين مصادفةً سنة 1938 عندما كان روي بلنكيت يعمل على تطوير مواد التثليج في مختبرات دو بونت. بسبب خواصها الممتازة في العزل الكيميائي والحراري أصبح لهذه المادة شهرة كبيرة، وأنتج منها كمّيّات كبيرة سنة 1941 وسوّقت تحت اسم تيفلون Teflon.[19][30][31]
أنتج كمّيّات كبيرة من عنصر الفلور أثناء الحرب العالميّة الثانيّة، سواء من قبل ألمانيا النازية، أو الولايات المتّحدة الأمريكية وذلك لأغراض مختلفة. استخدم الألمان التحليل الكهربائي عند درجات حرارة مرتفعة للحصول على أطنان من ثلاثي فلوريد الكلور،[33] وذلك في معامل شركة إي.غة. فاربن I.G. Farben من أجل تحضير القنابل الحارقة؛[34] وكذلك من قبل الولايات المتّحدة الأمريكية من أجل مشروع مانهاتن لصنع القنبلة النووية، وذلك لإنتاج سداسي فلوريد اليورانيوم والذي استخدم من أجل تخصيب اليورانيوم. أدّى الاستمرار في الأبحاث النووية بعد الحرب إلى تطوير كيمياء الفلور لاحقاً.[35]
الوفرة الطبيعية
في الكون
| العدد الذرّي | العنصر | الكمّية النسبية |
|---|---|---|
| 6 | كربون | 4,800 |
| 7 | نتروجين | 1,500 |
| 8 | أكسجين | 8,800 |
| 9 | فلور | 1 |
| 10 | نيون | 1,400 |
| 11 | صوديوم | 24 |
| 12 | مغنسيوم | 430 |
يوجد عنصر الفلور في الكون بنسبة 400 جزء في البليون (ppb)، وهو بذلك يقع في المرتبة 24 من حيث الوفرة بالنسبة لباقي العناصر الكيميائية. ومع ذلك، فإنّ هذه النسبة قليلة بالنسبة لباقي العناصر الخفيفة، إذ أنّ العناصر من الكربون إلى المغنسيوم ذات وفرة أكبر في الكون لمرتبة تصل إلى عشرين ضعف أو أكثر.[37] يعود هذا الأمر إلى أنّ تفاعلات الانصهار النجمي تتجاوز الفلور، إذ أنّ ذرّات هذا العنصر في حال تخليقها تكون ذات مقطع نووي كبير، ممّا يسمح بالاندماج النووي مع ذرّة هيدروجين أو هيليوم لتشكّل الأكسجين أو النيون على الترتيب.[37][38]
أمّا النسبة المتبقية من الفلور في الكون فهي تتشكّل حسب أحد ثلاثة تفسيرات:[37][39]
- أثناء الاستعار الأعظم من النوع 2 يحدث قذف لذرّات النيون بجسيمات نيوترينو والتي تحوّلها إلى فلور؛
- يمكن للرياح الشمسية لنجوم وولف-رايت أن تحمل ذرّات الفلور بعيداً عن أية ذرّات من الهيدروجين أو الهيليوم؛
- يحمل الفلور بعيداً من تيّارات الحمل الحراري الناتجة عن اندماج نجوم العملاق المقارب.
على الأرض
يقع الفلور في المرتبة 13 من حيث الوفرة بالنسبة لباقي العناصر الكيميائية في القشرة الأرضية، إذ يتراوح تركيزه فيها بين 600 - 700 جزء في المليون (ppm) كتلةً.[40] في حال وجود غاز الفلور في غلاف الأرض الجوّي فإنه سيتفاعل بسهولة كبيرة مع بخار الماء في الجوّ، ممّا يمنع من وجوده بالتالي على شكل عنصر حر.[41][42] بسبب النشاط الكيميائي الكبير للفلور فهو يوجد فقط بشكل مرتبط مع عناصر أخرى في أشكال معدنيّة مثل فلوريت وفلورأباتيت وكريوليت، وهي معادن ذات أهميّة صناعيّة كبيرة.[40][43] كما تحوي بعض المعادن الأخرى مثل التوباز على عنصر الفلور في تركيبها.
لمعدن الفلوريت الصيغة الكيميائية CaF2، وهو عبارة عن فلوريد الكالسيوم، ويكون على شكل معدن ملوّن له وفرة طبيعيّة كبيرة، ولذلك يعدّ مصدر التعدين الأساسي للفلور. تعدّ الصين والمكسيك من أكبر الدول المنتجة لهذه الخامة (بيانات 2006). كانت الولايات المتّحدة الأمريكية الرائدة في إنتاج الفلوريت في أوائل القرن العشرين، لكنّها توقّفت عن تعدينه منذ سنة 1995.[43][13][44][45][46]
ما يعيق استخدام فلورأباتيت Ca5(PO4)3F في تعدين الفلور هو انخفاض الكسر الكتلي (3.5%)، لذلك يستخدم في إنتاج الفوسفات. تنتج كمّيّات قليلة من مركّبات الفلور في الولايات المتّحدة من حمض سداسي فلورو السيليسيك H2SiF6، وهو ناتج ثانوي من صناعة الفوسفات.[43]
أمّا الكريوليت Na3AlF6 فهو معدن يستعمل بشكل أساسي في إنتاج الألومنيوم، لكنّه أكثر معادن الفلور ندرةً، ويتركّز في مناطق جغرافيّة محدّدة. كان المصدر الرئيسي لتعدين الكريوليت في منجم يقع غربي اليونان، والذي أغلق سنة 1987، وأغلب الكريوليت الموجود حالياً يحصل عليه بشكل صناعي.[43]
| معادن الفلور الأساسية | ||
 |  |  |
| فلوريت | فلورأباتيت | كريوليت |
على العكس من باقي الهاليدات فإنّ الفلوريدات غير منحلّة في الماء، لذلك لا توجد بتراكيز تمكّن من استخراجها اقتصاديّاً من مياه البحر المالحة.[43] عثر على كمّيّات نزرة وشحيحة من فلوريدات عضوية ذات مصدر غير معلوم في الثورات البركانية والينابيع الجيوحرارية.[47] إنّ وجود غاز الفلور في البلّورات، وذلك كتفسير للرائحة الناتجة عن تهشيم معدن أنتوزونيت antozonite، وهو شكل من أشكال الفلوريت، أمرٌ مشكوك بصحته.[48][49] على الرغم من ذلك، أظهرت دراسة سنة 2012 وجود ما نسبته 0.04% وزناً من غاز F2 في عيّنة أنتوزونيت، وعزي وجود تلك المتضمّنات إلى الإشعاع الصادر عن وجود كمّيّات ضئيلة من عنصر اليورانيوم في الخامة.[49]
الإنتاج والتحضير
بلغ تعدين الفلوريت، وهو المصدر الرئيسي للفلور في العالم، ذروته سنة 1989 عندما استُخرج 5.6 مليون طن متري من هذه الخامة. أدّت التقييدات على إنتاج مركّبات كلوروفلوروكربون (CFCs) إلى تخفيض الإنتاج إلى 3.6 مليون طن سنة 1994، ثم زاد الإنتاج من حينها مجدّداً. في سنة 2003 سُجّل إنتاج حوالي 4.5 مليون طن مع عائدات بلغت 550 مليون دولار أمريكي؛ وقدّرت تقارير لاحقة المبيعات العالمية من صناعات الفلور الكيميائية سنة 2011 بحوالي 15 بليون دولار أمريكي، وتنبّأت أن يقفز الإنتاج للفترة ما بين 2016–2018 إلى قيمة تتراوح بين 3.5 إلى 5.9 مليون طن، وعائدات لا تقلّ عن 20 بليون دولار.[19][50][51][52][53]
الإنتاج الصناعي

تستخدم طريقة مواسان في إنتاج كمّيات صناعية من الفلور عن طريق إجراء تحليل كهربائي لمصهور مزيج من فلوريد البوتاسيوم/فلوريد الهيدروجين بفرق جهد بين 8 - 12 فولت. أثناء العملية تختزل أيونات الهيدروجين على مهبط من الفولاذ لينتج غاز الهيدروجين، بالمقابل، تتأكسد أيونات الفلوريد على مصعد مصنوع من الكربون لينتج غاز الفلور.:[44][54]
يتم رفع درجات الحرارة أثناء العملية إلى درجة تتراوح بين 70 - 130 °س، إذ أنّ KF•2HF ينصهر عند 70 °س، ووجوده ضروري لأنّ HF النقي لا يمكن تحليله كهربائياً.[19][55][56] يمكن تخزين الفلور في خزّانات أسطوانيّة من الفولاذ تكون مبطّنة من الداخل لحمايتها من التآكل، وذلك عند درجات حرارة أقل من 200 °س، وإلاّ فإنّ استخدام النيكل في صناعتها سيكون ضرورياً.[19][57] تُصنع الصمّامات والأنابيب في منشأة إنتاج الفلور عادةً من النيكل، ويمكن استخدام سبيكة مونيل من أجل تمديدات الأنابيب أيضاً.[58] يجب الحذر أثناء إنتاج الفلور ونقله من عدم وجود أيّ رطوبة أو مواد دهنية، لذلك يتم العزل عادةً باستخدام التيفلون.[59]
التحضير المخبري
تمكّن العالم كارل كريستي Karl O. Christe في سنة 1986 من تصميم طريقة مخبرية لإنتاج غاز الفلور بمردود مرتفع وتحت الضغط الجوي:[60]
إنّ المواد المستخدمة في التفاعلات أعلاه معروفة منذ أكثر من 100 سنة، لكنّ مواسان استخدم طريقة التحليل الكهربائي بدل التفاعل المباشر.[61] غاز الفلور الناتج صناعياً أو مخبرياً نشيط جداً بحيث لا يمكن عزله كيميائياً.[62]
النظائر
يوجد هناك نظير واحد فقط للفلور في الطبيعة وبشكل وفير، وهو النظير فلور-19 19F.[63] لهذا النظير نسبة مغناطيسية دورانية مرتفعة،[64] وحساسية استثنائية للحقول المغناطيسية، ونظراً لأنّه النظير الوحيد المستقر فإنّه يستخدم في التصوير بالرنين المغناطيسي.[65]
للفلور 17 نويدة مشعّة لها عدد كتلي يتراوح بين 14 و 31، وجميعها مصطنعة ولا توجد في الطبيعة، وأطولها عمراً هو النظير فلور-18 18F، والذي يبلغ عمر النصف له 109.77 دقيقة. أمّا باقي النظائر المشعّة فلها قيم عمر نصف أقلّ من 70 ثانية، ومعظمها يضمحلّ في أقلّ من نصف ثانية.[66] يخضع النظيران فلور-17 وفلور-18 أثناء الاضمحلال إلى عمليّة إصدار بوزيتروني β+، أمّا النظائر الأخفّ فتضمحلّ بعملية اصطياد إلكترون، في حين أنّ النظائر الأثقل من فلور-19 تخضع إلى اضمحلال بيتا أو إصدار نيوتروني.[66] هناك مصاوغ نووي واحد للفلور وهو 18mF، وله عمر نصف يبلغ 234 نانوثانية.[67]
الخواص الفيزيائية
يكون الفلور في الشروط العادية من الضغط ودرجة الحرارة على شكل غاز ذي لون أصفر شاحب،[68] وله رائحة واخزة قابلة للكشف عند تراكيز تصل إلى 20 جزء في البليون (ppb).[69] يختلف مدى لون الغاز حسب سماكة الطبقات الموجودة في الإناء الحاوي له، أي حسب التركيز، إذ أنّه يكون عديم اللون في التراكيز الضئيلة، وفي التراكيز المرتفعة يصبح ذا لون أصفر. عند درجات حرارة أقل من −188 °س يكون الفلور على شكل سائل له لون أصفر يشبه لون الكناري المميّز.[70][71] للفلور كثافة مقدارها 1.6959 كغ/م³ عند الدرجة 0 °س وضغط 1013 هيكتوباسكال، بالتالي فهو أكثف من الهواء. تقع النقطة الحرجة للفلور عند ضغط 52.5 بار ودرجة حرارة مقدارها 144.2 كلفن (−129 °س).
تبلغ نقطة انصهار الفلور −219.52 °س؛[72] وهناك شكلان معروفان من الفلور الصلب، أحدهما يكون عند درجات حرارة تقع بين −227.6 °س ونقطة انصهار الفلور، ويكون على شكل نظام بلّوري مكعّب تبلغ قيمة ثابت الشبكة البلّورية له a = 667 بيكومتر، ويعرف هذا الشكل بالنمط بيتّا β.[73] يكون الشكل بيتّا شفّافاً وغير صلد، وله بنية بلّورية مكعّبة غير منتظمة،[74][75] وشبيهة بالتي عند الأكسجين الصلب المتبلور حديثاً،[70] وذلك على العكس من بنية النظام البلّوري المعيني القائم الموجودة عند باقي الهالوجينات الصلبة.[76][77] أمّا عند درجات حرارة دون −227.6 °س فيكون شكل الفلور الصلب من النمط ألفا α، وهو نمط شاف وصلد،[78] يتبلور حسب نظام بلوري أحادي الميل، تكون ثوابت الشبكة البلورية له حسب ما يلي: a = 550 بيكومتر، و b = 328 بيكومتر، و c = 728 بيكومتر، والزاوية β = 102.17°.[79] يكون هذا التحوّل الطوري من النمط بيتّا β إلى ألفا α في الفلور الصلب ناشراً للحرارة بشكل أكبر من تكاثف الفلور، ويمكن أن يكون عنيفاً.[76][77]
البنية الجزيئية
يوجد الفلور في حالته العنصريّة على شكل جزيء ثنائي الذرّة F2،[3] مثله كمثل باقي عناصر مجموعة الهالوجينات. يبلغ طول الرابطة F-F في جزيء الفلور 144 بيكومتر، وهي بذلك أقصر من الرابطة التساهمية البسيطة كربون-كربون (154 بيكومتر). على الرغم من قصر هذه الرابطة الكيميائية إلّا أنّ طاقة تفكّك الرابطة F-F ضئيلة (158 كيلوجول/مول) بالمقارنة مع الروابط الأخرى، وهي تقارب طاقة تفكك جزيء اليود، والذي له طول رابطة يبلغ 266 بيكومتر. يعود ذلك إلى أنّ الأزواج غير الرابطة في ذرّات الفلور تتقارب عند تشكيل الجزيء ممّا يؤدّي إلى تنافرها، وهذا يقود في النهاية إلى سهولة انفصام الرابطة، والذي يفسّر بالتالي النشاط الكيميائي الكبير للفلور.
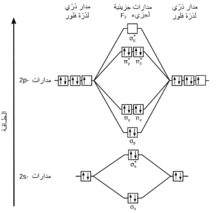
حسب نظرية المدارات الجزيئية فإنّ المدارات الذرّية s و p للذرّات المنفردة تتقارب لتشكل مدارات جزيئيّة رابطة وأخرى مضادّة للترابط. خلال الارتباط تتحوّل المدارات الذرّيّة 1s و 2s إلى المدارات الجزيئيّة σs و σs*. بما أنّ هذه المدارات الجزيئية تكون ممتلئةً بالكامل بالالكترونات، لذلك لا يكون لها دور في عملية الارتباط. بالمقابل، فإنّ المدارات الذرّيّة 2p في ذرّات الفلور المنفردة تتقارب لتشكّل ستّة مدارات جزيئية ذات مستويات طاقية متباينة، وهي: المدارات الرابطة σp و πy و πz بالإضافة إلى المدارات المضادّة للترابط σp* و πy* و πz*. تمتلك المدارات π مستويات طاقة متساوية كما هو موضّح في مخطط المدارات الجزيئية. عند توزيع الإلكترونات في المدارات الجزيئية تمتلئ مدارات π الرابطة والمضادة للترابط، لذلك فإن رتبة الرابطة في جزيء الفلور هي 1 = 2/(4-6)، كما يتّصف الجزيء بأنّ له مغناطيسية معاكسة.
الخواص الكيميائية
لذرّة الفلور تسعة إلكترونات، وهي بذلك أقلّ بإلكترون واحد من النيون، ويكون التوزيع الإلكتروني كما يلي: 1s22s22p5، بحيث يملأ إلكترونان الغلاف الداخلي وسبعة إلكترونات الغلاف الخارجي للذرّة، أي ينقصها إلكترون واحد لتكمل الغلاف الذرّي الخارجي. لا تساهم الإلكترونات الخارجية في عملية الحجب النووي، بشكل تكون فيه الشحنة النووية الفعالة 7 = 2 - 9؛ ممّا يؤثّر على خواص الذرّة بشكل عام.[4] إنّ طاقة التأيّن الأولى للفلور لها ثالث أعلى قيمة من بين كل العناصر، وذلك بعد الهيليوم والنيون،[80] ممّا يصعّب من مهمّة إزالة الإلكترونات من ذرّات الفلور المعتدلة. كما أنّ للفلور ألفة إلكترونية عالية، وهي الثانية بعد الكلور،[81] ممّا يجعلها تميل إلى التقاط إلكترون من أجل أن تصبح متساوية إلكترونيّاً مع الغاز النبيل المجاور، وهو النيون،.[4] لذلك يمكن تفسير أنّ الفلور أكثر عناصر الجدول الدوري كهرسلبية على الإطلاق.[82] يبلغ نصف القطر التساهمي للفلور حوالي 60 بيكومتر، وله أصغر قيمة بين عناصر الدورة الثانية.[83][84]
التفاعلية
إنّ طاقة الرابطة في جزيء الفلور F2 هي أقلّ بكثير من نظيراتها في الكلور Cl2 أو Br2، وهي مماثلة من حيث الوهن لرابطة البيروكسيد سهلة الفصم. على ضوء ذلك، وبإلاضافة إلى الكهرسلبية المرتفعة لهذا العنصر، يمكن تفسير التفاعلية العالية للفلور وارتباطه الشديد بالعناصر المغايرة للفلور.[85][86] لذلك فإنّ الفلور ينتمي إلى أقوى المؤكسدات الفعّالة عند درجة حرارة الغرفة، إذ يمكن أن يتفاعل مع أغلب المواد، حتى الخامل منها مثل مسحوق الفولاذ، أو شظايا الزجاج أو ألياف الأسبست والتي تتفاعل بسرعة مع غاز الفلور على البارد؛ أمّا الخشب والماء فيشتعلان فوراً عند تعرّضهما إلى تيّار من غاز الفلور.[3][87] تؤثّر الشروط المحيطة على تفاعل الفلور مع الماء، فعند تمرير كمّيّات ضئيلة من الفلور في الماء البارد يتشكّل بيروكسيد الهيدروجين (الماء الأكسجيني) وحمض الهيدروفلوريك:[88]
بالمقابل فإنّه عند تفاعل كمّيّات فائضة من الفلور مع كمّيّات أقلّ من الماء، أو الجليد أو الهيدروكسيدات يتشكّل الأكسجين وثنائي فلوريد الأكسجين كمنتجات رئيسية.[88]
يستطيع الفلور أن يتفاعل مع جميع العناصر الكيميائية عدا الهيليوم والنيون، ممّا يعني أنّه يستطيع التفاعل مع الغازات النبيلة الأثقل، فيتفاعل الفلور مع الرادون بسهولة،[89] في حبن أنّ تفاعله مع الزينون والكريبتون يتطلب وجود شروط خاصّة.[90] يتطلّب تفاعل عنصر الفلور مع الفلزّات شروطاً متفاوتة، فالفلزّات القلوية تسبّب الانفجارات، في حين أنّ الفلزّات القلوية الترابية تبدي فعالية كيميائية عنيفة في حال وجود كمّيات منها؛ وعلى العموم من أجل تجنّب حالة التخميل الناتجة عن تشكّل طبقات من فلوريدات الفلزات، ينبغي أن تكون الفلزّات المتبقية مثل الألومنيوم والحديد على شكل مساحيق؛[85] في حين أنّ الفلزّات النبيلة تتطلّب وجود غاز الفلور بحالة نقيّة عند درجات حرارة تتراوح بين 300 - 450 °س لتشكل الفلوريدات الموافقة.[91]
تتفاعل بعض اللافلزات الصلبة مثل الكبريت والفوسفور بعنف مع الفلور المسيّل،[92] كما يتفاعل كبريتيد الهيدروجين [92] وثنائي أكسيد الكبريت [93] بشكل فوري مع الفلور، أمّا حمض الكبريتيك فيتطلّب تفاعله مع الفلور درجات حرارة مرتفعة.[94] يتفاعل أسود الكربون مع الفلور عند درجة حرارة الغرفة ليعطي فلورو الميثان، أمّا الغرافيت فيعطي مع غاز الفلور عند درجات حرارة أعلى 400 °س مركّب غير ستوكيومتري من أحادي فلوريد الكربون، أمّا عند درجات حرارة أعلى من ذلك فتتشكّل مركّبات فلوروكربون الغازية، أحياناً بشكل انفجاري.[95] يتفاعل كلّ من أحادي أكسيد الكربون وثنائي أكسيد الكربون مع الفلور عند درجة حرارة الغرفة أو أعلى بقليل،[96] في حين أنّ المركّبات العضوية مثل البرافينات وغيرها تتفاعل بعنف وشدّة أكبر،[97] بحيث أنّه حتّى مركّبات هاليد الألكيل كاملة الاستبدال مثل رباعي كلوريد الكربون يمكن لها أن تنفجر، والتي هي عادةً ما تكون غير قابلة للاشتعال.[98] بشكل عنيف وانفجاري يتفاعل غاز الهيدروجين مع الفلور،[99] ليشكل فلوريد الهيدروجين؛ بالمقابل فإنّ غاز النتروجين يتطلّب وجود تفريغ كهربائي عند درجات حرارة مرتفعة لحدوث التفاعل، ويعود ذلك إلى الرابطة الثلاثية القويّة في جزيء النتروجين،[100] أمّا الأمونياك فيتفاعل بشكل انفجاري.[101][102] لا يرتبط الأكسجين مع الفلور عند درجات حرارة معتدلة، ولا يحدث التفاعل إلاّ بشروط قاسية بوجود تفريغ كهربائي عند درجات حرارة وضغوط منخفضة، ليعطي منتجات غير مستقرّة، والتي سرعان ما تتفكّك إلى عناصرها المكوّنة عند التسخين.[103][104][105] أمّا الهالوجينات الأثقل من الفلور فتتفاعل بشكل فوري معه.[106]
المركّبات الكيميائية
للفلور كيمياء غنية وطيف واسع من المركّبات الكيميائية سواء اللاعضوية أو العضوية منها. يستطيع الفلور تشكيل مركّبات مع جميع العناصر عدا الهيليوم والنيون، وذلك سواء أكانت فلزّات أو لافلزّات أو أشباه الفلزّات.[107] تكون حالة الأكسدة للفلور (−1) في أغلب هذه المركّبات، والتي غالباً ما تكون مركّبات أيونية بسبب الألفة الإلكترونية المرتفعة للفلور. عندما يشكّل الفلور روابط تساهمية فإنّها تكون مستقطبة وأحادية.[108][109]

مع الهيدروجين
يتحدّ الفلور مع الهيدروجين ليعطي فلوريد الهيدروجين، وهو غاز سام أكّال، تترابط جزيئاته مع بعضها على شكل تجمّعات عنقودية بسبب وجود الروابط الهيدروجينية بين الجزيئات، ممّا يجعل فلوريد الهيدروجين بهذه النقطة أشبه بالماء من كلوريد الهيدروجين.[110][111][112] ينتمي فلويد الهيدروجين المسيّل والخالي من الماء إلى الأحماض الفائقة. يغلي فلوريد الهيدروجين عند درجة حرارة أعلى من هاليدات الهيدروجين الأثقل منه، وعلى العكس منها فإنّه يمتزج مع الماء بشكل كامل.[113] عند التماس مع الماء يتميّه فلوريد الهيدروجين ليشكّل فلوريد الهيدروجين المائي المعروف باسم حمض الهيدروفلوريك. على العكس من باقي الأحماض الهيدروهاليدية والتي هي أحماض قوية، فإنّ حمض الهيدروفلوريك هو حمض ضعيف عند تراكيز منخفضة،[114][115] إلّا أنّه مع ذلك مادّة أكّالة تخرّش الزجاج، وهي ظاهرة لا تستطيع الأحماض المتبقيّة أن تفعله.[116] يعدّ فلوريد الهيدروجين المركّب الكيميائي الأساسي للفلور، والذي منه يتم استحصال الفلور العنصري بالإضافة إلى باقي المركّبات الأخرى.
مع الفلزّات
تعدّ الفلوريدات أملاح حمض الهيدروفلوريك، وهي تتشكّل من أثره على الفلزّات المختلفة. تكون فلوريدات الفلزّات القلوية مركّبات أيونية بلّورية ذات انحلالية عالية ولها نظام بلّوري مكعّب مشابه للكلوريدات الموافقة.[117][118] تتميّز فلوريدات الفلزّات القلوية الترابية أنّها مركّبات أيونية قوية، لكنّها غير منحلة (ذوّابة) في الماء،[24] باستثناء فلوريد البيريليوم، والذي له بعض الصفات التساهمية وبنية مشابهة لبنية ثنائي أكسيد السيليكون.[119] تكون فلوريدات الفلزّات القلوية حاوية على ذرّة فلور واحدة (أحادية الفلور)، في حبن أنّ فلوريدات الفلزّات القلوية الترابية ثنائية الفلور. أمّا فلوريدات العناصر الأرضية النادرة وباقي الفلزّات الأخرى فهي غالباً ما تكون فلوريدات أيونية ثلاثية (حاوية على ثلاث ذرّات فلور).[120][121][122]
تظهر الصفة التساهمية في الفلوريدات غالباً عندما تكون على شكل فلوريدات رباعية؛ ففي حين أنّ فلوريدات عناصر مثل الزركونيوم والهافنيوم،[123][124] والعديد من الأكتينيدات،[125] هي فلوريدات أيونية ذات نقطة انصهار مرتفعة،[126][127][124][128] إلّا أنّه بالمقابل تكون فلوريدات عناصر مثل التيتانيوم،[129] والفاناديوم،[130] ذات صفة بوليميرية،[131] تنصهر أو تتفكّك عند درجات حرارة أقل من 350 °س.[132] وعلى هذه الشاكلة تكون أيضاً الفلوريدات الخماسية والتي تتميّز بكونها على شكل بوليمرات خطّية أو معقّدات قليلة الوحدات.[133][134][135] هناك ستّة عشر عنصراً لهم فلوريدات سداسية، وجميعها لها بنية جزيئية ثمانية السطوح، وتكون صلبة ما عدا سداسي فلوريد الموليبدنوم MoF6 وسداسي فلوريد الرينيوم ReF6 السائلَين، بالإضافة إلى سداسي فلوريد التنغستن WF6 الغازي.[136][137][138] هناك فلوريد سباعي واحد فقط اكتشف لحد الآن وهو سباعي فلوريد الرينيوم ReF7، وهو عبارة عن صلب له نقطة انصهار منخفضة وله بنية جزيئية هرمية مزدوجة خماسية السطوح.[139] على العموم تتميّز الفلوريدات الحاوية على أكثر من ذرّة فلور بأنّها نشيطة كيميائياً.[140]
| بنى مختلفة لفلوريدات الفلزات | ||
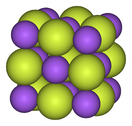 | 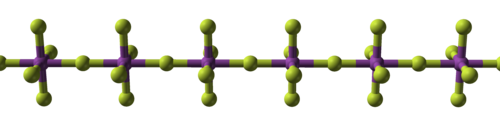 |  |
| البنية المكعّبة للمركب الأيوني فلوريد الصوديوم | سلسلة بوليميرية من خماسي فلوريد البزموت | البنية الجزيئية لسباعي فلوريد الرينيوم |
مع اللافلزّات وأشباه الفلزّات
تكون الفلوريدات الثنائية لأشباه الفلزّات واللافلزّات عبارة عن مركّبات تساهمية وذات تطايرية عالية، وتفاعلية كيميائية متفاوتة. تستطيع عناصر الدورة الثالثة واللافلزّات الثقيلة أن تشكّل فلوريدات مفرطة في التكافؤ.[141] لمركّب ثلاثي فلوريد البورون بنية مستوية ثلاثية، ولا تحقّق فيه ذرة البورون المركزية قاعدة الثمانية الإلكترونية، لذلك فإنّه يعدّ من أحماض لويس القادرة على الاتحاد مع قاعدة لويس مثل الأمونياك ليشكّل ناتج إضافة.[142] من جهة أخرى، يكون رباعي فلورو الميثان على شكل رباعي سطوح وخامل كيميائياً، في حين أنّ باقي فلوريدات مجموعة الكربون مثل رباعي فلوريد السيليكون ورباعي فلوريد الجرمانيوم تكون أيضاً ذات بنية رباعية السطوح،[143] لكنّها تتصرّف كأحماض لويس.[144][145] أمّا مجموعة النتروجين فلها فلوريدات ثلاثية تتزايد تفاعليتها الكيميائية وقاعديتها مع ارتفاع الكتلة الجزيئية، مع العلم أنّ ثلاثي فلوريد النتروجين يقاوم الحلمهة وليس قاعدياً.[146] تكون الفلوريدات الخماسية لكلّ من عناصر الفوسفور والزرنيخ والأنتيموان أكثر نشاطاً كيميائياً من نظيراتها الثلاثية، وخاصّة خماسي فلوريد الأنتيموان، والذي يعدّ أقوى أحماض لويس المعتدلة المعروفة.[133][147][148]
لمجموعة عناصر الكالكوجين فلوريدات متنوّعة، فهناك فلوريدات ثنائية غير مستقرّة لكلّ من الأكسجين والكبريت والسيلينيوم، بالإضافة إلى الفلوريدات الرباعية والسداسية للكبريت والسيلينيوم والتيلوريوم. لمركّب سداسي فلوريد الكبريت ثباتية كبيرة وهو غاز خامل.[149][150] على العكس من باقي الهالوجينات الأثقل فإنّه يوجد حمض أكسجيني واحد فقط للفلور، وهو حمض هيبوفلوروز HOF. تستطيع عناصر الهالوجينات الأخرى من الكلور والبروم واليود أن تشكّل فلوريدات أحادية وثلاثية وخماسية، ووحده اليود يكون قادراً على تشكيل مركّب بين هالوجيني مع الفلور أعلى من ذلك، وهو سباعي فلوريد اليود.[151] إنّ الكثير من هذه الفلوريدات المذكورة هي مصدر غني لذرّات الفلور في التفاعلات الكيميائية، مع الإشارة إلى أنّ العمليّات الصناعية التي تستخدم ثلاثي فلوريد الكلور تتطلّب أخذ الحيطة والوقاية كما هو الحال مع غاز الفلور.[152][153]

مع الغازات النبيلة
للغازات النبيلة عددٌ مكتمل من الإلكترونات في الغلاف الخارجي، بالتالي فهي لا تتفاعل مع باقي العناصر ولا تشكّل مركّبات كيميائية. بقيت هذه المعلومة صحيحة على الإطلاق إلى سنة 1962 عندما قام نيل بارتلت بتحضير سداسي فلوروبلاتينات الزينون لأوّل مرة سنة 1962.[155] تلا ذلك تحضير سلسلة من فلوريدات الغازات النبيلة مثل ثنائي فلوريد ورباعي فلوريد وسداسي فلوريد الزينون، بالإضافة إلى العديد من أوكسي الفلوريدات المتعدّدة والتي عزلت منذئذ.[156] يستطيع غاز الكريبتون أن يشكّل مركّب ثنائي فلوريد؛[157] وكذلك الأمر بالنسبة لغاز الرادون الذي يشكّل ثنائي فلوريد أيضاً.[158][159] تكون الفلوريدات الثنائية للغازات النبيلة الأخفّ غير مستقرّة للغاية، إذ يتّحد فلوريد الهيدروجين مع الأرغون تحت شروط قاسية جدّاً ليعطي فلوروهيدريد الأرغون.[90] بالمقابل، لا يمكن تشكيل مركّبات فلوريد من الهيليوم أو النيون.[160][161]
كيمياء الفلور العضوية
إنّ الرابطة الكيميائية فلور-كربون هي الأقوى بين الروابط في الكيمياء العضوية،[162] ممّا يعطي ثباتية فائقة لمركّبات فلوروكربون العضوية.[163] لا توجد مركّبات فلور عضوية في الطبيعة، وهي تصطنع كيميائياً فقط، حيث أدّت الأبحاث في هذا المجال إلى العديد من التطبيقات التجارية؛[164] كما تتداخل مركّبات الفلور العضوية المتنوّعة في العديد من مجالات أبحاث الكيمياء العضوية.[30]

يؤدّي استبدال ذرّات الهيدروجين في الألكانات بذرّات فلور إلى تغيّر في العديد من خواصّها، ويزداد هذا التغيّر مع ازدياد عدد ذرّات الفلور المستبدلة، إذ تنخفض نقطتي الانصهار والغليان، وتزداد الكثافة، وتتناقص الانحلالية في المذيبات الهيدروكربونية، وتزداد الثباتية بشكل عام. تدعى المركّبات العضوية الحاوية على ذرّات كربون وفلور فقط في البنية الجزيئية باسم مركبات فلوروكربون (والتي تسمى أحياناً بيرفلوروكربون)، وهي مركّبات غير منحلّة (ذوّابة) في أغلب المذيبات العضوية، وتتفاعل فقط مع الصوديوم في الأمونياك السائل.[165] يمكن لذرّات الفلور أن تستبدل الهيدروجين في العديد من المركّبات العضوية الأخرى غير الألكانات وذلك بوجود مجموعات وظيفية.[166][167] يكون لهذه المركّبات الفلورية العضوية صفات مشابهة لمركّبات الفلوروكربون مثل الثباتية والدفوعية للماء،[168] في حين أنّ المجموعة الوظيفية في البنية تكون مسؤولة عن التفاعلية، ممّا يمكّنها من الالتصاق بالسطوح واستخدامها كمؤثّرات سطحية (مواد فعّالة بالسطح)،[169] والتي تدعى مؤثّرات السطح الفلورية، والتي تعمل على تخفيض التوتّر السطحي بشكل أكبر من نظيراتها ذات الأساس الهيدروكربوني.
يستحصل عادةً على أيونات الفلوريد في الكيمياء العضوية باستخدام مركب فلوريد رباعي بوتيل الأمونيوم (TBAF)، والذي يتميّز بأنّه ينحلّ في المذيبات العضوية، وبذلك يكون أيون الفلوريد حرّاً وغير معاقاً بالكاتيون المرافق (حينئذ يوصف باسم الفلوريد المجرّد)، ممّا يسمح باستخدام TBAF كمصدر للفلوريد في التفاعلات العضوية، كما يستخدم في إزالة مجموعة حماية سيليل الإيثر عن الكحولات.[170]
- البوليميرات
تبدي البوليميرات الحاوية على ذرّات فلور مستبدلة في بنيتها ثباتيّة عالية بالإضافة إلى نقاط انصهار أعلى من نظيراتها الهيدروكربونية.[172] يعد متعدد رباعي فلورو الإيثيلين (PTFE) أبسط البوليميرات الفلورية وهو مناظر لبوليمير متعدد الإيثيلين (بولي إيثين) الهيدروكربوني، وله الوحدة البنائية –CF2–، وهو مقاوم للكيماويات ودرجات الحرارة، كما أنّه صعب القولبة.[173] هناك عدّة مشتقّات من PTFE ذات ثباتية أقل للحرارة وبالتالي هي سهلة القولبة، وتحضّر من إضافة مجموعات فلورية مثل مجموعات ثلاثي فلوروميثيل أو ثلاثي فلوروميثوكسي،[173] أو بإضافة مجموعة من فلور الإيثر منتهية بمجموعات حمض السلفونيك كما هو الحال في بنية نافيون.[174][175] هناك بعض البوليميرات الفلورية التي تستبقي على ذرّات هيدروجين في بنيتها مثل ثنائي فلوريد متعدد الفينيليدين (PVDF) وفلوريد متعدد الفاينيل (PVF)، والتي تشابه في خواصها البوليميرات الفلورية كاملة الاستبدال.[176]
الكشف عن الفلوريد
هناك عدّة تفاعلات كيميائية للكشف عن أيونات الفلوريد: إحداها يتم بوضع المادة الحاوية على الفلوريد في أنبوب اختبار زجاجي حاوٍ على حمض الكبريتيك المركّز:
ينتج عن التفاعل أبخرة فلوريد الهيدروجين، والتي تخرّش الزجاج، وفي نفس الوقت وبسبب التغيّر في السطح الملامس يفقد حمض الكبريتيك المقدرة على ترطيب الزجاج، وذلك دلالة على وجود الفلوريد في العيّنة.[177]

1-برومو-5،4،3-ثلاثي فلورو البنزين.
يمكن الكشف عن أيونات الفلوريد بطريقة أخرى تدعى قطرة الماء، حيث تعالج المادّة الحاوية على الفلوريد مع حمض السيليسيك وحمض الكبريتيك في وعاء مصنوع من الرصاص، فينتج عن ذلك تشكّل رباعي فلوريد السيليكون. بعد ذلك يوضع على الإناء الذي أجري فيه التفاعل ماصّة حاوية على قطرة من الماء، والتي يؤدّي تفاعل رياعي فلوريد السيليكون معها في تفاعل حلمهة إلى تشكّل ثنائي أكسيد السيليكون، الذي يتبلور بشكل مميّز على شكل إطار أبيض حول القطرة.[177]
حالياً وباستخدام وسائل تحليلية حديثة مثل مطيافية الرنين المغناطيسي النووي (NMR) يمكن الكشف عن الفلور بواسطة 19F NMR بسهولة، إذ يتميّز بأنه عنصر أحادي النويدة.
الدور الحيوي
في الإنسان
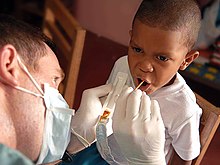
لا يعد الفلور من المغذّيات الأساسية للإنسان وللثديّيات الأخرى، إذ تكفي كمّيّات ضئيلة من أجل قوّة العظام، على الرغم من الشكوك التي تحوم حول تلك النقطة.[178] تؤدّي حاجة الجسم الضئيلة من الفلور وتوفّر العديد من المصادر الطبيعية للفلور إلى قلّة احتمال الإصابة بمرض عوز الفلور، ولا يمكن أن تقع إلا لمن يتّبع حمية غذائية غير طبيعية المصدر.[179][180] يوجد في جسم إنسان (70 كغ وسطياً) حوالي 5 غ من أيون الفلوريد،[181] وهو غير متجانس التوزيع، إذ يتركّز في العظام والأسنان.يقي الفلوريد من تسوس الأسنان، كما يعمل على تقسية مينا الأسنان، حيث تتمّ هذه العملية وفق الأبحاث من خلال إقحام الفلوريد بدل أيونات الهيدروكسيد في هيدروكسيل أباتيت ليتشكّل فلورأباتيت، والذي يتميّز بضعف انحلاليته، بالتالي يكون ثابتاً تجاه اللعاب، فيلعب دوراً في تدعيم الأسنان، وخاصّة أنّ الأباتيت المنحلّ سيترسّب مرّة أخرى بوجود الفلور؛ إلّا أنّ بعض الأبحاث الأخرى دحضت هذه النظرية؛ ولكن مع التأكيد على دور الفلوريد في دعم نمو المينا.[182] بالإضافة إلى ذلك فإنّ الفلوريد يلعب دوراً حاجباً لنوعية معيّنة من الإنزيمات، ممّا يسهم في إعاقة تحلل السكر الذي تسهم فيه أنواع البكتريا.[183] يمكن الحصول على الفلوريد من مصادر طبيعية عادةً إمّا عن طريق ماء الشرب (في بعض البلدان) أو من مصادر غذائية.
بالمقابل فإنّه عندما يتعرّض الأطفال في مرحلة نمو الأسنان إلى كمّيّات فائضة من الفلوريد يمكن حدوث حالة من تسمم الأسنان بالفلور. في هذه الإصابة تظهر نقط أو بقع ملوّنة على سطح الأسنان، كما يصبح السنّ أكثر هشاشةً وأقلّ مقاومة. يتفاوت الحدّ الأعظمي من الفلوريد الموصى به للإنسان يومياً حسب العمر؛ فبالنسبة للرضّع إلى عمر ستة أشهر يبلغ 0.7 مغ؛ ومن 7-17 شهر 0.9 مغ؛ وللأطفال حتى عمر 3 سنوات 1.3 مغ؛ أمّا الأطفال من أربع إلى ثمان سنوات فيكون الحد الأعظمي لهم هو 2.2 مغ؛ وبعد تمام نمو الأسنان تكون حاجة الإنسان الأعظمية من الفلوريد 10 مغ في اليوم.[184]

تعمد بعض الدول إلى إضافة أيون الفلوريد إلى ماء الشرب من أجل مكافحة تسوّس الأسنان،[185] كما هو الحال في الأمريكيتين،[186][187] بالمقابل فإنّ ألمانيا لا تسمح بفلورة الماء، أمّا في سويسرا فكانت مدينة بازل سنة 2000 آخر مدينة هناك تقوم بإضافة الفلوريد إلى مياه الشرب.[188] لا يوجد تأكيدات إلى الآن حول ضرورة إضافة الفلوريد إلى ماء الشرب، ولا يزال محطّ خلاف بين جهات داعمة ورافضة للفكرة. فالجهات الداعمة تشير إلى أن فلورة الماء ساهمت في تقليص نخر الأسنان عند الأطفال،[189][190] وأن الأثر السلبي الظاهر هو تسمم الأسنان بالفلور،[191] إلّا أنّ أطراف أخرى تعارض الفكرة من دوافع مادّية كالسلامة وأخرى معنوية أخلاقية.[187][192] خاصّة أنّ الفائدة من فلورة الماء تقلّصت مع انتشار مستحضرات العناية بالأسنان من معاجين وغسول فم ورغوات تنظيف حاوية على مصدر فلوري مثل أحادي فلوروفوسفات الصوديوم في تركيبها.[190][193]
في الكائنات الأخرى
عثر على آثار من الفلور العضوي الطبيعي في بعض النباتات،[47] ولكن ليس في الحيوانات.[194] أكثر مركّبات الفلور العضوية الطبيعية انتشاراً هو فلوروأسيتات الصوديوم، والذي يستخدم كأسلوب دفاع ضد العواشب من قبل ما لا يقل عن 40 نبتة في أفريقيا وأستراليا والبرازيل.[195] تشكّل الأحماض الدهنية ذات النهايات المفلورة، ومركّبات مثل فلورو أسيتون و 2-فلورو سيترات نماذج أخرى عن مركبات فلور عضوية طبيعية.[194] كما عثر على إنزيم مهمته ربط الفلور بالكربون - أدينوسيل-فلوريد سينثاز- وذلك في أحد أنواع البكتريا سنة 2002.[196]
الأثر البيئي
تتميّز مركّبات الفلور العضوية بأنّها مقاومة للتحلّل الحيوي بسبب قوّة الرابطة الكيميائية بين الكربون والفلور، لذلك تعدّ مركبات الفلوروكربون المختلفة، مثل أحماض بيرفلوروالألكيل (PFAAs) ذات الانحلالية الضئيلة في الماء بسبب المجموعات الوظيفية الحمضية، من الملوّثات المستدامة للبيئة.[198] على هذا الأساس شرعت الأبحاث باستقصاء المركّبات العضوية الفلورية المختلفة مثل حمض بيرفلوروأوكتان السلفونيك (PFOS) وحمض بيرفلورو الأوكتانويك (PFOA).[199][200][201] أفادت دراسة أجريت سنة 2013 بوجود علاقة بين مستويات PFAA في المياه الجوفية والتربة والنشاط البشري، كما وجدت علاقة بين المستويات المرتفعة لكل من PFOS و PFOA في تلك الدراسة.[199][200][202] ترتبط مركبات PFAAs في جسم الإنسان بالبروتينات مثل الألبومين في المصل، وتتركز في الكبد والدم قبل أن تطرح عبر الكلى خارج الجسم، ولكن مدّة المكث تتفاوت حسب الأجسام، ويمكن أن تصل إلى سنوات عند البشر.[199][200][203] يؤدّي التعرّض إلى مستويات مرتفعة من PFOS و PFOA إلى السرطان وحدوث وفيات عند فئران التجارب الوليدة حديثاً، ولا تزال الأبحاث مستمرّة لمعرفة المستويات الحرجة بالنسبة للبشر، خاصّة أن مستويات التعرّض الحالية لم تُبدِ أثراً لحد الآن.[199][200][203]

وضعت اتفاقية مونتريال الموقّعة سنة 1987 ضوابط صارمة تجاه استخدام مركبات كلوروفلوروكربون (CFCs) نظراً لأثرها المخرّب الذي يسبّب نضوب الأوزون. تعدّ هذه المركّبات ثابتة ومقاومة للتحلّل حتّى تصل إلى ارتفاعات عالية في طبقات الجوّ، ثمّ تتفكّك حينها لتعطي جذور حرة من ذرّات الكلور والتي تهاجم جزيئات الأوزون.[205] تشير بعض الآراء إلى أنّه حتّى بعد الحظر سيتطلّب الأمر عدّة أجيال حتى تعود طبقة الأوزون إلى الوضع السابق قبل التلوّث الحاصل بسبب مركّبات كلوروفلوروكربون،[206][207] التي تستخدم مركبات هيدروكلوروفلوروكربون كبديل عنها حالياً(HCFCs)،[208] والتي بدورها ستستبدل مستقبلاً (2030–2040) بشكل كامل بمركّبات هيدروفلوروكربون (HFCs) الخالية من الكلور وعديمة الضرر بالنسبة للأوزون.[209] بالمقابل فإنّ غازات فلوروكربون هي غازات دفيئة ذات احتمالية حدوث احترار عالمي (GWPs) تتراوح بين 100 و 10,000، مع العلم أنّ سداسي فلوريد الكبريت له قيمة GWP حوالي 20,000.[210] من هذه المركّبات 3،3،3،2-رباعي فلورو البروبين (HFO-1234yf)، والذي له قيمة GWP تبلغ 4 بالمقارنة مع 1430 لمركّب 2،1،1،1-رباعي فلورو الإيثان (HFC-134a)، وهي مادّة قياسية لمواد التثليج حاليّاً.[211]
الاستخدامات
تقوم عملية التعويم الزبدي بفصل الفلوريت الجاري تعدينه بنسبة متساوية تقريباً إلى صنفين رئيسيين لهما درجات تعدينية متفاوتة: الأول يدعى ميتسبار metspar وهو ذو نقاوة تتراوح بين 60-85 %، ويستخدم تقريباً بالكامل في صهر الحديد وإنتاج الصلب؛ أمّا الثاني فهو أسيدبار acidspar والذي له نقاوة تزيد عن 97%، والذي يحوّل بشكل رئيسي إلى فلوريد الهيدروجين كمركّب وسطي صناعي.

التطبيقات الصناعية
ينتج ما لا يقل عن 17000 طن متري من الفلور سنوياً، وهو يكلّف 5-8 دولار أمريكي لكل كيلوغرام عند إنتاجه على شكل سداسي فلوريد اليورانيوم أو الكبريت، ولكن السعر يتضاعف عند الحصول عليه بشكل عنصري نظراً للتحدّيات المرافقة أثناء التعامل معه نظراً لنشاطه الكيميائي الكبير، والكثير من العمليّات التي تتطلّب وجود الفلور العنصري تقوم بتوليده في الموقع حسب مبدأ التكامل الرأسي.[212]
غاز الفلور

إنّ التطبيق الأساسي لغاز الفلور هو استخدامه من أجل تحضير سداسي فلوريد اليورانيوم UF6 المستخدم في دورة الوقود النووي، باستهلاك يصل إلى 7000 طن سنوياً. يستخدم الفلور العنصري في فلورة رباعي فلوريد اليورانيوم UF4، والذي يستحصل بدوره من ثنائي أكسيد اليورانيوم UO2 وحمض هيدروفلوريك.[212] بما أنّ الفلور عنصر أحادي النظير، بالتالي أيّ فرق في الكتلة بين جزيئات UF6 الغازية هو نتيجة لوجود 235U أو 238U؛ ممّا يمكّن من تخصيب اليورانيوم عن طريق الانتشار الغازي أو باستخدام طاردة مركزية غازية.[3][44] يستهلك حوالي 6000 طن متري سنوياً من غاز الفلور في إنتاج سداسي فلوريد الكبريت SF6 الخامل والعازل كهربائياً والمستخدم في المحوّلات عالية الجهد وفي قواطع التيار، ممّا يجنّب الحاجة إلى مركبات ثنائي الفينيل متعدد الكلور الخطرة والتي يترافق تطبيقها مع وجود أجهزة مليئة بالوقود.[213] تستخدم النسبة المتبقية من غاز الفلور في إنتاج بعض الفلوريدات العضوية التي لها تطبيقات مختلفة، ولكنّ تمنع الفعالية العالية له دون استخدامه بشكل مباشر، لذلك يحوّل في البداية إلى مركّبات بين هالوجينية مثل ClF3 أو BrF3 أو IF5، أمّا المستحضرات الصيدلانية الفلورية فيستخدم فيها رباعي فلوريد الكبريت كبديل.[44]
الفلوريدات اللاعضوية
تستخدم أملاح الفلوريد بشكل أساسي في صهر المعادن وصناعة الصلب والفولاذ، حيث يضاف حوالي 3 كغ من ميتسبار إلى كلّ طن متري من الفولاذ (الصلب)، حيث تعمل أيونات الفلوريد على تخفيض نقطة الانصهار واللزوجة.[44][214] كما يلعب الفلور دوراً آخر في هذه الصناعة، إذ يؤخذ الشكل النقي وهو أسيدبار ويفاعل مع حمض الكبريتيك لتحضير حمض هيدروفلوريك، والذي يستخدم من أجل المعالجة الحمضية لتنظيف سطوح الفولاذ، كما يستخدم هذا الحمض أيضاً من أجل تنميش الزجاج وله استخدام في عمليات تكسير الألكانات.[44] يستهلك حوالي الثلث من فلوريد الهيدروجين في تحضير مركبي الكريوليت وثلاثي فلوريد الألومنيوم واللذان يستخدمان كصهيرة في عملية هول-هيرو لاستخراج الألومنيوم، والتي يحتاج فيها لإنتاج طن واحد من الألومنيوم إلى حوالي 23 كغ من تلك المواد.[44][215] يستخدم فلوريد الهيدروجين أيضاً من أجل تحضير أملاح فلوروسيليكات، مثل سداسي فلوروسيليكات الصوديوم Na2SiF6، والمستخدم في فلورة المياه، وكذلك كمركّب وسطي أثناء تحضير الكريوليت ورباعي فلوريد السيليكون.[216]
من الفلوريدات اللاعضوية المهمّة أيضاً التي لها تطبيقات صناعية كل من فلوريدات الكوبالت والنيكل والأمونيوم.[44][118][217] كذلك الأمر بالنسبة لفلوريدات الرينيوم والتنغستن التي تستخدم في الترسيب الكيميائي للبخار؛[218] وثلاثي فلوريد النتروجين المستخدم في تنظيف الأجهزة.[44]
مركبات الفلور العضوية
تستهلك الفلوريدات العضوية أكثر من 20% من خامة الفلوريت وأكثر من 40% من حمض هيدروفلوريك حيث يذهب الاستهلاك الأكبر على مواد التثليج، بالإضافة إلى الطلب المتزايد من البوليميرات الفلورية.[44][219] تعدّ المواد الفعّالة بالسطح الفلورية من المنتجات الثانوية لصناعة الفلور الكيمائية، إلّا أنّها تعطي ما مقداره بليون دولار أمريكي كعائدات سنوية.[220] هناك استخدامات أخرى متفرّقة، إذ يستخدم رباعي فلورو الميثان في التنميش بواسطة البلازما،[221][222] أمّا بيرفلورو البوتان C4F10 فيستخدم كمادّة في إطفاء الحرائق.[223]
نظراً للخطر المرافق لتفاعلات فلور-هيدروكربون المباشرة فوق -150 °س، فإنّ إنتاج مركّبات فلوروكربون الصناعية يتمّ بشكل غير مباشر عن طريق تفاعلات تبادل هالوجينية، أو باستخدام الفلورة الكهروكيميائية، التي تخضع فيها الهيدروكربونات إلى التحليل الكهربائي في فلوريد الهيدروجين، ومن ثمّ المعالجة عن طريق عملية فاولر بمادّة فلورية صلبة مثل فلوريد الكوبالت الثلاثي.[30][224]
- مواد التثليج
تدعى مواد التثليج الهالوجينية باسم فريونات، وهي تميّز بحرف R يوضع بعده أرقام تشير إلى عدد ذرّات الفلور والكلور والكربون والهيدروجين الموجودة في البنية.[44][225] كانت مركبات كلوروفلوروكربون (CFCs) مثل ثلاثي كلورو فلورو الميثان (R-11) وثنائي كلورو ثنائي فلورو الميثان (R-12) و 2،1-ثنائي كلورو رباعي فلورو الإيثان (R-114) مسيطرة على صناعة الفلور الكيميائية للطلب الكبير عليها في صناعة البرّادات وأجهزة التكييف وكمواد ترذيذ، وبلغت هذه الصناعة ذروتها في ثمانينات القرن العشرين، قبل أن تضمحلّ بسبب الحظر العالمي المطبّق بعد اتفاقية مونتريال.[44] كبديل أكثر أماناً يستخدم حالياً مركبات هيدروكلوروفلوروكربون (HCFCs) وهيدروفلوروكربون (HFCs)، والتي يتطلّب اصطناعها استهلاك حوالي 90% من الفلور في الصناعات الكيميائية العضوية. من مركبات HCFCs المهمّة مركب كلورو ثنائي فلورو الميثان (R-22) و 1،1-ثنائي كلورو-1-فلورو الإيثان (R-141b). أما بالنسبة لمركّبات HFC فأشهرها 2،1،1،1-رباعي فلورو الإيثان (R-134a)،[44] بالإضافة إلى 3،3،3،2-رباعي فلورو البروبين (HFO-1234yf) الذي له خواص بيئية جيّدة نسبياً.[211]
- البوليميرات

أنتج حوالي 180 ألف طن متري من البوليميرات الفلورية بين عامي 2006 و 2007، والتي جلبت عائدات فاقت 3.5 بليون دولار سنوياً.[226] قُدّرت عائدات السوق العالمي بحوالي 6 بليون دولار سنة 2011، ويتوقّع لها أن تنمو بنسبة 6.5% سنوياً حتى سنة 2016.[227]
لا يمكن الحصول على البوليميرات الفلورية إلّا عن طريق بلمرة الجذور الحرة.[172] يمثّل متعدد رباعي فلورو الإيثيلين (PTFE)، أو كما يعرف بالاسم التجاري تيفلون Teflon التابع لشركة دوبونت،[228] ما قيمته حوالي 60–80% وزناً من الإنتاج العالمي للبوليميرات الفلورية.[226] إن أكبر تطبيق للتيفلون هو في العزل الكهربائي، كما يستخدم كمادة تبطين خاملة في الصناعات الكيميائية عندما يتطلّب الأمر مقاومة للتآكل وذلك للمفاعلات أو تمديدات الأنابيب. من التطبيقات الأخرى استخدامه كطبقة مانعة للالتصاق في أواني الطبخ،[228] وكمادّة دافعة للماء في أقمشة غور-تكس Gore-Tex المستخدمة في صناعة الواقيات المطرية ومعدات الوقاية الشخصية، بالإضافة إلى تطبيقات ميكانيكية أخرى.[228] أجريت تحويرات عديدة على هذا البوليمير بحيث أصبح من الممكن الحصول على ميّزات جديدة، فمثلاً استخدمت طبقتين رقيقتين من اثنين من البوليميرات الفلورية محل الزجاج في بعض الخلايا الشمسية.[228][229]
تستخدم الوحدات الأيونية (أيونومير) المفلورة والثابتة كيميائياً في صناعة أغشية الخلايا الكهركيميائية وأشهرها مادة النافيون Nafion، والتي طوّرت في ستّينات القرن العشرين، واستعملت بادئ الأمر في صناعة خلايا الوقود في المركّبات الفضائية، ومن ثم حلّت محلّ خلايا عملية الكلور القلوي ذات الأساس المبني على الزئبق. تدخل مركّبات الفلور العضوية أيضاً في صناعة المطاط الاصطناعي والبوليميرات المرنة مثل منتجات Viton، والتي هي مزيج من بوليميرات فلورية متشابكة تستخدم في صناعة الحلقات المستديرة.[228]
- معالجة السطوح
المواد الفلورية الفعّالة بالسطح هي مواد عضوية فلورية صغيرة ذات فدرة على دفع الماء والبقع، ومن أشهر من سوّقها شركة ثري إم الأمريكية باسم المنتج Scotchgard، والذي حقّق مبيعات فاقت 300 مليون دولار سنة 2000.[220][230][231] بالإضافة إلى ذلك، يمكن معالجة سطوح اللدائن بالفلور ممّا يعطيها طاقة سطح أعلى، وخصوصاً بالنسبة اللدائن المدعّمة بألياف والتي يعطيها تماسكاً أكبر، ويقلّل من الاحتكاك؛ كما تزيد فلورة السطوح من الانتقائية في تقنية الأغشية.[232]
- الكيماويات الزراعية
إنّ حوالي 30% من الكيماويات الزراعية تحوي على عنصر الفلور في تركيبها،[233] وأغلبها مبيدات للأعشاب وللفطريات، مع وجود قلّة من الهرمونات النباتية. إنّ إقحام مجموعات الفلور العضوية في هذه الكيماويات يؤدّي إلى إطالة مدة المكث الحيوي، كما أنّها تتميّز بقدرتها على اختراق الأغشية وعلى تغيير التعرّف الجزيئي.[234] من الأمثلة الشهيرة عليها مستحضر تريفلورالين المبيد للأعشاب الضارّة،[234][235] والذي ينتشر استخدامه في الولايات المتّحدة، ولكنّه محظور في عدّة دول أوروبية، إذ يشكّ بأنّه مادّة مسرطنة.[236] يعدّ فلوروأسيتات الصوديوم (1080) مادّة سامّة للثدييات، حيث يعمل على الإخلال باستقلاب الخلايا بدخوله محلّ الأسيتات في دورة حمض الستريك. اصطنع هذا المركب لأوّل مرّة في أواخر القرن التاسع عشر، واستخدم كمبيد حشري في أوائل القرن العشرين، لكنّه ممنوع من الاستخدام في كل من الولايات المتّحدة وأوروبا،.[195][237] وتعد نيوزيلندا أكبر مستهلك حالي لهذه المادّة، إذ تستخدمه لحماية طيور الكيوي من حيوانات بوسوم كث الذيل الأسترالية.[238]
التطبيقات الطبية
العقاقير الصيدلانية
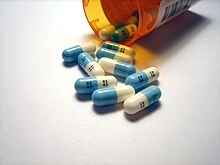
يقدّر تقريباً أنّ حوالي 20% من الأدوية الصيدلانية الحديثة تحوي الفلور في تركيبها.[239] يتم فلورة العقاقير من أجل تأخير تثبيطها ومن أجل تطويل مدّة الجرعات ما أمكن، حيث أنّ رابطة كربون-فلور قويّة جدّاً ومستقرّة.[240] تزيد عملية الفلورة أيضاً من جعل العقار محبّاً للدهن، لأنّ الرابطة كارهة للماء بشكل أكبر من الرابطة بين الكربون والهيدروجين، ممّا يساعد في اختراق غشاء الخلية، وبالتالي يصبح التوافر الحيوي ممكناً.[241]
من الأمثلة على هذه الأدوية عقار أتورفاستاتين المخفّض للكوليسترول، والذي حقّق مبيعه عائدات كبيرة قبل أن تنتهي حقوق ملكية اصطناعه ويصبح بالإمكان إنتاج أدوية مكافئة له؛[242] ومن الأمثلة الأخرى أيضاً عقار فلوتيكازون،[241] وكذلك عقار فلوكسيتين المستخدم كمضاد اكتئاب والذي تميّز بخلوّه من الآثار الجانبية التي كانت تسبّبها أدوية مضادات الاكتئاب ثلاثية الحلقات في السابق. في الوقت الراهن هناك عدّة عقاقير فلورية مضادّة للاكتئاب بما فيها مثبطات استرداد السيروتونين الانتقائية: سيتالوبرام ومصاوغه إسيتالوبرام وفلوفوكسامين وباروكسيتين.[243][244] تعدّ مركّبات الكينولون من المضادّات الحيوية واسعة الطيف، والتي غالباً ما يتمّ فلورتها من أجل تحسين أثرها، ومن أمثلتها سيبروفلوكساسين وليفوفلوكساسين.[245][246][247][248]
للفلور أيضاً وجوده في الستيرويدات:[249] فعقار فلودروكورتيزون عبارة عن مينيرالوكورتيكويد رافع لضغط الدم، وتريامسينولون وديكساميتازون عبارة عن ستيرويدات غلوكوكورتيكويد.[250] إنّ أغلب المواد المخدّرة المستنشقة طبّياً تكون مفلورة بشكل كبير، ومن أمثلتها هالوثان، بالإضافة إلى الإيثرات المفلورة مثل سيفوفلوران وديسفلوران، والتي هي أفضل من الهالوثان، وهي تقريباً غير منحلّة في الدمّ، ممّا يتيح فترة إيقاظ أسرع.[251][252]
التصوير المقطعي PET

يستخدم الفلور-18 في تركيب مواد الاقتفاء المشعة من أجل التصوير المقطعي بالإصدار البوزيتروني PET، إذ أنّ عمر النصف لهذا النظير يبلغ حوالي ساعتين، وهي مدّة كافية لإجراء عملية التصوير وتحضيراتها.[253] أشهر مواد الاقتفاء المشعة الفلورية هو مركب فلوروديوكسي غلوكوز،[253] والذي يعطى عبر حقنة وريدية، حيث يمتصّ من أعضاء الجسم وأنسجته المتطلّبة للسكر مثل الدماغ والخلايا في مكان وجود الأورام الخبيثة؛[254] وبعد الكشف يمكن بعد ذلك استعمال التصوير المقطعي المحوسب من أجل تصوير أكثر دقّة وتفصيلاً.[255]
حمل الأكسجين
يمكن لمركّبات فلوروكربون السائلة أن تحمل كمّيّات كبيرة من الأكسجين أو ثنائي أكسيد الكربون بشكل أكبر من الدم، ولفتت هذه الخاصّية الانتباه إلى إمكانية استخدام نظرية في تنفس السائل.[256] بما أنّ مركّبات فلوروكريون لا تمتزج مع الماء، فينبغي لذلك إضافة مستحلبات لاستخدامها كبديل للدمّ.[257][258] كمثال على هذه المواد الحاملة للأكسجين مركّب Oxycyte،[259] إلّا أنّ هذه المواد محظورة الاستخدام في الأنشطة الرياضية إذ تعدّ ضمن المنشطات الممنوعة، وقد جرى تحقيق سنة 1998 على أحد الدرّاجين الذي قارب الوفاة بسبب تعاطي مثل هذه المواد غير المشروعة.[260][261]
من التطبيقات للمواد الفلورية حاملة الأكسجين استخدامها في الحالات الطارئة لمساعدة المصابين بحروق شديدة ولمساعدة الأطفال الخدّج الذين يعانون من مشاكل في التنفّس بسبب عجز الرئتين عن أداء وظيفتها،[262] إلاّ أنّ مثل هذه المواد لم يصل بعد إلى مرحلة التجارب السريرية لأنّ النتائج لم تكن أفضل من وسائل العلاج العادية.[263]
المخاطر
إنّ الفلور العنصري عالي السمّية بالنسبة للكائنات الحيّة، ويبدأ تأثيره على الإنسان من تراكيز أدنى من تأثير سيانيد الهيدروجين وتقدّر بحدود 50 جزء في المليون (ppm)،[264] وهو قريب من التراكيز المؤثّرة لغاز الكلور السامّ أيضاً.[265] تحدث تهيّجات خطيرة للعينين وللجهاز التنفّسي بالإضافة إلى أضرار في الكبد والكليتين عند تراكيز أعلى من 25 جزء في المليون (ppm)، والتي تعدّ قيمة تركيز الفلور ذات الخطورة الفورية للحياة أو الصحة (IDLH).[266][267] تتأذّى العينان والأنف بشكل كبير عند تراكيز تصل إلى 100 ppm، أمّا استنشاق غاز الفلور عند تركيز 1000 ppm فسوف يسبب الموت خلال دقائق معدودة،[268] وذلك بالمقارنة مع 270 ppm لسيانيد الهيدروجين.[269]

يؤدّي التماس مع حمض هيدروفلوريك HF إلى حروق كيميائية شديدة، وذلك بشكل أكبر من الأحماض القويّة مثل حمض الكبريتيك على الرغم من ضعفه، حيث يبقى معتدلاً في المحاليل المائية، وبالتالي يخترق الأنسجة بشكل أسرع، سواء عبر الاستنشاق أو الابتلاع أو التماس عبر الجلد، حيث يتفاعل مع المغنسيوم أو الكالسيوم في الدم مسبّباً حدوث نقص كالسيوم الدم ووفاة محتملة بسبب اضطراب النظم القلبي.[271] يؤدّي تشكّل فلوريد الكالسيوم غير المنحل إلى آلام مبرّحة،[272] ويمكن أن تسبّب الحروق الأكبر من 160 سم2 سمّيّة خطيرة للأعضاء.[273] بالإضافة إلى ذلك، يستطيع HF أن يشكّل روابط هيدروجينية قويّة، وبالتالي بإمكانه تغيير البنية الرابعية للبروتينات.[274] في حال تعرّض الجلد إلى HF فإنّه يمكن تخفيف الضرر بشطفه بتيّار من الماء لمدة 10-15 دقيقة وبالتخلّص من الملابس الملوّثة.[275] يمكن إضافة غلوكونات الكالسيوم بعد ذلك من أجل توفير أيونات الكالسيوم كي يتاح لها الارتباط مع الفلوريد، وذلك على شكل جل 2.5% أو محاليل معالجة خاصّة.[276][277][278] في أسوأ الأحوال قد يتطلّب الأمر بتر العضو المصاب.[273][279]
تعدّ الفلوريدات المنحلة متوسّطة السمّية، إذ يتراوح المجال بين 32-64 مغ أيون فلوريد لكل كيلوغرام من كتلة الجسم، وهي تمثّل الجرعة القاتلة بالنسبة للبالغين.[280] إنّ مقدار الخُمس من هذه الجرعة القاتلة يمكن أن يسبب العديد من الآثار السلبية على صحة الجسم،[281] كما أنّ التعرّض المزمن لجرعات زائدة يمكن أن يؤدّي إلى حدوث حالة تسمم هيكلي بالفلور، والتي تصيب عدداً كبيراً من الأشخاص في آسيا وأفريقيا.[281][282] توضع حدود التعرّض للفلوريد بإجراء فحص للبول وذلك لمعرفة قدرة الجسم على التخلّص من أيونات الفلوريد.[281][283] إنّ أغلب حالات التسمم بالفلوريد المسجلّة تاريخياً كانت بسبب الابتلاع غير المقصود للمبيدات الحشرية الحاوية على فلوريدات غير عضوية.[284] وقد سجّلت بعض الحوادث المتفرقة بسبب ابتلاع معاجين الأسنان الحاوية على الفلوريد،[281] أو بسبب عطل فني في أجهزة فلورة المياه مثلما حدث في ألاسكا، والذي أودى بحياة شخص وأصاب 300 آخرين.[285] تنصح مراكز مكافحة الأمراض واتقائها الأمريكية بمصاحبة الأطفال دون السادسة أثناء تنظيفهم لأسنانهم كي لا يبتلعوا معاجين الأسنان.[286] وقد سجّلت دراسة محلّية في الولايات المتحدة حدوث 87 حالة تسمّم بالفلوريد على مدار سنة كاملة، معظمها دون أعراض، و30% منها كانت مترافقة بآلام في المعدة.[284] وقد بيّنت دراسة شملت كامل الولايات أنّ 80% من الحالات كانت لأطفال دون السادسة، ولم يكن هناك إلا بضعة حالات خطيرة فقط.[287]
المراجع
المصادر مرتبة أبجدياً
- Agricola، Georgius؛ Hoover، Herbert Clark؛ Hoover، Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Air Products and Chemicals (2004). "Safetygram #39 Chlorine Trifluoride" (PDF). Air Products and Chemicals. مؤرشف من الأصل (PDF) في 2006-03-18. اطلع عليه بتاريخ 2014-02-16.
- Alavi، Abbas؛ Huang، Steve S. (2007). "Positron Emission Tomography in Medicine: An Overview". في Hayat، M. A. (المحرر). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. ص. 39–44. ISBN:978-0-12-370468-9.
- Ampère, André-Marie (1816). "Suite d'une classification naturelle pour les corps simples". Annales de chimie et de physique (بالفرنسية). 2: 1–5. Archived from the original on 2023-03-04.
- . PMID:18067684. مؤرشف من الأصل في 2016-01-27.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Asimov، Isaac (1966). The Noble Gases. New York: Basic Books. ISBN:978-0-465-05129-8.
- Atkins، Peter؛ Jones، Loretta (2007). Chemical Principles: The Quest for Insight (ط. 4th). New York: W. H. Freeman. ISBN:978-1-4292-0965-6.
- Aucamp، Pieter J.؛ Björn، Lars Olof (2010). "Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update" (PDF). United Nations Environmental Programme. مؤرشف من الأصل (PDF) في 2017-08-30. اطلع عليه بتاريخ 2013-10-14.
- Augenstein، W. L.؛ وآخرون (1991). "Fluoride Ingestion in Children: A Review of 87 cases". Pediatrics. ج. 88 ع. 5: 907–912. PMID:1945630. مؤرشف من الأصل في 2010-10-02.
- Babel، Dietrich؛ Tressaud، Alain (1985). "Crystal Chemistry of Fluorides". في Hagenmuller، Paul (المحرر). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. ص. 78–203. ISBN:978-0-12-412490-5.
- Baelum، Vibeke؛ Sheiham، Aubrey؛ Burt، Brian (2008). "Caries Control for Populations". في Fejerskov، Ole؛ Kidd، Edwina (المحررون). Dental Caries: The Disease and Its Clinical Management (ط. 2nd). Oxford: Blackwell Munksgaard. ص. 505–526. ISBN:978-1-4051-3889-5.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Baez, Ramon J.؛ Baez, Martha X.؛ Marthaler, Thomas M. (2000). "Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community". Revista Panamericana de Salud Pública. ج. 7 ع. 4: 242–248. DOI:10.1590/S1020-49892000000400005.
- Banks، R. E. (1986). "Journal of Fluorine Chemistry". Journal of Fluorine Chemistry. ج. 33 ع. 1–4: 3–26. DOI:10.1016/S0022-1139(00)85269-0.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: ref duplicates default (link) - Barbee، K.؛ McCormack، K.؛ Vartanian، V. (2000). "EHS Concerns with Ozonated Water Spray Processing". في Mendicino، L. (المحرر). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. ص. 108–121. ISBN:978-1-56677-230-3.
- Barry، Patrick L.؛ Phillips، Tony (26 مايو 2006). "Good News and a Puzzle". National Aeronautics and Space Administration. مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2012-01-06.
- Beasley، Michael (أغسطس 2002). "Guidelines for the safe use of sodium fluoroacetate (1080)" (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN:0-477-03664-3. مؤرشف من الأصل (PDF) في 2013-11-11. اطلع عليه بتاريخ 2013-11-11.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - Beck، Jefferson؛ Newman، Paul؛ Schindler، Trent L.؛ Perkins، Lori (2011). "What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?". National Aeronautics and Space Administration. مؤرشف من الأصل في 2020-08-04. اطلع عليه بتاريخ 2013-10-15.
- Bégué، Jean-Pierre؛ Bonnet-Delpon، Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN:978-0-470-27830-7.
- . PMID:17520044.
- Biller، José (2007). Interface of Neurology and Internal Medicine (ط. illustrated). Philadelphia: Lippincott Williams & Wilkins. ISBN:0-7817-7906-5. مؤرشف من الأصل في 2020-08-01.
- Blodgett، D. W.؛ Suruda، A. J.؛ Crouch، B. I. (2001). "Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S" (PDF). American Journal of Industrial Medicine. ج. 40 ع. 2: 215–220. DOI:10.1002/ajim.1090. PMID:11494350. مؤرشف من الأصل (PDF) في 2015-03-06.
- Bombourg، Nicolas (4 يوليو 2012). "World Fluorochemicals Market, Freedonia". Reporterlinker. مؤرشف من الأصل في 2020-04-23. اطلع عليه بتاريخ 2013-10-20.
- Brantley، L. R. (1949). Squires، Roy؛ Clarke، Arthur C. (المحررون). "Fluorine". Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. ج. 3 ع. 1: 11–18. ISBN:978-0-9794418-5-1.
- Brody، Jane E. (10 سبتمبر 2012). "Popular Antibiotics May Carry Serious Side Effects". The New York Times Well Blog. مؤرشف من الأصل في 2020-08-06. اطلع عليه بتاريخ 2013-10-18.
- Brown، Paul L.؛ Mompean، Federico J.؛ Perrone، Jane؛ Illemassène، Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN:978-0-444-51803-3.
- . Annual Review of Physical Chemistry. ج. 51: 275–296. Bibcode:2000ARPC...51..275B. DOI:10.1146/annurev.physchem.51.1.275. PMID:11031283.[وصلة مكسورة]
- Burney، H. (1999). "Past, Present and Future of the Chlor-Alkali Industry". في Burney، H. S.؛ Furuya، N.؛ Hine، F.؛ Ota، K.-I. (المحررون). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. ص. 105–126. ISBN:1-56677-244-3.
- . PMID:198801.
- . Space Science Review. ج. 15: 121–146. Bibcode:1973SSRv...15..121C. DOI:10.1007/BF00172440. مؤرشف من الأصل (PDF) في 2011-10-21.
- Carey، Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN:978-1-85109-998-6.
- Centers for Disease Control and Prevention (2001). "Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States". MMWR Recommendations and Reports. ج. 50 ع. RR–14: 1–42. PMID:11521913. مؤرشف من الأصل في 2020-07-24. اطلع عليه بتاريخ 2013-10-14.
- Centers for Disease for Control and Prevention (10 يوليو 2013). "Community Water Fluoridation". مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2013-10-25.
- Chambers، C.؛ Holliday، A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN:978-0-408-70663-6. مؤرشف من الأصل (PDF) في 2015-12-27.
- Chang، Raymond؛ Goldsby، Kenneth A. (2013). Chemistry (ط. 11th). New York: McGraw-Hill. ISBN:978-0-07-131787-0.
- . BMJ. ج. 335 ع. 7622: 699–702. DOI:10.1136/bmj.39318.562951.BE. PMC:2001050. PMID:17916854. مؤرشف من الأصل (PDF) في 2019-12-09.
- Chisté، V.؛ Bé، M. M. (2011). "F-18". في Bé, M. M.؛ Coursol, N.؛ Duchemin, B.؛ Lagoutine, F.؛ وآخرون (المحررون). Table de radionucléides (PDF) (Report). CEA (Commissariat à l'énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l'Energie Atomique). مؤرشف من الأصل (PDF) في 2020-08-11. اطلع عليه بتاريخ 2011-06-15.
{{استشهاد بتقرير}}: صيانة الاستشهاد: ref duplicates default (link) - Christe، Karl O. (1986). "Chemical Synthesis of Elemental Fluorine". Inorganic Chemistry. ج. 25 ع. 21: 3721–3722. DOI:10.1021/ic00241a001.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: ref duplicates default (link) - Christe Research Group (n.d.). "Chemical Synthesis of Elemental Fluorine:". مؤرشف من الأصل في 2018-08-25. اطلع عليه بتاريخ 2013-01-12.
- Clark، Jim (2002). "The Acidity of the Hydrogen Halides". chemguide.co.uk. مؤرشف من الأصل في 2020-08-05. اطلع عليه بتاريخ 2013-10-15.
- Clayton، Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN:978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (ط. 4th). Boston: Kluwer Academic Publishers. ISBN:978-0-412-78230-5.
- Cordero، B.؛ Gómez، V.؛ Platero-Prats، A. E.؛ Revés، M.؛ Echeverría، J.؛ Cremades، E.؛ Barragán، F.؛ Alvarez، S. (2008). "Covalent Radii Revisited". Dalton Transactions ع. 21: 2832–2838. DOI:10.1039/b801115j.
- Cracher، Connie M. (2012). "Current Concepts in Preventive Dentistry" (PDF). dentalcare.com. مؤرشف من الأصل (PDF) في 2016-08-10. اطلع عليه بتاريخ 2013-10-14.
- Croswell، Ken (سبتمبر 2003). "Fluorine: An element–ary Mystery". Sky and Telescope. مؤرشف من الأصل في 2016-03-04. اطلع عليه بتاريخ 2013-10-17.
- Davis، Nicole. "Better than blood". Popular Science ع. November 2006. مؤرشف من الأصل في 2011-06-04. اطلع عليه بتاريخ 2013-10-20.
- Davy، Humphry (1813). "Some experiments and observations on the substances produced in different chemical processes on fluor spar". Philosophical Transactions of the Royal Society. ج. 103: 263–279. DOI:10.1098/rstl.1813.0034.
- Dean، John A. (1999). Lange's Handbook of Chemistry (ط. 15th). New York: McGraw-Hill. ISBN:0-07-016190-9.
- Directorate-General for the Environment (European Commission) (2007). dossier_proposal for submission to the UNECE POP Protocol.pdf Trifluralin (PDF) (Report). European Commission. مؤرشف من الأصل (PDF) في 2020-07-28. اطلع عليه بتاريخ 2013-10-14.
{{استشهاد بتقرير}}: تحقق من قيمة|مسار أرشيف=(مساعدة) - DuPont (2013a). "Freon". مؤرشف من الأصل في 2015-02-21. اطلع عليه بتاريخ 2013-10-17.
- DuPont (2013b). "Understanding the Refrigerant 'R' Nomenclature". مؤرشف من الأصل في 2015-06-10. اطلع عليه بتاريخ 2013-10-17.
- Eaton، Charles (1997). "Figure hfl". E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). مؤرشف من الأصل في 2020-07-25. اطلع عليه بتاريخ 2013-09-28.
- Edwards، Philip Neil (1994). "Use of Fluorine in Chemotherapy". في Banks، R. E.؛ Smart، B. E.؛ Tatlow، J. C. (المحررون). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. ص. 501–542. ISBN:978-0-306-44610-8.
- Einstein، F. W. B.؛ Rao، P. R.؛ Trotter، J.؛ Bartlett، N. (1967). "The Crystal Structure of Gold Trifluoride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical. ج. 4: 478–482. DOI:10.1039/J19670000478.
- Eisler، Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Report). Patuxent Environmental Science Center (U.S. National Biological Service). مؤرشف من الأصل (PDF) في 2020-03-07. اطلع عليه بتاريخ 2011-06-05.
- Ellis، Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN:978-0-521-80094-5.
- El-Kareh، Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN:978-0-7923-9534-8.
- El Saadi، M. S.؛ Hall، A. H.؛ Hall، P. K.؛ Riggs، B. S.؛ Augenstein، W. L.؛ Rumack، B. H. (1989). "Hydrofluoric Acid Dermal Exposure". Veterinary and Human Toxicology. ج. 31 ع. 3: 243–247. PMID:2741315.
- Emeléus، H. J.؛ Sharpe، A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. New York: Academic Press. ج. 16. ISBN:978-0-08-057865-1.
- Emeléus، H. J.؛ Sharpe، A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. Academic Press. ج. 27. ISBN:0-12-023627-3.
- Emsley، John (1981). "The Hidden Strength of Hydrogen". New Scientist. ج. 91 ع. 1264: 291–292. مؤرشف من الأصل في 2020-08-01.
- Emsley، John (2011). Nature's Building Blocks: An A–Z Guide to the Elements (ط. 2nd). Oxford: Oxford University Press. ISBN:978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Report). مؤرشف من الأصل (PDF) في 2020-04-18. اطلع عليه بتاريخ 2013-10-15.
- . Future Medicinal Chemistry. ج. 1 ع. 5: 777–791. DOI:10.4155/fmc.09.65. PMID:21426080. مؤرشف من الأصل (PDF) في 2013-10-22.
- Fischman، Michael L. (2001). "Semiconductor Manufacturing Hazards". في Sullivan، John B.؛ Krieger، Gary R. (المحررون). Clinical Environmental Health and Toxic Exposures (ط. 2nd). Philadelphia: Lippincott Williams & Wilkins. ص. 431–465. ISBN:978-0-683-08027-8.
- Forster، P.؛ Ramaswamy، V؛ Artaxo، P.؛ Berntsen، T.؛ Betts، R.؛ Fahey، D. W.؛ Haywood، J.؛ Lean، J.؛ Lowe، D. C.؛ Myhre، G.؛ Nganga، J.؛ Prinn، R.؛ Raga، G.؛ Schulz، M.؛ Van Dorland، R. (2007). "Changes in Atmospheric Constituents and in Radiative Forcing". في Solomon، S.؛ Manning، M؛ Chen، Z.؛ Marquis، M؛ Averyt، K. B.؛ Tignor، M.؛ Miller، H. L. (المحررون). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. ص. 129–234. ISBN:978-0-521-70596-7.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Fulton، Robert B.؛ Miller، M. Michael (2006). "Fluorspar". في Kogel، Jessica Elzea؛ Trivedi، Nikhil C.؛ Barker، James M.؛ Krukowski، Stanley T. (المحررون). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). ص. 461–473. ISBN:978-0-87335-233-8.
- Gains، Paul (18 أكتوبر 1998). "A New Threat in Blood Doping". The New York Times. مؤرشف من الأصل في 2020-07-27. اطلع عليه بتاريخ 2013-10-18.
- Giesy، J.P.؛ Kannan، K. (2002). "Perfluorochemical Surfactants in the Environment". Environmental Science & Technology. ج. 36 ع. 7: 146A–152A. DOI:10.1021/es022253t. PMID:11999053.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: ref duplicates default (link) - Godfrey، S. M.؛ McAuliffe، C. A.؛ Mackie، A. G.؛ Pritchard، R. G. (1998). "Inorganic Derivatives of the Elements". في Norman، Nicholas C. (المحرر). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. ص. 67–158. ISBN:978-0-7514-0389-3.
- Green، S. W.؛ Slinn، D. S. L.؛ Simpson، R. N. F.؛ Woytek، A. J. (1994). "Perfluorocarbon Fluids". في Banks، R. E.؛ Smart، B. E.؛ Tatlow، J. C. (المحررون). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. ص. 89–119. ISBN:978-0-306-44610-8.
- Greenwood، N. N.؛ Earnshaw، A. (1998). Chemistry of the Elements (ط. 2nd). Oxford: Butterworth Heinemann. ISBN:0-7506-3365-4.
- Gribble، G. W. (2002). "Naturally Occurring Organofluorines". في Neison، A. H. (المحرر). Organofluorines. The Handbook of Environmental Chemistry. Berlin: Springer. ج. 3N. ص. 121–136. DOI:10.1007/10721878_5. ISBN:3-540-42064-9.
- Grot، Walter (2011). Fluorinated Ionomers (ط. 2nd). Oxford and Waltham: Elsevier. ISBN:978-1-4377-4457-6.
- Hasegawa، Y.؛ Otani، R.؛ Yonezawa، S.؛ Takashima، M. (2007). "Reaction Between Carbon Dioxide and Elementary Fluorine". Journal of Fluorine Chemistry. ج. 128 ع. 1: 17–28. DOI:10.1016/j.jfluchem.2006.09.002.
- Haxel، G. B.؛ Hedrick، J. B.؛ Orris، G. J. (2005). Stauffer، P. H.؛ Hendley II، J. W. (المحررون). Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Report). U.S. Geological Survey. مؤرشف من الأصل في 2020-07-19. اطلع عليه بتاريخ 2014-01-31.
- Haynes، William M.، المحرر (2011). Handbook of Chemistry and Physics (ط. 92nd). Boca Raton: CRC Press. ISBN:1-4398-5511-0.
{{استشهاد بكتاب}}: صيانة الاستشهاد: ref duplicates default (link) - Hoffman، Robert؛ Nelson، Lewis؛ Howland، Mary؛ Lewin، Neal؛ Flomenbaum، Neal؛ Goldfrank، Lewis (2007). Goldfrank's Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN:978-0-07-144310-4.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. مؤرشف من الأصل (PDF) في 2016-03-04. اطلع عليه بتاريخ 2014-01-09.
- Hoogers، G. (2002). "Fuel Cell Components and Their Impact on Performance". في Hoogers، G. (المحرر). Fuel Cell Technology Handbook. Boca Raton: CRC Press. ص. 4–1–4–27. ISBN:0-8493-0877-1.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - Hounshell، David A.؛ Smith، John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN:0-521-32767-9.
- ICIS (2 أكتوبر 2006). "Fluorine's Treasure Trove". Reed Business Information. مؤرشف من الأصل في 2016-06-04. اطلع عليه بتاريخ 2013-10-24.
- Johnson، Linda A. (28 ديسمبر 2011). "Against Odds, Lipitor Became World's Top Seller". The Boston Globe. مؤرشف من الأصل في 2016-03-04. اطلع عليه بتاريخ 2013-10-24.
- Katakuse، Itsuo؛ Ichihara، Toshio؛ Ito، Hiroyuki؛ Sakurai، Tohru؛ Matsuo، Takekiyo (1999). "SIMS Experiment". في Arai، T؛ Mihama، K؛ Yamamoto، K؛ Sugano، S (المحررون). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. ص. 259–273. ISBN:4-06-208635-2.
- Kelly، T. D.؛ Miller، M. M. (2005). "Historical Fluorspar Statistics". U.S. Geological Service. مؤرشف من الأصل في 2013-05-22. اطلع عليه بتاريخ 2014-02-10.
- King، D. E.؛ Malone، R.؛ Lilley، S. H. (2000). "New Classification and Update on the Quinolone Antibiotics". American Family Physician. ج. 61 ع. 9: 2741–2748. PMID:10821154. مؤرشف من الأصل في 2020-08-06. اطلع عليه بتاريخ 2013-10-08.
- Kirsch، Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN:978-3-527-30691-6.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Kissa، Erik (2001). Fluorinated Surfactants and Repellents (ط. 2nd). New York: Marcel Dekker. ISBN:978-0-8247-0472-8.
- Lagow، R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (PhD thesis, Rice University, TX). Ann Arbor: UMI. مؤرشف من الأصل (PDF) في 2020-07-26.
- . Toxicological Sciences. ج. 99 ع. 2: 366–394. DOI:10.1093/toxsci/kfm128. PMID:17519394. مؤرشف من الأصل (PDF) في 2016-04-07.
- Lewars، Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN:1-4020-6972-3. مؤرشف من الأصل في 2023-01-23.
- Lide، David R. (2004). Handbook of Chemistry and Physics (ط. 84th). Boca Raton: CRC Press. ISBN:0-8493-0566-7.
- Lidin, R.; Molochko, V.A.; Andreeva, L.L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (بالروسية). Moscow: Khimiya. ISBN:5-7245-1163-0.
- Liteplo، R.؛ Gomes، R.؛ Howe، P.؛ Malcolm، H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. ISBN:92-4-157227-2. مؤرشف من الأصل في 2020-01-12. اطلع عليه بتاريخ 2013-10-14.
- Lusty، P. A. J.؛ Brown، T. J.؛ Ward، J.؛ Bloomfield، S. (2008). "The Need for Indigenous Fluorspar Production in England". British Geological Survey. مؤرشف من الأصل في 2016-08-07. اطلع عليه بتاريخ 2013-10-13.
- Mackay، Kenneth Malcolm؛ Mackay، Rosemary Ann؛ Henderson، W. (2002). Introduction to Modern Inorganic Chemistry (ط. 6th). Cheltenham: Nelson Thornes. ISBN:0-7487-6420-8.
- Macomber، Roger (1996). Organic chemistry. Sausalito: University Science Books. ج. 1. ISBN:978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). "Observation concernant une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides" [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres (بالفرنسية). XXIV: 3–11. Archived from the original on 2020-08-01.
- Martin، John W.، المحرر (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN:978-0-08-045127-5.
- Marya، C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN:978-93-5025-216-1.
- Matsui، M (2006). "Fluorine-containing Dyes". في Kim، Sung-Hoon (المحرر). Functional dyes. Orlando: Academic Press. ص. 257–266. ISBN:978-0-12-412490-5.
- Meusinger، Reinhard؛ Chippendale، A. Margaret؛ Fairhurst، Shirley A. (2012). "Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy". في Ullmann، Franz (المحرر). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ج. 24. ص. 609–660. DOI:10.1002/14356007.b05_471.
{{استشهاد بكتاب}}: صيانة الاستشهاد: ref duplicates default (link) - Meyer، Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN:978-0-13-129239-0.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Miller، M. Michael (2003a). "Fluorspar" (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. ص. 27.1–27.12.
- Miller، M. Michael (2003b). "Mineral Resource of the Month, Fluorspar" (PDF). U.S. Geological Survey. مؤرشف من الأصل (PDF) في 2017-02-17. اطلع عليه بتاريخ 2013-10-24.
- Mitchell، E. Siobhan (2004). Antidepressants. New York: Chelsea House Publishers. ISBN:978-1-4381-0192-7.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Moeller، T.؛ Bailar، J. C.؛ Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (ط. 3rd). New York: Academic Press. ISBN:0-12-503350-8.
- Moissan, Henri (1886). "Action d'un courant électrique sur l'acide fluorhydrique anhydre". Comptes rendus hebdomadaires des séances de l'Académie des sciences (بالفرنسية). 102: 1543–1544. Archived from the original on 2020-08-06. Retrieved 2013-10-09.
- Moore، John W.؛ Stanitski، Conrad L.؛ Jurs، Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN:978-0-495-39079-4.
- Müller، Peter (2009). "5.067 Crystal Structure Refinement" (PDF). Cambridge: MIT OpenCourseWare. مؤرشف من الأصل (PDF) في 2020-08-06. اطلع عليه بتاريخ 2013-10-13.
- Murthy، C. Parameshwara؛ Mehdi Ali، S. F.؛ Ashok، D. (1995). University Chemistry. New Delhi: New Age International. ج. I. ISBN:978-81-224-0742-6.
- National Health and Medical Research Council (2007). "A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results" (PDF). Canberra: Australian Government. ISBN:1-86496-421-9. مؤرشف من الأصل (PDF) في 2018-04-05. اطلع عليه بتاريخ 2013-10-08.
- The National Institute for Occupational Safety and Health (1994). "Fluorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2014-01-15.
- The National Institute for Occupational Safety and Health (1994). "Chlorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2014-07-13.
- National Nuclear Data Center. "NuDat 2.1 Database". Brookhaven National Laboratory. مؤرشف من الأصل في 2020-08-11. اطلع عليه بتاريخ 2013-10-25.
- National Oceanic and Atmospheric Administration. "UN/NA 1045 (United Nations/North America Fluorine Data Sheet)". مؤرشف من الأصل في 2020-08-07. اطلع عليه بتاريخ 2013-10-15.
- Nelson، Eugene W. (1947). "'Bad Man' of The Elements". Popular Mechanics. ج. 88 ع. 2: 106–108, 260. مؤرشف من الأصل في 2020-08-01.
- . Clinical Infectious Diseases. ج. 44 ع. 7: 977–980. DOI:10.1086/512369. PMID:17342653. مؤرشف من الأصل (PDF) في 2018-11-20.
- Norwood، Charles J.؛ Fohs، F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- . Inorganic Chemistry. ج. 41 ع. 8: 2164–2172. DOI:10.1021/ic011003v. PMID:11952370. مؤرشف من الأصل (PDF) في 2020-05-11. اطلع عليه بتاريخ 2012-05-23.
{{استشهاد بدورية محكمة}}: تحقق من قيمة|مسار أرشيف=(مساعدة) - Olivares، M.؛ Uauy، R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Report). World Health Organization (WHO). مؤرشف من الأصل (PDF) في 2016-06-04. اطلع عليه بتاريخ 2013-10-14.
- Parente، Luca (2001). "The Development of Synthetic Glucocorticoids". في Goulding، Nicolas J.؛ Flower، Rod J. (المحررون). Glucocorticoids. Basel: Birkhäuser. ص. 35–53. ISBN:978-3-7643-6059-7.
- Partington، J. R. (1923). "The early history of hydrofluoric acid". Memoirs and Proceedings of the Manchester Literary and Philosophical Society. ج. 67 ع. 6: 73–87.
- Patnaik، Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (ط. 3rd). Hoboken: John Wiley & Sons. ISBN:978-0-471-71458-3.
- Pauling، Linus (1960). The Nature of the Chemical Bond (ط. 3rd). Ithaca: Cornell University Press. ISBN:978-0-8014-0333-0.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Perry، Dale L. (2011). Handbook of Inorganic Compounds (ط. 2nd). Boca Raton: CRC Press. ISBN:978-1-4398-1461-1.
- Pitzer، Kenneth S.، المحرر (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN:978-981-02-1439-5.
- . Clinical Oral Investigations. ج. 11 ع. 3: 189–193. DOI:10.1007/s00784-007-0111-6. PMID:17333303. مؤرشف من الأصل (PDF) في 2020-07-24.
- Posner، Stefan (2011). "Perfluorinated Compounds: Occurrence and Uses in Products". في Knepper، Thomas P.؛ Large، Frank T. (المحررون). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. ص. 25–40. ISBN:978-3-642-21871-2.
- Posner, Stefan؛ وآخرون (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology. Copenhagen: Nordic Council of Ministers. DOI:10.6027/TN2013-542. ISBN:978-92-893-2562-2.
- Preskorn، Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN:978-1-884735-08-0.
- Principe، Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN:978-0-226-68295-2.
- PRWeb (28 أكتوبر 2010). "Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc". prweb.com. مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2013-10-24.
- PRWeb (23 فبراير 2012). "Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc". prweb.com. مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2013-10-24.
- PRWeb (7 أبريل 2013). "Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets". prweb.com. مؤرشف من الأصل في 2020-07-31. اطلع عليه بتاريخ 2013-10-24.
- Raghavan، P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN:978-81-7141-418-5.
- Raj، P. Prithvi؛ Erdine، Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN:978-0-470-67038-5.
- Ramkumar، Jayshree (2012). "Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications". في Banerjee، S.؛ Tyagi، A. K. (المحررون). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. ص. 549–578. ISBN:978-0-12-385142-0.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link)- Rhoades، David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor: ProQuest. ISBN:978-0-549-78540-8.
- Richter، M.؛ Hahn، O.؛ Fuchs، R. (2001). "Purple Fluorite: A Little Known Artists' Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe". Studies in Conservation. ج. 46 ع. 1: 1–13. DOI:10.1179/sic.2001.46.1.1. JSTOR:1506878.
- . Journal of Public Health Dentistry. ج. 53 ع. 1: 17–44. DOI:10.1111/j.1752-7325.1993.tb02666.x. PMID:8474047. مؤرشف من الأصل (PDF) في 2013-05-16.
{{استشهاد بدورية محكمة}}: تحقق من قيمة|مسار أرشيف=(مساعدة) - Salager، Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. مؤرشف من الأصل (PDF) في 2020-07-31. اطلع عليه بتاريخ 2013-10-13.
- Sandford، Graham (2000). "Organofluorine Chemistry". Philosophical Transactions. ج. 358 ع. 1766: 455–471. DOI:10.1098/rsta.2000.0541.
- . PMID:19742251.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Scheele, Carl Wilhelm (1771). "Undersŏkning om fluss-spat och dess syra" [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (بالسويدية). 32: 129–138. Archived from the original on 2020-08-01.
- Schimmeyer، S. (2002). "The Search for a Blood Substitute". Illumin. Columbia: University of Southern Carolina. ج. 15 ع. 1. مؤرشف من الأصل في 2011-10-02. اطلع عليه بتاريخ 2013-10-15.
- . Journal of Spinal Disorders. ج. 13 ع. 6: 541–544. DOI:10.1097/00002517-200012000-00016. PMID:11132989. مؤرشف من الأصل (PDF) في 2020-05-08. اطلع عليه بتاريخ 2013-10-08.
- Schulze-Makuch، D.؛ Irwin، L. N. (2008). Life in the Universe: Expectations and Constraints (ط. 2nd). Berlin: Springer-Verlag. ISBN:978-3-540-76816-6.
- Schwarcz، Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life. Toronto: ECW Press. ISBN:1-55022-621-5.
{{استشهاد بكتاب}}: صيانة الاستشهاد: ref duplicates default (link) صيانة الاستشهاد: التاريخ والسنة (link) - Senning، A. (2007). Elsevier's Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN:978-0-444-52239-9.
- Shin، Richard D.؛ Silverberg، Mark A. (2013). "Fluoride Toxicity". Medscape. مؤرشف من الأصل في 2020-08-06. اطلع عليه بتاريخ 2013-10-15.
- Shriver، Duward؛ Atkins، Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN:978-1-4292-5255-3.
- Slye، Orville M (2012). "Fire Extinguishing Agents". في Ullmann، Franz (المحرر). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ج. 15. ص. 1–11. DOI:10.1002/14356007.a11_113.pub2.
{{استشهاد بكتاب}}: صيانة الاستشهاد: ref duplicates default (link) - . PMID:20423814.
- Stillman، John Maxson (ديسمبر 1912). "Basil+Valentine",+hoax "Basil Valentine, A Seventeenth Century Hoax". Popular Science Monthly. ج. 81. مؤرشف من الأصل في 2016-11-16. اطلع عليه بتاريخ 2013-10-14.
- Storer، Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis. مؤرشف من الأصل في 2018-11-16.
- Struble، M. D.؛ Scerba، M. T.؛ Siegler، M.؛ Lectka، T. (2013). "Evidence for a Symmetrical Fluoronium Ion in Solution". Science. ج. 340 ع. 6128: 57–60. DOI:10.1126/science.1231247. PMID:23559245.
- Swinson، Joel (يونيو 2005). "Fluorine – A Vital Element in the Medicine Chest" (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. مؤرشف من الأصل (PDF) في 2016-03-04. اطلع عليه بتاريخ 2013-10-09.
- Taber، Andrew (22 أبريل 1999). "Dying to ride". Salon. مؤرشف من الأصل في 2018-11-06. اطلع عليه بتاريخ 2013-10-18.
- Tanner Industries (يناير 2011). "Anhydrous Ammonia: (MSDS) Material Safety Data Sheet". tannerind.com. مؤرشف من الأصل في 2020-08-06. اطلع عليه بتاريخ 2013-10-24.
- Theodoridis، George (2006). "Fluorine-Containing Agrochemicals: An Overview of Recent Developments". في Tressaud، Alain (المحرر). Fluorine and the Environment : Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. ص. 121–176. ISBN:978-0-444-52672-4.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - Toon، Richard (2011). "Fluorine, An Obsession with a Tragic Past". Education in Chemistry. ج. 48 ع. 5: 148–151. مؤرشف من الأصل (PDF) في 2020-08-13.
- Transparency Market Research (17 مايو 2013). "Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research". Transparency Market Research Blog. مؤرشف من الأصل في 2016-08-20. اطلع عليه بتاريخ 2013-10-15.
- Ullmann، Fritz (2008). Ullmann's Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN:978-3-527-31772-1.
- United States Environmental Protection Agency (1996). "R.E.D. Facts: Trifluralin" (PDF). مؤرشف من الأصل (PDF) في 2014-10-16. اطلع عليه بتاريخ 2013-10-17.
- United States Environmental Protection Agency (2012). "Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)" (PDF). مؤرشف من الأصل (PDF) في 2013-06-07. اطلع عليه بتاريخ 2013-11-04.
- United States Environmental Protection Agency (2013a). "Class I Ozone-depleting Substances". مؤرشف من الأصل في 2015-12-29. اطلع عليه بتاريخ 2013-10-15.
- United States Environmental Protection Agency (2013b). "Phaseout of HCFCs (Class II Ozone-Depleting Substances)". مؤرشف من الأصل في 2015-09-24. اطلع عليه بتاريخ 2013-10-15.
- Viel، Claude؛ Goldwhite، Harold (1993). "1906 Nobel Laureate: Henri Moissan, 1852–1907". في Laylin، K. James (المحرر). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. ص. 35–41. ISBN:978-0-8412-2690-6.
- Vigoureux، P. (1961). "The Gyromagnetic Ratio of the Proton". Contemporary Physics. ج. 2 ع. 5: 360–366. DOI:10.1080/00107516108205282.
- Walsh، Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN:978-0-87170-721-5.
- Walter، P. (2013). "Honeywell Invests $300m in Green Refrigerant". Chemistry World. مؤرشف من الأصل في 2016-03-04.
- . PMID:21729289.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - Wiberg، Egon؛ Wiberg، Nils؛ Holleman، Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN:978-0-12-352651-9.
- Willey، Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN:978-0-615-14397-2.
- Yaws، Carl L.؛ Braker، William (2001). "Fluorine". Matheson Gas Data Book (ط. 7th). Parsippany: Matheson Tri-Gas. ISBN:978-0-07-135854-5.
- Young، David A. (1975). Phase Diagrams of the Elements (Report). Lawrence Livermore Laboratory. مؤرشف من الأصل في 2020-08-13. اطلع عليه بتاريخ 2011-06-10.
- Zorich، Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN:978-0-323-14055-3.
وصلات خارجية
 فيديو خارجي فيديو خارجي | |
|---|---|
 | تفاعلات مختلفة لعنصر الفلور على يوتيوب |
 | تفاعل الفلور مع السيزيوم على يوتيوب |










