Conexina
As conexinas, ou proteínas das unións comunicantes, son unha familia de proteínas transmembrana estruturalmente relacionadas que se ensamblan para formar un tipo de unión celular chamado unión comunicante de vertebrados (polo que son unha familia completamente diferente á das innexinas, que forman as unións comunicantes de invertebrados).[1] Cada unión comunicante está composta por dúas semicanles, un en cada célula situados un enfronte do outro, chamados conexóns, cada un dos cales está constituído por seis moléculas de conexinas. As unións comunicantes son esenciais para moitos procesos fisiolóxicos, como a despolarización coordinada do músculo cardíaco, o correcto desenvolvemento embrionario, e a resposta de condución na microvasculatura sanguínea. Por esta razón, as mutacións nos xenes que codifican as conexinas poden causar anormalidades no desenvolvemento e funcionais.
| Conexina | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Visión lateral e frontal dun hexámero de conexina-26. As conexinas forman os conexóns ou semicanles da unión comunicante. | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Connexin | ||||||||||
| Pfam | PF00029 | ||||||||||
| InterPro | IPR013092 | ||||||||||
| PROSITE | PDOC00341 | ||||||||||
| TCDB | 1.A.24 | ||||||||||
| OPM superfamily | 215 | ||||||||||
| OPM protein | 2zw3 | ||||||||||
| |||||||||||
Estrutura

As conexinas son proteínas transmembranas que atravesan catro veces a membrana que constan duns extremos N e C-terminais citoplasmáticos, un bucle citoplasmático (CL) e dous bucles extracelulares, (EL-1 e EL-2). As conexinas están ensambladas en grupos de seis formando hemicanles, ou conexóns; dúass destas hemicanles combínanse para formar unha unión comunicante. A familia de xenes da conexina é diversa, e consta de 21 membros identificados no xenoma humano secuenciado, e vinte no do rato (19 deles son pares ortólogos). Xeralmente o seu peso é de entre 26 e 60 kDa, e teñen unha lonxitude media de 380 aminoácidos. As diversas conexinas combínanse formando unións comunicantes homoméricas ou heteroméricas, cada unha das cales pode mostrar diferentes propiedades funcionais, como a condutancia de poro, selectividade de tamaño, selectividade de carga, apertura por voltaxe ou por unha substancia química.
Nomenclatura
O termo conexina abréviase como Cx ou CX. Na literatura recente as conexinas denomínanse xeralmente polo seu peso molecular, por exemplo a Cx26 é a conexina de 26 kDa. Porén, isto pode levar a confusión cando se comparan conexinas de diferentes especies, por exemplo, a Cx36 humana é homóloga da Cx35 do peixe cebra. Unha nomenclatura que compite coa anterior é o sistema GJ (gap junction ou unión comunicante), no que as conexinas son clasificadas en formas α (GJA) e β (GJB), e agrúpanse conexinas adicionais nos grupos C, D e E, seguidos dun número de identificación, por exemplo, GJA1/Gja1 corresponde a CX43/Cx43. Na Gap Junction Conference celebrada en 2007 en Elsinore deciciuse utilizar o sistema de nomenclatura GJ para os xenes que codifican as conexinas, pero para as proteínas codificadas preferiuse manter a nomenclatura das conexinas tradicional usando o peso molecular da proteína humana para numerar as proteínas ortólogas.
Biosíntese e internalización
Unha característica salientable das conexinas é que teñen unha vida media relativamente curta de tan só unhas poucas horas.[2] O resultado disto é a existencia dun ciclo dinámico de síntese e substitución de conexinas. Suxeriuse que esta curta vida media permite regular de forma máis fina os procesos fisiolóxicos, como no caso do miometrio.
Desde o núcleo á membrana
A medida que as conexinas son traducidas nos ribosomas do retículo endoplasmático rugoso, son inseridas na membrana do retículo endoplasmático. Unha vez no retículo endoplasmático as conexinas preganse correctamente, orixinándose os dous bucles extracelulares, chamados EL-1 e EL-2. É tamén no retículo endoplasmático onde se produce o inicio da oligomerización de varias moléculas de conexinas para formar as hemicanles, un proceso que continuará no compartimento intermedio do UR-Golgi.[2] As hemicanles formadas poden ser homotípicas, heterotípicas, ou combinacións heterotípica/heteromérica.
Despiois de saíren do retículo endoplasmático e pasaren polo ERGIC, as conexinas pregadas xeralmente entran na rede cis-Golgi.[3] Porén, algunhas das conexinas, como a Cx26 poden ser transportadas independentemente do Golgi.[4][5][6][7][8]
Ensamblaxe das unións comunicantes
As hemicanles, unha vez que son inseridas na membrana plasmática, difunden libremente dentro da bicapa lipídica.[9] Coa axuda de proteínas específicas, principalmente cadherinas, as hemicanles poden acoplarse a hemicanles da célula adxacente formando unións comunicantes.[10] Estudos recentes demostraron a existencia de comunicacións entre as unións adherentes e as unións comunicantes,[11] o que indica que pode haber un nivel de coordinación maior do que se pensaba anteriormente.
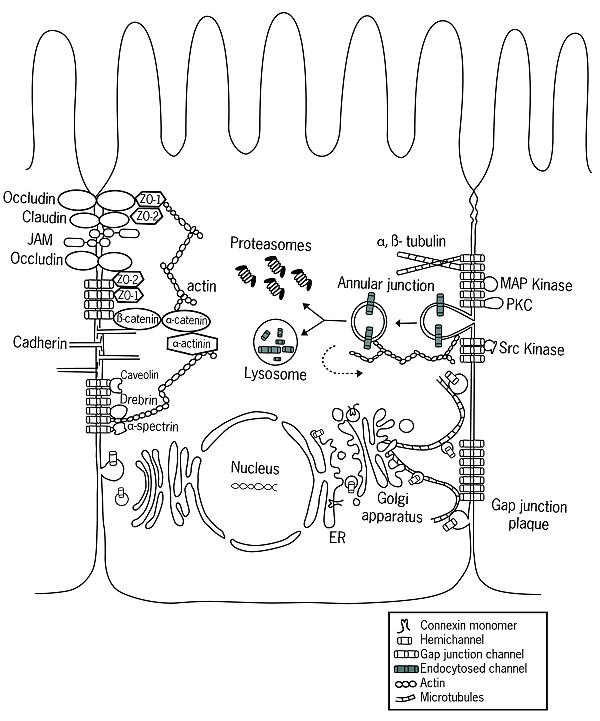
As conexinas son sintetizadas en ribosomas unidos ao retículo endoplasmático rugoso e inseridos no retículo endoplasmático cotraducionalmente. despois prodúcese a oligomerización no retículo endoplasmático ou na rede trans-Golgi (dependendo do tipo de conexina) formando os conexóns, os cales son despois levados á membrana plasmática por medio da rede de microtúbulos de actina. Os conexóns poden tamén ser enviados á membrana plasmática por transferencia directa desde o retículo endoplasmático. Despois da súa inserción na membrana, os conexóns poden permanecer en forma de hemicanles ou poden acoplarse con conexóns compatibles de células adxacentes para formar unións comunicantes. Os novos conexóns que chegan son engadidos na zona periférica de unións comunicantes preformadas, mentres que os fragmentos de unións comunicantes "vellas" centrais son degradados ao internalizarse unha estrutura de dobre membrana chamada unión anular nunha das dúas células, onde ten lugar unha posterior degradación lisosómica ou proteasómica, ou nalgúns casos os conexóns son reciclados á membrana (indicado na figura con frechas descontinuas). Durante o seu ciclo de vida, as conexinas asócianse con diferentes proteínas, entre as cales están: (1) compoñentes citoesqueléticos como microtúbulos, actina, e as proteínas que se unen á actina α-espectrina e drebrina, (2) moléculas das unións celulares como compoñentes das unións adherentes como as cadherinas, α-catenina, e β-catenina, e compoñentes das unións herméticas como as proteínas ZO-1 e ZO-2, (3) encimas como as quinases e fosfatases, que regulan a ensamblaxe, funcionamento e degradación, e (4) outras proteínas como a caveolina.[12]
Función
As unións comunicantes formadas por conexinas atópanse só en vertebrados, mentres que en invertebrados as unións comunicantes están formadas por unhas proteínas de función análoga (pero xeneticamente non relacionadas) chamadas innexinas. Os ortólogos das innexinas foron identificadas tamén en cordados, pero non forman unións comunicantes; denomínanse pannexinas, e as canles formadas por estas proteínas actúan como poros transmembrana moi grandes que conectan os compartimentos intracelular e extracelular, pero non unha célula con outra.
No sistema nervioso central, as unións comunicantes proporcionan un acoplamento eléctrico entre as células proxenitoras, neuronas, e células gliais. Utilizando ratos knockout para as conexinas, atopouse que o acoplamento celular é esencial para a sinalización visual nas células da retina. Na retina, os niveis de luz ambiental inflúen no acoplamento celular proporcionado polas canles das unións comunicantes, adaptando a función visual a diversas condicións de iluminación. O acoplamento das células está gobernado por varios mecanismos, entre os que está a expresión das conexinas.[13]
Lista das conexinas humanas
| Conexina | Xene | Localización e función |
|---|---|---|
| Cx43 | GJA1 | Expresadas na superficie dos vasos sanguíneos con placas ateroscleróticas, e reguladas á alza durante a aterosclerose nos ratos. Poden ter efectos patolóxicos. Tamén expresados nas células da granulosa, e requírense para a proliferación. Normalmente expresadas en astrocitos, tamén se detectan na maioría dos astrocitomas humanos e nos compoñentes astrogliais dos tumores glioneurais.[14] É tamén a principal conexina cardíaca, que se atopa principalmente no miocardio ventricular.[15] Asociadas coa displasia oculodentodixital. |
| Cx46 | GJA3 | |
| Cx37 | GJA4 | Inducidas no músculo liso vascular durante a arterioxénese coronaria. As mutacións que afectan a Cx37 non son letais. Forman unións comunicantes entre os ovocitos e as células da granulosa, e son necesarios para a supervivencia dos ovocitos. |
| Cx40 | GJA5 | Expresadas selectivamente en miocitos das aurículas do corazón. Responsables de mediar a activación eléctrica coordinada das aurículas.[16] |
| Cx33 | GJA6 (GJA6P) | Pseudoxene en humanos |
| Cx50 | GJA8 | En unións comunicantes entre células horizontais tipo A retinianas de rato e coello.[17] |
| Cx59 | GJA10 | |
| Cx62 | GJA10 | As Cx62 humanas corresponden ás Cx57 (rato). A localización nas células horizontais tipo B que levan axón na retina de coello.[18] |
| Cx32 | GJB1 | Principal compoñente da mielina periférica. As mutacións no xene humano causan a enfermidade de Charcot-Marie-Tooth ligada ao cromsoma X, que é unha neuropatía hereditaria. No cerebro humano normal a CX32 exprésase nas neuronas e oligodendrocitos.[14] |
| Cx26 | GJB2 | Mutadas na síndrome de Vohwinkel e na síndrome queratite–ictiose–xordeira (KID). |
| Cx31 | GJB3 | Poden ser asociadas coa eritroqueratodermia variable. |
| Cx30.3 | GJB4 | Confirmouse a expresión de Cx30.3 en timocitos.[19] Poden asociarse coa eritroqueratodermia variable. |
| Cx31.1 | GJB5 | |
| Cx30 | GJB6 | Mutadas na síndrome de Clouston (displasia ectodermal hidrótica) |
| Cx25 | GJB7 | |
| Cx45 | GJC1/GJA7 | En células epiteliais ductais pancreáticas humanas.[20] No nodo aurículo-ventricular. |
| Cx47 | GJC2/GJA12 | Expresadas nas unións comunicantes de oligodendrocitos.[21] |
| Cx30.2 | GJC3 | Expresadas en estruturas do oído interno. Crese que teñen unha función no trnasporte de ións para a transdución de sinais en células do pelo.[22] |
| Cx36 | GJD2/GJA9 | Interveñen na función das células beta pancreáticas, mediando a liberación de ìnsulina. Nas neuronas do sistema nervioso central no que sincronizan a actividade neural.[23] |
| Cx31.9 | GJD3/GJC1 | |
| Cx39 | GJD4 | |
| Cx40.1 | GJD4 | |
| Cx23 | GJE1 | |
| Cx29 | GJE1 | Non forman unións comunicantes que se saiba; están presentes na capa máis interna da vaíña de mielina nas células de Schwann.[24] |
Notas
Véxase tamén
Ligazóns externas
- Connexins Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.