Պոլոնիում
Պոլոնիում (լատին․՝ Polonium), տարրերի պարբերական համակարգի 6-րդ պարբերության 6-րդ խմբի ռադիոակտիվ քիմիական տարր, որի նշանն է Po և ատոմային թիվը՝ 84: P տարր է, ատոմի էլեկտրոնային թաղանթների կառուցվածքն է 5s25p65d106s26p4։ К, L, M և N թաղանթները լրացված են։ Պատկանում է հալոգենների խմբին։ Պոլոնիումը սպիտակ-արծաթափայլ մետաղ է[4]։
| |||||
|---|---|---|---|---|---|
| Ատոմի հատկություններ | |||||
| Անվանում, սիմվոլ, կարգաթիվ | Պոլոնիում / Polonium (Po), Po, 84 | ||||
| Ատոմային զանգված (մոլային զանգված) | 208,9824[1] զ. ա. մ. (գ/մոլ) | ||||
| Էլեկտրոնային կոնֆիգուրացիա | [Xe] 4f14 5d10 6s2 6p4 | ||||
| Ատոմի շառավիղ | 176 պմ | ||||
| Քիմիական հատկություններ | |||||
| Կովալենտ շառավիղ | 146 պմ | ||||
| Իոնի շառավիղ | (+6e) 67 պմ | ||||
| Էլեկտրաբացասականություն | 2,3 (Պոլինգի սանդղակ) | ||||
| Էլեկտրոդային պոտենցիալ | Po ← Po3+ 0,56 В Po ← Po2+ 0,65 В | ||||
| Օքսիդացման աստիճաններ | –2, +2, +4, +6 | ||||
| Իոնացման էներգիա (առաջին էլեկտրոն) | 813,1 (8,43) կՋ/մոլ (էՎ) | ||||
| Պարզ նյութի թերմոդինամիկական հատկություններ | |||||
| Հալման ջերմաստիճան | 527 K (254 °C, 489 °F) | ||||
| Եռման ջերմաստիճան | 1235 K (962 °C, 1764 °F) | ||||
| Մոլյար ջերմունակություն | 26,4[3] Ջ/(Կ·մոլ) | ||||
| Մոլային ծավալ | 22,7 սմ³/մոլ | ||||
| Պարզ նյութի բյուրեղային ցանց | |||||
| Բյուրեղացանցի կառուցվածք | խորանարդ | ||||
| Բյուրեղացանցի տվյալներ | 3,350 | ||||
| CAS համար | CAS գրանցման համար? | ||||
| 84 | Պոլոնիում |
(209) | |
| 4f145d106s26p4 | |
Տարրը 1898 թվականին հայտնաբերել են Մարի Կյուրին և Պիեռ Կյուրին։ Այն հազվադեպ հանդիպող և շատ ռադիոակտիվ տարր է, որը չունի լրացված շերտերով իզոտոպներ։ Պոլոնիումը քիմիապես նման է բիսմութին և տելուրին ու հանդիպվում է ուրանի հանքաքարերում[5]։
Պարբերական աղյուսակում իր դիրքի պատճառով պոլոնիումը երբեմն դասվում է որպես մետաղանման տարր, բայց նրա հատկությունները փաստում են, որ այն միանշանակ մետաղ է։
Պատմություն և անվան ծագում
Պոլոնիումը ռադիոակտիվ հատկությունների շնորհիվ հայտնաբերված առաջին տարրն է։ Պոլոնիումը հայտնաբերել են Պիեռ Կյուրի և Մարի Սկլադովսկայա-Կյուրի ամուսինները (1898)[6] ուրանի խեժահանքում[7] և անվանել Մարի Սկլադովսկայա-Կյուրիի հայրենիքի՝ Լեհաստանի (լատին․՝ Polonia)[8][9] պատվին։ Բնական պոլոնիումի՝ 2l0Po կշռելի քանակներն (0,15 գ) առաջին անգամ անջատվել են 212PO-ի քայքայման արդյունքներից։
Այդ ժամանակ Լեհաստանը ռուսական, գերմանական և ավստրո-հունգարական տիրապետության տակ էր և անկախ չէր։
Կյուրին հույս ուներ, որ տարրը, իր հայրենիքի անունով անվանելով, հայտնի կդառնար իրենց երկրում անկախության պակասը։ Այն առաջին տարրն էր, որի անվանումը օգնեց կարևորել քաղաքական հակասությունները։
Այս տարրը Կյուրիների կողմից հայտնաբերված առաջին տարրն էր։ Այն հայտնաբերվեց, երբ նրանք ուսումնասիրում էին Փիչբլենդ ռադիոակտիվության պատճառը։ Փիչբլենդի միջից ռադիոակտիվ տարրերը՝ ուրանը ու թորիումը, հանելուց հետո, ավելի ռադիոակտիվ է քան ուրանը ու թորիումը միասին։ Այս գաղափարը ստիպեց Կյուրիներին հայթայթել նոր ռադիոակտիվ տարրեր։ 1898 թվականի հուլիսին նրանք փիչբլենդը առանձնացրեցին պոլոնիումից, և հինգ ամիս հետո նաև մեկուսացրեցին ռադիումը։
Բնության մեջ

Պոլոնիումը շատ հազվադեպ է հանդիպվում բնության մեջ, քանի որ իր բոլոր իզոտոպները ունեն շատ կարճ կես-կյանք։ 210Po, 214Po, և 218Po գոյություն ունեն փտած 238U-ի մեջ։ Պոլոնուոմի ռադիոնուկլիդները մտնում են հազվագյուտ ռադիոակտիվ շարքեր կազմի մեջ։
- 210Po (Т1/2 = 138,376 օր), 218Po (Т1/2 = 3,10 րոպե) и 214Po (Т1/2 = 1,643×10−4 վայրկյան) - 238U շարքում,
- 216Po (Т1/2 = 0,145 վրկ) և 212Po (Т1/2 = 2,99×10−7 վրկ) - Th շարքում,
- 215Po (Т1/2 = 1,781×10−3 վրկ) և 211Po(Т1/2 = 0,516 վրկ) - 235U շարքում։
Պոլոնիումը հազվագյուտ տարր է, պարունակությունը երկրակեղևում 2·10−14 զանգված % է, ուրանի խեժահանքում մինչև 5,8 •10−5 %, հրաբխային ապարներում՝ մինչև 3•10−6 %:
Պոլոնիում-2 փոքր քանակությամբ գտնվում է բնության մեջ և կուտակվում է ծխախոտում[10][11][12]։
Պլոնիումի հայտնաբերվել է նաև սննդային շղթաներում, հատկապես ծովամթերքում[13][14]։
Ֆիզիկական հատկություններ
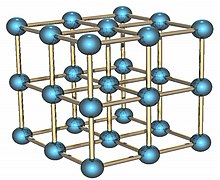
Պոլոնիումը փափուկ, սպիտակ արծաթափայլ ռադիոակտիվ մետաղ է, հալման ջերմաստիճանը՝ 254 °C, եռմանը՝ 1162 °C[15], խտությունը՝ 9300 կգ/մ3, 366°-ից բարձր առաջանում է պոլոնիումի β-ձևափոխությունը (9398 կգ/մ3)։
Պոլոնիումը և նրա միացությունները չափազանց թունավոր են, միացություններից շատերը նաև ցնդող, որի հետևաքով քիմիական հատկություններն անբավարար են ուսումնասիրված։
Քիմիական հատկություններ
Քիմիական հատկություններով պոլոնիումը մոտ է տելուրին, մասամբ նաև բիսմութին։ Միացություններում ունի 4-4, ավելի հազվադեպ -2, +3 և +6 օքսիդացման աստիճաններ։ Լուծվում է թթուներում՝ անջատելով ջրածին։
Օդում տաքացնելիս (250 °C) առաջացնում է PoO2։ Ինդիկատորային (չկշռվող) քանակներով ստացվել են РоО3 և պոլոնիումական թթվի աղերը՝ պոլոնատները (օրինակ, K2PoO4)։ Հայտնի են նաև PoO օքսիդը, լուծույթում՝ Po2+, Po+4, PoO3−2, PoO4−2 իոնները, հիդրօքսիդը՝ Ро(ОН)2, հալոզենիդները՝ РоС12, РоВr2 և այլն, սուլֆիդը՝ PoS[16][17]:
| Բանաձև | Գույն | Հալման ջերմաստիճան (°C) | Սուբլիմացիան ջերմ. (°C) | Սիմետրիա | Փիրսոն սիմվոլ | Բյուրեղագրաֆիկ խումբ | Ոչ | a (pm) | b(pm) | c(pm) | Z | ρ (գ/սմ3) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PoO2 | բաց դեղին | 500 | 885 | խորանարդ | cF12 | Fm3m | 225 | 563.7 | 563.7 | 563.7 | 4 | 8.94 | [19] |
| PoCl2 | մուգ կարմիր | 355 | 130 | շեղանկյուն | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6.47 | [20] |
| PoBr2 | մանուշակագույն-շագանակագույն | 270 | [21] | ||||||||||
| PoCl4 | դեղին | 300 | 200 | մոնոցիկլիկ | [20] | ||||||||
| PoBr4 | կարմիր | 330 | Խորանարդ | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | [21] | ||
| PoI4 | սև | [22] |
Օքսիդներ
| Հիդրիդներ
| Հալոիդներ
|
Կշռելի քանակներով ստացվել են քառահալոգենիդները և սուլֆատները, որոնք ջրում հիդրոլիզվում են։ Հալոգենների հետ առաջացնում է տետրահալոգենիդներ։ Թթուների ազդեցությամբ լուծվում է լուծույթներում՝ առաջացնելով Ро2+-ի վարդագույն գույնի իոնը։
Սինթեզվել են պոլոնիում-օրգանական միացությունները՝ (C6H5)2Po, (СбН5)2РоС12, և այլն։
Մետաղական պոլոնիումը օդում արագ օքսիդանում է։ Հայտնի են պոլոնիումի երկօքսիդը (РоО2)x և պոլոնիումի մոնօքսիդը РоО:
Պոլոնիումը մագնեզիումի առկայությամբ փոխազդում է աղաթթվի հետ՝ առաջացնելով պոլոնոջրածին.
,
որոնք սենյակային ջերմաստիճանում գտնվում են հեղուկ վիճակում (−36,1 մինչև 35,3 °C)
Պոլոնիումը միակ քիմիական տարրն է, որը ցածր ջերմաստիճանում ձևավորում է միատոմանի, պարզ խորանարդ բյուրեղացանց[23]։
Ալֆա վիճակը պարզ խորանարդային կառուցվածքի միակ հայտնի օրինակն է մեկ ատոմի դեպքում, որի գագաթնային չափսերն են 335.2 պիկոմետր է, իսկ բետա վիճակը՝ ռոմբոբջջրային[24][25][26]։ Պոլոնիումի կառուցվածքը բնութագրվել է ռենտգենյան ճառագայթների և էլեկտրոնների օգնությամբ։
Իզոտոպներ
Պոլոնիումը ունի 33 հայտնի իզոտոպներ, որոնք բոլորը ռադիոակտիվ են։ Հայտնի են 193-218 զանգվածի թվերով ռադիոակտիվ իզոտոպները, որոնցից ամենակայունը 209Po(T1/2 = 103 տարի) արհեստական իզոտոպն է։ Բնության մեջ հանդիպում են 210-212, 214-216 և 218 զանգվածի թվերով իզոտոպները, առաջանում են որպես բնական ռադիոակտիվ շարքերի անդամներ։ Նրանց հարաբերական ատոմային զանգվածները տատանվում են 188-ից 220։ 210Po-ը (կես կյանք-138.376 օր) և բոլոր իզոտոպներից ամենատարածվածն է։ Իսկ ամենաերկարակյաց իզոտոպը 209Po-ը (կես կյանք 125.2 ± 3.3 տարի) և 208Po-ը (կես կյանք 2.9 տարի)։ Պոլոնիումի կայուն իզոտոպներ հայտնի չեն[27]։Ամենակայունը բնական իզոտոպն է՝ 210Po(T1/2= 138 օր, α-ճառագայթիչ, փոխարկվում է 206Рb-ի) որն աննշան քանակներով կուտակվում է ուրանի հանքերում, մշտապես ուղեկցում ռադիումին և նրա միացություններին։
208Po-ը կարող է ստացվել հատուկ անոթի մեջ կապարի կամ բիսմութի ալֆա, պրոտոն կամ դեյտրոն ռմբակոծումից։Պինդ վիճակ
Պոլոնիումը ռադիոակտիվ տարր է, որը գոյություն ունի երկու մետաղական ալոտրոպներում։
| Իզոտոպ | Անվանում | Նշան | Ռադիոակտիվ շարք |
|---|---|---|---|
| 210Po | Ռադիում F | RaF | 238U |
| 211Po | Ակտինիում C' | AcC' | 235U |
| 212Po | Թորյում C' | ThC' | 232Th |
| 214Po | Ռադիում C' | RaC' | 238U |
| 215Po | Ակտինիում A | AcA | 235U |
| 216Po | Թորիում A | ThA | 232Th |
| 218Po | Ռադիում A | RaA | 238U |
Ստացում
Պոլոնիումը (210Ро) միլիգրամային քանակներով ստանում են միջուկային ռեակտորներում՝ բիսմութը նեյտրոններով ճառագայթելով։
2006 թվականին բրիտանացի գիտնական և գրող Ջոն Էմսլի հաստատմամբ, այդ տարվա ընթացքում արտադրվել է մոտ 100 գրամ 210Ро-ում.[28]:
Արժեք
Ըստ բրիտանացի փորձագետների՝ պոլոնիումի-210 մանրադիտակային դոզան արժի միլիոնավոր ԱՄՆ դոլլարներ[29]։ Մյուս կողմից, ռադիոքիմիկոսների հաստատմամբ բիսմութից ստացված պոլոնիումի-210 շատ էժան է[30]։ Համաձայն 2006 թվականի տվյալների՝ արտադրված պոլոնիումի-210-ի 9,6 գրամի համար վճարվում էր շուրջ 10 միլիոն ռուբլի[31], որը համընկնում է տրիտիումի գնի հետ[32]։
Սակայն ամերիկյան United Nuclear ընկերություն, ստանալով իզոտոպը Ռուսաստանում, 2006 թվականին պոլոնիումի նմուշները վաճառեց $69 գնով, պնդելով, որ մահացու դոզայի համար կպահանջվի ավեի քան $1 միլիոն դոլլար[33]։
Միացություններ
Պոլոնիումը չունի հասարակ միացություններ և իր գրեթե բոլոր միացությունները արհեստականորեն են ստացվում։ Այդ միացություններիցավելի քան 50-ը ճանաչված են։ Պոլոնիումի ամենակայուն միացությունները պոլոնիդներն են, որոնք պատրաստվում են երկու տարրերի անմիջական փոխազդեցությունից։
Na2Po-ը ունի անտիֆլորիտ կառուցվածքը, Ca, Ba, Hg, Pb տարրերի պոլոնիդների և լանթանիդների փոխազդեցությունից առաջանում է NaCl-ի ցանցեր, իսկ BePo-ը և CdPo-ը ունեն ուրտզիտ, և MgPo-ը՝ նիկել արսենիդ կառուցվածքը։
Կիրառություն
Պոլոնիումային հիմքով ալֆա մասնիկների աղբյուրները առաջացել էին ԽՍՀՄ-ում։ Այսպիսի աղբյուրներ օգտագործվում էին արդյունաբերական ծածկույթների հաստությունը որոշելու համար։
Պոլոնիումի կիրառությունները քիչ են։ Այն օգտագործվում է տիեզերագնաց և հակաստատիկ սարքերի պատրաստման մեջ։ Նաև հանդիսանում է նեյտրոնների և ալֆա մասնիկների աղբյուր։
Թունավորություն
210Po բնական ռադիոակտիվ նստվածքի սովորական բաղադրիչն է, որը արմատների և վերգետնյա օրգանների միջոցով անցնում է բույսին։ Մարդու և կենդանիների օրգանիզմ է ներմուծվում սննդի հետ․ թեյը պարունակում է 500-600․ ծովային ձուկը՝ 20-100, միսը՝ 2-3, ձավարեղենը՝ 2, հացը՝ 1 պԿյուրի/կգ։
Մարդու և կենդանիների հյուսվածքներում պոլոնիումի պարունակությունը մոտ 4•10−2 պԿյուրի/կգ է։ Նրա այդպիսի փոքր քանակների կենսաբանական ներգործությունը վատ է ուսումնասիրված, մեծ քանակները α-ճառագայթման պատճառով ազդում են բազմաթիվ օրգանների վրա։
Պոլոնիում-210-ից թունավորման դեպքեր
- Ալեքսանդր Վալտերովիչ Լիտվինենկոն 2006 թվականին մահացել է պոլոնիում-210-ի թունավորումից։
- Պոլոնիումը հայտնաբերվել է Յասեր Արաֆաթի անձնական իրերում, ով մահացել է 2004 թվականին։ Որոշվել է նշանակել արտաշիրիմում[34]։ Սկզբում շվեյցարական միջազգային հանձնաժողովը հաստատեց, այն փաստը, որ թունավորվել է պոլոնիումով[35]։ Ավելի ուշ ռուսական և ֆրանսիական կողմերի արդյունքների եզրակացության համաձայն թունավորման ոչ մի ապացույց չկար[36]։
Տես նաև
Ծանոթագրություններ
Գրականություն
- Bagnall, K. W. (1962). «The Chemistry of Polonium». Advances in Inorganic Chemistry and Radiochemistry. Vol. 4. New York: Academic Press. էջեր 197–226. doi:10.1016/S0065-2792(08)60268-X. ISBN 0-12-023604-4. Վերցված է 2012 թ․ հունիսի 14-ին.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0080379419.
Արտաքին հղումներ
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Polonium
- Polonium at The Periodic Table of Videos (University of Nottingham)
- Gesundheits- und Umweltaspekte von Polonium
- Polonium-210 – In tödlicher Mission
- Verfahren zur Bestimmung von Polonium-210 in Urin in einem radiochemischen Labor des Forschungszentrums Jülich
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Պոլոնիում» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից։ |
| Այս հոդվածն ընտրվել է Հայերեն Վիքիպեդիայի օրվա հոդված: |



