ミオグロビン
ミオグロビン(英語: myoglobin)(略: Mb)は、筋肉中にあって酸素分子を代謝に必要な時まで貯蔵する色素タンパク質である。クジラ、アザラシ、イルカなど水中に潜る哺乳類は大量の酸素を貯蔵しなければならないため、これらの筋肉には特に豊富に含まれている。一般に動物の筋肉が赤いのはこのタンパク質に由来する。
歴史
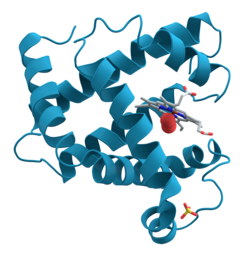
X線回折により三次構造が解かれた最初のタンパク質として知られる。1958年にジョン・ケンドリューらはマッコウクジラのミオグロビン結晶を使って2Åの分解能でその全構造を明らかにした。
構造と機能
1本のポリペプチド鎖と1分子のヘムからなり、酸素分子を結合する。筋繊維中に広く見られ、球状タンパクで酸素を蓄える。153個のアミノ酸残基から成り、1個のヘムをもち、分子量は約1万7800である。タンパク質は8個のαヘリックスをもち、それらがヘムをとり囲んでいる。酸素分子はヘムの中央にある鉄に可逆的に結合する(酸素化)。
- 酸素の貯蔵(Long period oxygen storage)[1][2]
- 生体触媒(Biochemical catalyst)[3][2]
- 酸素透過の促進(Facilitation of oxygen diffusion)[4][2]
- 酸素バッファー(Oxygen bufferあるいはShort-time oxygen storage)[2]
酸素に対する化学親和力がヘモグロビンより高く、血中のヘモグロビンから酸素を受け取り貯蔵することができる。ミオグロビンの構造と機能はヘモグロビンと類似性が高いが、ヘモグロビンが四量体であるのに対してミオグロビンは単量体である点が大きく異なっている。外部酸素濃度が低い場合、例えば筋肉の酸素要求が血液からの供給を超えた場合などにのみ酸素分子を放出し、緊急時の酸素貯蔵庫として機能する。
毒性
ミオグロビンは筋挫滅、強い圧迫、激しい運動を受けた筋肉が解放されるとカリウム、乳酸などと共に大量に流れ出し、クラッシュ症候群を引き起こす。ミオグロビンやヘモグロビンのヘム色素は腎毒性があるため、高ミオグロビン血症[5]による急性腎不全(尿細管壊死)を招き(ミオグロビン尿症)の原因となる[6]。
誘導形態
食肉中には、酸素型(オキシミオグロビン)、還元型、メト型3種の誘導型が存在する[7]。
ミオグロビンとヘム鉄
メトミオグロビンはミオグロビンのヘム鉄が Fe2+ から Fe3+ に主に酸素により酸化されたものである。生きている筋肉においては、補酵素であるNADHとシトクロムb4の存在下でメトミオグロビンの補欠分子族であるヘムの Fe3+ を通常のミオグロビンの Fe2+ に還元するメトミオグロビン還元酵素の活動によりメトミオグロビンの濃度は無視できるほど少量である。死んだ筋肉である食肉は、メトミオグロビンを除去するためのこの還元作用が働かず、ミオグロビンが酸化されてメトミオグロビンが過剰に生成され、それゆえ食肉が古くなると茶色のメトミオグロビンが蓄積されるものである。