心停止
心停止(しんていし、英: cardiac arrest)は、突然の心停止(英: sudden cardiac arrest)とも呼ばれ、心臓の拍動が突然停止することである[11][1]。その結果、血液は正常な循環で全身に送られなくなり、意識は急速に失われ、呼吸は異常を呈するか消失する[1]。心停止が起こった場合、心肺蘇生法(CPR)や、場合によっては除細動などの即時介入がなければ後遺症を残すか、心臓突然死(英: sudden cardiac death)と呼ばれる死に至ることもある[2][12][13]。日本では、心停止は心肺停止(英: cardiopulmonary arrest: CPA)とも呼ばれることもある[14][15][16]。
| 心停止 | |
|---|---|
| 別称 | 心肺停止、突然の心停止[1] |
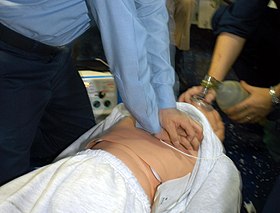 | |
| 心停止を模したマネキンに対して行われている心肺蘇生法 | |
| 概要 | |
| 診療科 | 循環器学, 救急医学 |
| 症状 | 意識レベル低下 or 意識消失, 呼吸停止, 脈拍触知不能[1][2] |
| 発症時期 | 発症リスクは年齢とともに増加する[3]。 |
| 原因 | 虚血性心疾患, 先天性心疾患, 大量出血, 低酸素症, 感電, 低カリウム血症, 心不全など |
| 診断法 | 脈拍無し,[1] 心電図[4] |
| 合併症 | 蘇生した場合、 昏睡、 遷延性意識障害、心停止後症候群。蘇生されなかった場合は死に至る。 |
| 予防 | 喫煙をしない, 運動, 健康体重の維持, 健康的な食事[5] |
| 治療 | 心肺蘇生法 (CPR), 除細動[6] |
| 予後 | 全生存率 ≈10% (病院外) 25% (病院内);[7][8] 予後は心停止のタイプとその原因とで大きく異なる。 |
| 頻度 | 年間13人/10,000人 (米国、病院外)[9] |
| 死亡数・率 | 425,000人/年 以上 (米国)[10] |
| 分類および外部参照情報 | |
医学的には「死」とは、心肺系、もしくは脳に不可逆的な損傷を負った状態(脳死)を含み[17]、生命維持に不可欠な臓器の恒久的な全機能停止とされる[18]。一方、心停止は極めて深刻な病的状態だが、心肺蘇生によって、最善の場合社会復帰できる可能性と可逆性を有しており[19][20]、死とは区別される[注釈 1]。本項では心停止について概説する。
概要
心停止の最も一般的な原因は心室細動(Vf)や心室頻拍(VT)などの致死的不整脈であるが、様々な疾患が原因となる[22]。特に心臓疾患が心停止の主な危険因子である[3]。これらの致死的不整脈においては、心電図上は心臓の電気活動はあるものの、心臓は全身に血液を送り出すポンプ機能を喪失している。
心停止は脈拍(手首や首などの動脈の拍動)が確認できないことで診断される[1]。なお、心拍と脈拍は医学的に異なる概念である。心拍は、胸部聴診や心電図で確認できる心臓の拍動であり、脈拍は手首や首などで確認できる動脈の拍動である[23][24]。心電図上、心室細動・心室頻拍以外の波形が認められたり、たとえ、その波形が正常であっても、脈拍が確認できなければ、心停止である[25][26]。このような状況は無脈性電気活動と呼ばれる[27]。心電図上、電気活動がない、いわゆるフラットな状況は心静止と呼ばれ、心停止の一種ではあるが、より深刻な状況である[27][28][29]。
心肺蘇生と除細動により、心停止を回復させ、自己心拍を再開させることができるが、そのような介入がなければ、心臓突然死として知られる致命的な状況となる[13][30]。心停止後の心肺蘇生の開始は早ければ早いほど、生存確率は高まる[31][32]。
他の、一般的ではない原因としては、大出血、低酸素症、極度の血中カリウム濃度低下、感電、心不全、遺伝性不整脈、激しい運動などがある。これらの心停止に対しては、それぞれの原因に対する治療、例えば大出血に対しては止血、低酸素症に対しては酸素供給の再開など、根本の治療を行わねば、生存は期待できない。
場合によっては、死亡が予測される重篤な疾患の結果として心停止が起こることもある[33]が、疾患の末期や老衰など蘇生しても継続的な延命が困難な状況では、事前の本人もしくは家族による蘇生を行わないという意思表示(蘇生措置拒否、DNR)があれば、心肺蘇生の対象とはならない[34]。
心停止は、それが起こった状況で分類されている。例えば、心停止の瞬間を目撃した人がいたかどうか(目撃のある心停止、目撃のない心停止)や病院内で発生したかどうか(病院内心停止、病院外心停止)[35]。これらの状況により、心停止の治療戦略が変わり、予後も変わる[35]。
病院内でDNR対象外の予期しない心停止もしくはそれに準ずる事態が発生した場合は、蘇生対応のための医療従事者の緊急召集を意味するコード・ブルーが発令、放送される。病院外で心停止に遭遇した場合、周囲の助けを求め、救急医療サービス(日本では119番)に連絡する[36]。
心停止の治療には、直ちに心肺蘇生を行い、ショックで治療可能な不整脈(心室細動か心室頻拍)が存在する場合は除細動を行う[6]。病院内では除細動器が用いられるが、病院外の公共の場所では医療従事者以外でも使用できる自動体外式除細動器(AED)が用いられる。心肺蘇生には、一次救命措置(BLS)と二次救命処置(ALS)の2つのプロトコルが確立されている[37]。BLSは医療従事者に限定しない一般人をも対象として、講習が開催されている。ALSにおいては、アドレナリンの静脈注射、酸素投与や気道確保など、様々な医療処置が行われる[38][注釈 2]。心肺蘇生においては、中断時間を最小限にした、胸骨圧迫(心臓マッサージ)が脳や心臓への血流供給維持の上で重要である[40][41]。心拍が再開した患者では、体温管理療法が転帰を改善する可能性がある[42][43]。致死的不整脈からの蘇生後のケアでは、再発による死亡の可能性を減らすために、植え込み型除細動器(ICD)の使用が考慮される[5]。
地域によって違いはあるが、病院外心停止からの全生存率は10%未満と低い[7]。心停止からの蘇生確率は、蘇生が遅れると分秒単位で低下していくからである[36]。この現状を打破するため、心停止の予防、心停止の早期認識と通報、一次救命処置、二次救命処置、これらの救命行為を途切れること無く行う「救命の連鎖」が勧奨されている[36][44]。心停止から生還しても、様々な障害が残ることがあり、これらは心停止後症候群と呼ばれる[45]。とりわけ、脳は血流の途絶に弱く、およそ20分の血流途絶で不可逆的な損傷を受ける[46]。その症状は、軽度の記憶障害で済むこともあれば遷延性意識障害[注釈 3]に至ることもある[47]。
症状と徴候
心停止はおよそ半数が、警告的な症状が現れることなく突然に起こる[48]。有症状の場合でも、その症状は通常、心停止に特有なものでは無い[49]。以下の症状が新規に、ないしは既存症状の悪化として現れる[49]。
意識障害や異常な呼吸の徴候から居合わせた人が心停止を疑った場合は、心停止であると考え、心肺蘇生を開始すべきである。訓練を受けた医療従事者が心停止を疑った場合は、心肺蘇生を開始する前に10秒間脈拍を確認する[51]。脳への血流が失われた結果、患者は急速に意識を失い、呼吸が停止する。脳の酸素不足の状態が長く続くと、心停止から昏睡状態に陥ることがある。心停止から生還した人の10~20%が臨死体験を報告しており、これは蘇生中も一定レベルの認知機能が働いていることを示している[52]。
危険因子
心停止の危険因子は虚血性心疾患の危険因子と類似しており、年齢、喫煙、高血圧、高コレステロール血症、運動不足、肥満、糖尿病、家族歴、心筋症などがある[53][54]。 これらの危険因子の多くを統計的に分析した結果、心停止全体の約50%は、複数の危険因子の総合的な弊害により最もリスクが高いと認識される人口集団の10%で発生しており、複数の併存疾患の累積リスクが各リスクの合計を上回ることが示された[55]。
冠動脈疾患を有する喫煙者は、30~59歳の間に心臓突然死のリスクが2~3倍上昇することが明らかになっている。さらに、元喫煙者のリスクは喫煙経験のない人のリスクに近いことが明らかになった[48][56]。過去の有害心イベント、非持続性心室頻拍(NSVT)、失神、左室肥大は、小児期肥大型心筋症(稀な疾患)における心臓突然死の予測因子である[57]。
駆出率の低下や不整脈などの心臓の機能的変化は、心停止のリスクを増加させ、前述の危険因子とは独立して作用することが示されている。これらの機能的変化をもたらす病態は、過去の心障害の後に後天的に発症することもあれば、不整脈性疾患の家族歴を通じて遺伝することもある[58]。
原因
突然の心停止、または心臓突然死は、心臓が突然、異常または不規則なリズム(不整脈)で拍動し始めたときに起こる[59]。心筋の刺激伝導系が組織化されていないと、心室の収縮が一定せず、その結果、心臓からの十分な心拍出量(心臓から全身への血液の前方への送り出し)を得られなくなる[60]。不整脈にはさまざまな種類があるが、突然の心停止で最も頻繁に記録されるのは心室頻拍と心室細動である[61][62][63]。心停止で頻度の低い不整脈には、無脈性電気活動(pulseless electrical activity: PEA)、徐脈、心静止がある[59]。このような不整脈は、心停止が長引いたり、心室細動が進行したり、蘇生のために除細動を行ったりした場合にみられる[59]。リズムの変化はまた、心傷害の根本原因(虚血性か非虚血性か)と相関しているようである[64]。
突然の心停止は、以下のような心原性および非心原性の要因によって起こりうる。
心原性
冠動脈疾患
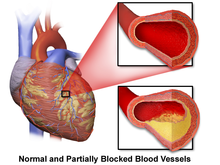
冠動脈疾患(Coronary artery disease: CAD)は虚血性心疾患(ischemic heart disease: IHD)としても知られ、心臓突然死の62~70%を占める[65][66]。CADは40歳未満の心臓突然死の原因としては、他よりはるかに頻度が低い[65]。心臓突然死の剖検で最もよくみられる所見は、心筋に血液を供給する動脈である主要冠動脈の少なくとも1部位の慢性高度の狭窄であることが、症例から示されている[67]。この狭窄は多くの場合、数年にわたるコレステロールプラーク、すなわちアテロームの沈着と炎症に伴う動脈の狭窄と硬化の結果である。冠動脈血管のこのような蓄積とリモデリングは他の全身血管とともにアテローム性動脈硬化の進行を特徴づけるものである[68]。安定したプラークが破裂すると、小動脈を通る血液と酸素の流れが遮断され、その結果虚血性障害を引き起こす。虚血後の組織の傷害は、心臓の正常な伝導サイクルの継続を妨げ、心拍数を変化させる構造的・機能的変化をもたらす[69]。
非動脈硬化性冠動脈疾患
動脈硬化とは関係のない冠動脈の異常には、先天性冠動脈異常(例えば左冠動脈が肺動脈から起始する)、冠動脈炎として知られる炎症、塞栓症、血管攣縮、結合組織疾患や外傷による器質的異常などがある。これらの疾患は、心停止や心臓突然死の10~15%を占める[69]。
- 冠動脈炎は、川崎病として知られる小児の熱性炎症性疾患に起因することが多い。他の血管炎も心臓突然死のリスクを高める原因となる
- 冠動脈の塞栓症(血栓症)は、大動脈弁、三尖弁、または人工弁が侵された心内膜炎に続発する敗血症性塞栓から起こることが最も多い。
- 冠血管攣縮 は、心臓の電気伝導を変化させる不整脈を引き起こす可能性があり、重度または長時間のリズム変化により完全な心停止の危険性がある
- 心停止の危険性を伴う器質的異常は、マルファン症候群や外傷に起因する冠動脈解離から生じることがある[69]。
構造的心疾患

冠動脈疾患とは関係のない構造的心疾患は心臓突然死の10%を占める[60][66]。例えば、心筋症(肥大型、拡張型、不整脈源性)、不整脈、心筋炎、高血圧性心疾患、うっ血性心不全などである[70][71]。なお、構造的心疾患とは、従来は心筋疾患や先天性心疾患などの心臓の構造異常を意味していたが、現在は虚血性心疾患以外で心内に何らかの構造異常を呈するもの全体を意味する[72]。
左室肥大は、成人における心臓突然死の主な原因であると考えられている[73][59]。左室肥大は、心臓の主要なポンプ室である左心室の壁に不適応な変化を引き起こす、長年の高血圧の結果として起こることがほとんどである[74]。血圧が上昇すると、全身に血液を十分に循環させるために心臓のポンプ作用がより強くならねばならない。コントロールされていない高血圧のために心臓が長期間このような状態になると、左心室が肥大して心臓の働きが低下する[75]。左室肥大は心エコー図や心電図(ECG、EKG)で確認することができる[74]。
1999年の米国における心臓突然死のレビューによると、30歳未満の心臓突然死の30%以上が構造性心疾患であった。18〜35歳の軍の新兵を対象とした調査では、心臓突然死の40%以上が構造的心疾患であった[65][66]。
うっ血性心不全は心臓突然死のリスクを5倍に高める[71]。
心臓伝導系(特に房室結節とヒス-プルキンエ系)の構造的異常は、突然の心停止に至る危険性のある不整脈を誘発する可能性があるが、その危険性はまだ低い。これらの伝導ブロックの多くは、線維化の重症度や重度の電気生理学的障害のためにリスクが高いと判断された場合には、植込み型除細動器による治療が可能である[76]。
遺伝性不整脈疾患
心臓の構造的疾患によるものではない不整脈は、突然の心停止の5〜10%を占める[77][78][79]。これらの不整脈は遺伝的疾患によって引き起こされることが多い[59]。遺伝子変異は多くの場合、細胞膜を横切って電荷を帯びた粒子を伝導するイオンチャネルとして知られる特殊なタンパク質に影響を及ぼすため、この疾患群はしばしばチャネロパチーと呼ばれる。このような遺伝性不整脈症候群の例としては、QT延長症候群(LQTS)、ブルガダ症候群、カテコールアミン作動性多形性心室頻拍(Catecholaminergic polymorphic ventricular tachycardia: CPVT)、QT短縮症候群などがある。また、致死的な不整脈を引き起こす可能性のある大きな音への反応など、環境的または神経原性の誘因を伴うものも多い[76]。不整脈を促進するが遺伝子変異が原因ではない疾患には、他にウォルフ・パーキンソン・ホワイト症候群がある[60]。
QT延長症候群は、若者の死亡例でしばしば言及される疾患であるが、出生5000〜7000人に1人の割合で発生し、米国で救急隊が対応する心停止年間約30万人に対し、3000人が該当すると推定されている[80]。これらの病態は、心停止に関連する死亡者全体の数パーセントに過ぎないが、心停止前に発見される可能性があり、治療可能な可能性がある病態である。QT延長症候群の症状は非常に幅広く、心停止よりもむしろ失神を呈することが多い。心停止のリスクは依然として存在するため、突然の心停止の家族歴のある人は、LQTSや他の治療可能な致死的不整脈の原因についてスクリーニングを受けるべきである。心停止のリスクが高いのは、性別が女性であること、QT延長が著明であること、原因不明の失神(失神発作)の既往があること、または若年での心臓突然死の家族歴があることである[76]: さらに、LQTS患者は、この伝導異常を重症化させるリスクのある特定の薬剤、例えば、特定の抗不整脈薬、抗うつ薬、キノロン系またはマクロライド系の抗生物質などを避けるべきである[81]。
非心原性
非心原性は心停止の15~25%を占める[79][82]。最も一般的な非心臓性の原因は、外傷、大出血(消化管出血、大動脈破裂、脳出血)、循環血液量減少性ショック、薬物過剰摂取、溺水、肺塞栓症である[82][83][84]。心停止は、ある種のクラゲに刺されたような中毒や、雷のような感電によっても引き起こされる[59]。
可逆性の原因
心停止の心臓以外の原因は、身体のホメオスタシスの一時的な障害に起因する場合がある。これは、電解質比の変化、酸素飽和度の変化、または身体のpHに影響を及ぼす他のイオンの変化の結果である可能性がある[47]。「6H6T」は、治療可能または可逆的な心停止の原因を覚えるための記憶術である[85][37][47]。
この記憶術には、以下のとおり、心臓由来の原因と非心臓由来の原因が含まれる。
- 6H
- 循環血液量減少(Hypovolemia) - 出血やアナフィラキシーなど
- 低酸素症(Hypoxia)
- 水素(Hydrogen)イオン – アシドーシス
- 高カリウム血症(Hyperkalemia)又は低カリウム血症(hypokalemia)
- 低体温症(Hypothermia) – 体温調節の異常
- 低血糖症(Hypoglycemia)又は高血糖症(hyperglycemia)
- 6T
- 錠剤(Tablets) 又は 毒素(toxins)- 薬物過剰摂取や服毒など
- 心タンポナーデ(tamponade) – 心臓と心膜との間の体液貯留
- 緊張性気胸(Tension pneumothorax) – 胸膜腔への気体貯留
- 血栓症(Thrombosis) (心筋梗塞) – 冠動脈の血栓症
- 血栓症 (肺血栓塞栓症) - 肺動脈の血栓症
- 外傷性心停止(Traumatic cardiac arrest)
小児
小児の心停止の最も一般的な原因は、治療を受けていないショックまたは呼吸不全である[59]。小児では、不整脈は最も一般的な原因ではない[59]。心不整脈があったとしても、成人にみられる心室細動や頻脈とは対照的に、多くの場合、心静止や徐脈である[59]。以前は健康であった小児が、心停止に至るような不整脈を呈するその他の原因としては、コカイン やメタンフェタミンなどの薬物や、抗うつ薬などの薬物過剰摂取があり得る[59]。小児における原因不明の突然の心停止の一般的な原因には、肥大型心筋症、冠動脈異常、不整脈などがある[86]。
機序
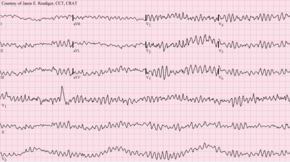
心停止の決定的な電気的メカニズムは、上記の機能的、構造的、または生理学的異常のいずれかに起因する可能性があるが、収縮期に至らない頻脈性不整脈または徐脈性不整脈が特徴である[55]。 頻脈性不整脈はさらに、心室細動と無脈性または持続性心室頻拍(VT)に分類することができ、どちらも、十分な血流を維持できず、身体の需要を満たすのに不十分な、急速で不規則な不整脈である[87]。
心臓突然死の原因の大部分は心室細動である。心室細動は、心室心筋の乱れた電気的活動によって特徴づけられる頻脈性不整脈であり、心拍数が乱れ、速くなりすぎて有効な心拍出量が得られなくなるため、脳や重要臓器の灌流が不十分になる[88]。心室頻拍では、心臓の拍動も通常より速くなり、心室が血液で適切に満たされないことがある[89]。心室細動を支える電気生理学的メカニズムには、異所性自動能、リエントリー、撃発活動[90]などがある[91]。遺伝的要因(例えば、イオンチャネルをコードする遺伝子の突然変異)による病的心臓の構造変化では心臓突然死の急性発症の説明はできない[92]。
心室細動も心室頻拍も、心臓が血液を効率よく全身に送り出せなくなる。心室頻拍は心電図上のQRS複合体の変化と毎分100回を超える心拍数を特徴とする[93]。心室頻拍が持続(少なくとも30秒間持続)すると、心臓組織への血流が不十分となり、心停止に至ることがある[94]。
徐脈性不整脈は、自発的な電気伝導と心臓の機械的機能が解離し、最悪の場合、無脈性電気活動(pulseless electrical activity: PEA)または心臓の電気活動が完全に消失して心静止となる。頻脈性不整脈の結果と同様に、これらの状態も十分な血流を維持することができなくなるが、徐脈性不整脈の場合、根本的な原因は心収縮の無秩序をもたらす急速な拍動ではなく、心臓の機械的活動の欠如である[87]。
診断

病歴情報と身体診察によって、心停止を診断し、潜在的な原因と予後に関する情報が得られる[59]。患者の病歴を聴取する医療者は、そのエピソードが誰かに目撃されていたかどうか、そのエピソードがいつ起こったか、その人が何をしていたか(特に外傷があったかどうか)、薬物の関与があったかどうかを判断することを目的とすべきである[59]。心停止を診断するための身体検査では、脈がないことに注目する[59]。多くの場合、頸動脈脈拍欠如が心停止診断のゴールドスタンダードである。末梢(橈骨動脈/足背動脈)の脈がないことは、他の状態(ショックなど)や単に救助者の誤りから生じることもある[95]。緊急時に頸動脈を確認する際、救助者が医療従事者であろうと一般人であろうと、しばしば間違いを犯す可能性があることが研究で示されている[96][95]。
ポイントオブケア超音波(Point-of-care ultrasound: POCUS)は、患者のベッドサイドで心臓の動きや収縮力を調べるために使用できるツールである[97]。POCUSは、心臓の動きや収縮を検出するだけでなく、中心脈(頸動脈または大腿動脈)を確認することによる診断の欠点を克服し、病院環境で心停止を正確に診断することができる[97]。
POCUSにより、臨床医は心停止中の心臓のさまざまな部位を限定的だが二次元的に見ることができる[98]。これらの画像は、臨床医が心臓内の電気活動が脈なし(いわゆるPEA)かPEA類似病態であるかどうかを判断するのに役立つだけでなく、心停止の原因として可逆的なものを診断するのにも役立つ[98]。アメリカ心エコー図学会(American Society of Echocardiography: ASE)、アメリカ救急医学会(American College of Emergency Physicians)、ヨーロッパ蘇生協議会(European Resuscitation Council: ERC)、アメリカ心臓協会(AHA)が発表したガイドライン および2018年版の術前二次心肺蘇生法(ACLS)ガイドラインは、心停止の診断と管理においてPOCUSを用いることの潜在的な利点を認めている[98]。
一方、POCUSは正確さを欠くため、ヨーロッパ蘇生協議会(ERC)のような一部の団体は、あまり重要視していない。その代わりに、現在のガイドラインでは、呼吸がなかったり、異常があったりする意識のない人に対しては、心肺蘇生を開始するよう促している[99]。英国の蘇生協議会は、ERCの勧告やアメリカ心臓協会の勧告と同じ立場である[37]。彼らは、頸動脈をチェックする技術は、特別な訓練と専門知識を持った医療従事者のみが使用すべきであり、その場合でも、死戦期呼吸のような他の指標と合わせて見るべきであると提案している[99]。
循環を検出し、心停止を診断するための他のさまざまな方法が提案されている。2000年の国際蘇生連絡協議会(ILCOR)の勧告に従ったガイドラインでは、救助者は脈拍ではなく「循環の徴候」を探すことになっていた[37]。これらの徴候には、咳、あえぎ呼吸、顔色、痙攣、身体の動きが含まれる[100]。このガイドラインが効果的でなかったことを示すエビデンスにより、現在のILCOR勧告は、意識がなく、正常な呼吸をしていないすべての死傷者について心停止を診断すべきであるというもので、ヨーロッパ蘇生協議会が採用しているプロトコルと同様のものである[37]。患者が死亡している非急性期の状況では、分子病理解剖または死後分子診断によって心停止を診断することができる。これは、一連の分子学的手法を使って、心臓に欠陥のあるイオンチャネルを見つけるものである[101]。これにより、患者の死因を解明することができる。
その他の身体的徴候や症状は、心停止の潜在的な原因を特定するのに役立つ[59]。以下は、臨床所見とヒトが示す可能性のある徴候・症状と、それらに関連する可能性のある原因の表である。
| 場所 | 所見 | 考えられる原因 |
|---|---|---|
| 全身 | 皮膚蒼白 | 出血 |
| 体温が低い | 低体温症 | |
| 気道 | 分泌物、吐物、血液 | 誤嚥 |
| 陽圧換気困難 | 緊張性気胸 気道閉塞 | |
| 首 | 頚静脈怒張 | 緊張性気胸 |
| 気管偏位 | 緊張性気胸 | |
| 胸 | 胸骨中央の手術痕 | 心疾患 |
| 肺 | 呼吸音の一側減弱 | 緊張性気胸 誤嚥 |
| 呼吸音が聞こえない、もしくは聞こえにくい | 食道挿管 気道閉塞 | |
| 呼気性喘鳴(Wheezing) | 誤嚥 | |
| 湿性ラ音(Crackles) | 誤嚥 肺水腫 | |
| 心臓 | 心音減弱 | 循環血液量減少(Hypovolemia) 心タンポナーデ 緊張性気胸 肺塞栓 |
| 腹部 | 腹部膨満 | 腹部大動脈瘤破裂 子宮外妊娠からの腹腔内出血 |
| 膨満しており、鼓音を聴取する。 | 食道挿管 | |
| 直腸 | 下血 | 消化管出血 |
| 四肢 | 脈拍の強さが左右で異なる | 大動脈解離 |
| 皮膚 | 注射痕 | 薬物乱用 |
分類
臨床医は心電図波形によって心停止を「ショック可能」と「ショック不可能」に分類する。これは、特定のクラスの心不整脈が除細動で治療可能かどうかを意味する[99]。「ショック可能」な2つのリズムは心室細動と無脈性心室頻拍であり、「ショック不可能」な2つのリズムは心静止と無脈性電気活動(Pulseless electrical activity: PEA)である[102]。
予防
心停止後は良好な転帰が得られないことから、心停止を予防するための効果的な戦略の開発に努力が払われてきた。心停止の主な原因が虚血性心疾患であることから、健康的な食事、運動、喫煙中止を推進する取り組みが重要である[5]。心臓病のリスクのある人には、血圧のコントロール、コレステロールの低下、その他の薬物治療的介入が行われる。 2016年に発表されたコクラン・レビューでは、血圧降下薬は心臓突然死のリスクを減少させないことを示す中程度の質のエビデンスが見いだされた[103]。運動は、一般集団では心停止の効果的な予防策であるが、持病のある人にはリスクがあるかもしれない[104]。心臓疾患のある人では、運動中や運動直後に一過性の破局的心イベントのリスクが増加する[104]。定期的に運動を行っている心臓病患者では、心停止の生涯および急性期のリスクが減少しており、おそらく運動の有益性がリスクを上回っていることを示唆している[104]。
食事
2021年にJAMA誌に発表された研究によると、食事は心臓突然死の発生率を低下させる修正可能な危険因子である可能性がある[105]。この研究では、「添加脂肪、揚げ物、卵、内臓肉、加工肉、砂糖入り飲料」を摂取する「南部型食生活」に該当する人は、心停止リスクの上昇と正の関係があり、「地中海食」を実践しているとみなされる人は、心停止リスクに関して逆の関係があることがわかった[105]。アメリカ心臓協会も、心血管疾患の予防を目的とした食事を推奨している[106]。
さらに、海洋由来のオメガ3多価不飽和脂肪酸(polyunsaturated fatty acids: PUFA)は、血中トリグリセリド値を下げ、不整脈を予防し、血小板凝集を減少させ、血圧を低下させる能力があると仮定されているため、心臓突然死を予防するために推進されている[107]。一方、2012年に発表されたシステマティック・レビューによると、オメガ3系PUFAの補給は心臓突然死のリスク低下とは関連していない[108]。
コードブルー
コード・ブルーとは、医療機関において、心停止などの緊急事態に陥った患者の蘇生のために行われる、医療スタッフや必要な機器の召集要請である[109][110]。呼び方は病院によってさまざまで、「ハリーコール」、「スタットコール」などとも呼ばれる。英語圏の病院では、心停止は単に「コード」とも呼ばれるが、これは通常、病院内緊急コード(hospital emergency codes)のコード・ブルーを指す[111]。心停止に対する治療は、「コードを呼ぶ」と呼ばれることもある[112][注釈 4]。
一般病棟の患者は、心停止が起こるまでに数時間から数日間の悪化の経過を辿ることが多い[99][113]。この原因は、病棟スタッフの知識と技術不足、特に呼吸数の測定漏れにあるとされている。呼吸数は、心停止の48時間以内に変化することが多く、病状悪化の主な予測因子である[99]。これを受けて、現在では多くの病院で病棟スタッフに対する研修が強化されている。また、バイタルサインをもとに患者の悪化リスクを定量化し、スタッフに行動指針を与えることを目的とした「早期警告」システムも数多く存在する。
さらに、病棟レベルですでに行われている仕事を補強するために、専門スタッフがより効果的に活用されている。以下のようなものがある。
- コードブルーチーム(またはクラッシュチーム)- これは、蘇生に関する特別な専門知識を持つ選ばれたスタッフで、病院内のすべての心停止現場に招集される。通常、救急カート(crash cart)と呼ばれる機器(除細動器を含む)と薬剤を積んだ専用のカートを使用する。
- 救急医療チーム(Medical emergency team: MET) - このチームは、心停止を防ぐために、病気の急性期にある人々を治療することを目的として、あらゆる緊急事態に対応する。これらのチームは、院内心停止(IHCA)の発生率を低下させ、生存率を向上させることがわかっている[9]。
- クリティカルケアアウトリーチ - 上記の2つのタイプのチームのサービスを提供することに加え、このチームは非専門医のスタッフを教育する役割をも担っている。さらに、集中治療室/ハイケアユニットと一般病棟との間の移動の円滑化にも貢献する。これは特に重要である。多くの研究によると、重症ケアユニットから退室した患者の数%が、すぐに悪化して再入室することがわかっているからである[114]。
植込み型除細動器
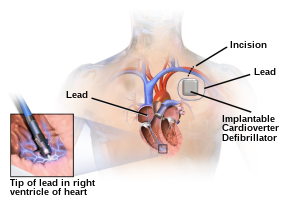
植込み型除細動器(ICD)は、心臓の電気的活動を監視し、不整脈が検出されると電気ショックを与えて異常なリズムを停止させることができる電池内臓の装置である。ICDは、心室細動または心室頻拍による突然の心停止(SCA)の既往を有する患者の心臓突然死(SCD)を予防するために使用される(二次予防)[115]。ICDはまた、特定の高リスク患者集団における心臓突然死を予防するためにも、予防的に使用される(一次予防)[116]。
心臓突然死の二次予防におけるICDの使用に関しては、数多くの研究が行われている。これらの研究では、抗不整脈薬を使用した場合と比較してICDを使用した場合の生存率の改善が示されている[115]。ICD治療は不整脈による死亡の相対リスクを50%減少させ、全死因死亡の相対リスクを25%減少させる[117]。
高リスク患者集団に対するICD治療による心臓突然死の一次予防も同様に、いくつかの大規模研究で生存率の改善が示されている。これらの研究における高リスク患者集団は,重症虚血性心筋症 (左室駆出率(LVEF)の低下によって決定される)を有する患者と定義された。これらの試験で用いられたLVEFの基準は、30%以下(MADIT-II試験)から40%以下(MUSTT試験)までの範囲であった[115][116]。
治療
突然の心停止は、心肺蘇生を試みることによって治療されることがある。これは通常、一次救命処置(BLS)、二次救命処置(ACLS)、小児二次救命処置(PALS)、新生児蘇生法のガイドラインに基づいて行われる[37][118]。

心肺蘇生法
早期の心肺蘇生(CPR)は、心停止から良好な神経機能で生還するために不可欠である[119][59]。CPRはできるだけ早く開始し、開始後の中断は最小限にとどめることが推奨される。CPRの中で生存率に最も大きな違いをもたらすのは、胸骨圧迫とショック可能な心臓リズムに対する除細動である[47]。除細動後、再度リズムをチェックする前に胸骨圧迫を2分間続ける必要がある[59]。これは、1分間に100~120回の圧迫、胸部で5~6cmの圧迫深度、圧迫の間の十分な胸郭の戻り(Chest recoil)、1分間に10回の人工呼吸を基本としている[59]。正しく行われたバイスタンダーCPRは生存率を高めることが示されている。しかし、2007年の調査では院外心停止に対するCPRの施行率は30%以下であった[120]。質の高いCPRを行っても自己心拍再開(return of spontaneous circulation: ROSC)に至らず、心静止のままである場合、心肺蘇生を中止して死亡を宣告するのは、一般的に20分後が妥当である[121]。ただし、低体温症や溺水の場合は例外である[47][121]。このようなケースでは、ほぼ正常体温になるまで、より長く、より持続的に心肺蘇生を行うべきである[47]。病院内で心停止した場合は、より長時間の心肺蘇生が妥当である可能性がある[122]。救急隊が到着する前に、一般の人が心肺蘇生を行うことも予後を改善する[9]。
嘔吐や逆流がよく起こる(特に院外心停止)ため、呼吸を助けるためにバッグバルブマスクを使用したり、高度な気道確保を行って良い[123][124][125]。このような場合は、喉頭鏡と吸引による気道浄化(Suction Assisted Laryngoscopy Airway Decontamination)など、既存の中咽頭吸引法の変更 が必要になることもある[126]。心肺蘇生中は一般に高濃度の酸素を投与する[123]。気管挿管は心停止時の生存率や神経学的転帰を改善することは認められておらず[120][127]、病院前救護ではむしろ悪化させる可能性がある[128]。気管チューブと声門上エアウェイは同様に有用である[127]。救急隊員が行う場合は、胸骨圧迫を続けながら呼吸を行うよりも、30回の圧迫の後に2回の呼吸を行うほうがよいようである[129]。
バイスタンダー(市民救護者)にとっては、心臓の問題で心停止に陥った患者に対する心肺蘇生法は、標準的な心肺蘇生法に比べ、胸骨圧迫のみを行う心肺蘇生法の方が良い結果をもたらす[129]。患者に呼吸を提供する手段としての口対口人工呼吸(mouth-to-mouth ventilation)は、患者から感染症に感染する危険性があるため、廃止されつつある[130]。機械による胸骨圧迫は、手で行う胸骨圧迫よりは劣る[123]。除細動の前に数分間の心肺蘇生を行うことで、すぐに除細動を行うのと異なる結果が得られるかどうかは不明である[131]。心停止が妊娠20週以降に起こった場合は、心肺蘇生中に子宮を患者の身体の左側に引くか押すべきである(仰臥位低血圧症候群の軽減)[132]。4分までに脈が戻らない場合は、緊急帝王切開が勧められる[132]。これは死戦期帝王切開と呼ばれる[133]。
自動体外式除細動器

除細動は、電気ショック可能な心リズムが存在する場合に適応となる。ショック可能な2つのリズムとは、心室細動と無脈性心室頻拍である。小児では2~4J/Kgの電気ショックが推奨される[134]。
院外心停止では、自動体外式除細動器(AED)により除細動が行われる。自動体外式除細動器(AED)は、誰でも使用できる携帯型の機械であり、除細動の手順の音声指示を提供し、負傷者の状態を自動的にチェックし、適切な電気ショックを加える。除細動器の中には、心肺蘇生法の圧迫の質をフィードバックし、素人の救助者に胸を強く押して血液を循環させるよう促すものもある[135]。
さらに、公共利用可能なAEDも増えている。これは、公共の場所にAEDを設置し、その場所のスタッフに使い方をトレーニングするものである。これにより、救急隊が到着する前に除細動を行うことができ、生存の可能性が高まることが示されている。人里離れた場所で心停止を起こした人は、心停止後の転帰が悪いことが示されている[136]。
薬剤
2016年現在、アドレナリン注射薬以外の薬物療法は、ガイドラインには含まれているものの、病院外心停止後の退院までの生存率を改善することは示されていない[47]。これにはアトロピン、リドカイン、アミオダロンの使用が含まれる[47][137][138][139][140][141]。2019年現在、成人におけるアドレナリンは生存率を改善するようだが、神経学的に正常な生存率を改善するようには見えない[142][143][144]。一般に3~5分ごとの投与が推奨されている[123]。アドレナリンはα1受容体に作用し、心臓に供給される血流を増加させる[145]。これは心臓により多くの酸素を供給する助けとなる。2019年のガイドラインに基づくと、アドレナリン1mgを3~5分ごとに患者に投与してもよいが、アドレナリン1mgより多い量を心停止にルーチンに使用することは推奨されない。非ショック性リズムの患者には、アドレナリンをできるだけ早く投与すべきである。ショック可能なリズムの場合、アドレナリンは最初の除細動を試みた後にのみ投与すべきである[146]。バソプレシンはアドレナリンと比較して転帰を改善することも悪化させることもない[123]。アドレナリン、バソプレシン、メチルプレドニゾロンの併用は転帰を改善するようである[147]。長期的な有益性の欠如の一部は、アドレナリン使用の遅れに関連している可能性がある[148]。小児におけるアドレナリンの使用を支持するエビデンスはないが、ガイドラインではその使用は妥当であるとしている[47][134]。ショック可能なリズムを有する小児の心停止では、リドカインとアミオダロンも妥当とされている[123][134]。炭酸水素ナトリウムやカルシウムの一般的な使用は推奨されていない[123][149]。小児へのカルシウムの使用は、生存率の低下だけでなく、神経機能の低下とも関連している[59]。小児における薬剤の正しい投与量は体重に左右される[59]。投薬量の計算にかかる時間を最小限にするため、小児救急用テープ(Broselow tape) の使用が推奨されている[59]。
アメリカ心臓協会(AHA)の2010年ガイドラインでは、無脈性電気活動および心静止にアトロピンを使用する推奨はなくなった。アトロピンの使用を支持するエビデンスがないためである[47][150]。除細動を行っても心室頻拍や心室細動が続く場合、リドカインもアミオダロンも、入院までの生存率はどちらも同様に改善するが、退院までの生存率は改善しない[151]。
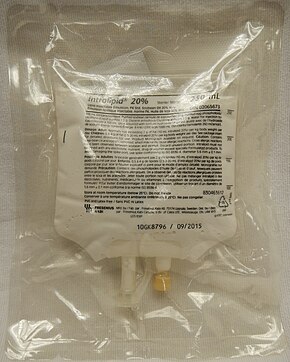
血栓溶解薬は害を及ぼす可能性があるが、肺塞栓症が心停止の原因として確認された場合には有益である[132][152]。オピオイドによる心停止に対するナロキソンの使用に関するエビデンスは不明であるが、それでも使用してよい[132]。局所麻酔薬による心停止では、脂肪乳剤(lipid emulsion) [注釈 5]を使用してもよい[132]。
体温管理療法
現在の国際的なガイドラインでは、心停止後の成人の冷却には、以前は脳低温療法として知られていた体温管理療法を行うことが推奨されている[154]。通常、目標体温は32~36℃(90~97°F)で、24時間冷却する[155]。体温を下げるには、氷嚢や冷水循環パッドを体に直接当てたり、冷たい生理食塩水を輸液したりする方法がある。その後、12~24時間かけて徐々に再加温する[156]。
院外心停止後の 体温管理療法 の有効性は現在も議論がある。院外心停止後の病院前での体温管理療法は有害転帰のリスクを高めることが示されている[154]。再心停止率は、病院前の体温管理療法を受けた人のほうが高いかもしれない[154]。また、体温管理療法が死亡率や神経学的転帰を改善することは認められていない。さらに、体温管理療法が心停止後の生存者に神経学的な悪影響を及ぼす可能性があるとする報告もある[157]。
蘇生措置拒否
終末期における積極的な処置を避けることを選択する人もいる。事前のリビング・ウィルの形で蘇生措置拒否(DNR:do not resuscitate order)を残すことで、心停止の際に心肺蘇生を望まないことを明確にすることができる[158]。その他に、呼吸不全時の気管挿管を希望するかどうか、安楽死しか望まない場合は医療従事者による「自然な死」を認めてもらうことも規定できる[159]。
救命の連鎖
いくつかの組織が、「救命の連鎖」という考え方を推進している。この連鎖は、以下の「リンク」で構成されている。それは、心停止の予防、早期認識と通報、一次救命処置、二次救命処置、そして蘇生後の治療等で構成される[36][160]。救命の連鎖は対象が成人であるか、小児か、どの蘇生プロトコールに則るか、などで多少異なるものの、これらの蘇生に関連する行為を中断時間を最小にして継続するという概念は共通している[36][161][162][160]。
- 早期発見。可能であれば、心停止に至る前に病気に気づくことで、救助者は心停止の発生を防ぐことができる。心停止が発生したことを早期に認識することが生存の鍵であり、患者が心停止状態に1分とどまるごとに、生存の可能性はおよそ10%低下する[99]。
- 早期の心肺蘇生によって、血液の流れが改善され、重要な臓器に酸素が供給されるようになる。これは心停止治療の重要な要素である。特に、脳に酸素を含む血液を供給し続けることで、神経障害の可能性が減少する。
- 早期の除細動は、心室細動や無脈性心室頻拍の管理に有効である[99]。
- 早期の高度医療。
- 早期の蘇生後の治療。経皮的冠動脈インターベンションを含むこともある[163]。
この連鎖の1つ以上のリンクが欠落したり遅れたりすると、生存の可能性は著しく低下する。病院内では、これらのプロトコルは、通常、心停止や呼吸不全の切迫した、あるいは急性の発症を示すコード・ブルーによって開始されることが多い[164]。
その他の治療法
体外式膜型人工肺(ECMO)による蘇生も試みられており、最も恩恵を受けると思われる集団では、院外心停止(生存率4%)よりも院内心停止(生存率29%)の方が良好な結果が得られている[165]。院外心停止から生還した患者に対する心臓カテーテル治療は、質の高いエビデンスはないが、転帰を改善するようである[166]。基礎に心臓疾患があり心電図上のST上昇心停止を起こした場合は、できるだけ早く行うことが推奨される[123]。
除細動器がすぐに使用できない場合、目撃・監視された不安定な心室頻拍(無脈性心室頻拍を含む) の場合は前胸部叩打を考慮してもよいが、心肺蘇生とショック伝達を遅らせたり、目撃者の居ない院外心停止の場合は行うべきではない[167]。
予後
病院外で心停止した人の生存率は全体で10%である[168][169]。院外心停止患者のうち、70%は自宅で発症し、その生存率は6%である[170][171]。院内心停止の場合、少なくとも心停止発生から1年間の生存率は13%と推定される[172]。1年生存率は、非心原性心停止と診断された人(11%)に比べ、心原性心停止と診断された人(39%)で高いと推定される[172]。小児の生存率は北米では3~16%である[173]。院内心停止では、退院までの生存率は約22%である[47][174]。心拍再開し、搬送入院まで生存した患者は、心停止後症候群(Post-Cardiac Arrest Syndrome)を呈することが多い。その症状は、軽度の記憶障害から昏睡に至ることもある[47]。
低酸素性虚血性脳損傷は、心停止を起こした人にとって最も有害な転帰である[175]。心停止後の神経学的転帰の悪さは、生命維持装置の差し控えを行わない国(約50%)では、差し控える国(10%未満)に比べてはるかに多い[175]。認知機能の改善は、心停止後最初の3ヵ月間にほとんど起こり、心停止後1年まで改善を報告する人もいる[175]。心停止生存者の50~70%が症状として疲労を報告しており、疲労は患者が報告する症状の中で最も多い[175]。
予後は通常、心停止後72時間以上経過してから評価される[176]。生存率は、倒れるのを目撃した人がいた人、バイスタンダーCPRを受けた人、および/または評価時に心室細動または心室頻拍のいずれかを有していた人の方が高い[177]。心室細動または心室頻拍のある人の生存率は15~23%である[177]。女性は男性よりも心停止から生還し退院する可能性が高い[178]。
1997年のレビューでは、退院までの生存率は14%であったが、研究間では0~28%と幅があった[179]。入院中に心停止を起こした70歳以上の患者では、退院までの生存率は20%未満である[180]。このような人たちが退院後どの程度管理できているかは明らかではない[180]。
心肺蘇生を受けて院外心停止から回復できた人の世界的な割合は約30%で、退院までの生存率は9%と推定されている[181]。退院までの生存率は、心停止がバイスタンダーまたは救急隊によって目撃された人、バイスタンダーCPRを受けた人、ヨーロッパと北米に住む人でより高い[181]。アジア諸国では、退院までの生存率が比較的低いことが観察されている[181]。
疫学
心停止のリスクは地域、年齢、性別によって異なる。フラミンガム心臓研究の解析によると、生涯リスクは男性(12.3%)が女性(4.2%)の3倍である[182]。この性差は85歳を超えると消失する[183]。これらの人の約半数は65歳未満である[184]。
北米
死亡診断書によると、心臓突然死は米国における全死亡の約20%を占める[185]。米国では、年間約326,000例の院外心停止および209,000例の院内心停止が成人で発生しており、これは成人10万人あたり年間約110.8例の発生率である[9][47][185]。米国では、妊娠中の心停止は約1万2,000件に1件、出生1万件に1.8件である[132]。カナダではもっと低い[132]。
日本
日本では全国の救急隊員が搬送した心停止患者数は総計129144人であり、うち一般市民が目撃した心原性心停止は26500人(2021年)であった[186]。その57.5%に対して一般市民による心肺蘇生が行われ、うち、1096人にAEDが用いられた[186]。AED使用者数の40.1%が一ヶ月後に社会復帰していた[186]。
他の地域
非西洋地域では発生率が異なる。中国の心臓突然死の発生率は10万人あたり41.8人であり、南インドでは10万人あたり39.7人である[185]。
社会と文化
呼称について
多くの出版物において、「心臓突然死」の明確な、または暗黙の意味は、心臓の原因による突然死である[187]。たとえ生存していても、心停止を「心臓突然死」と呼ぶ医師もいる。そのため、生きている人の「心臓突然死の過去のエピソード」についての言及を耳にすることがある[188]。
2021年、アメリカ心臓協会は、「心臓発作」がしばしば心停止を表すのに誤って用いられることを明らかにした[189]。心臓発作は血液供給が途絶えた結果、心臓の筋肉組織が死滅することを指すが、心停止は心臓の伝導系が機能不全に陥ったときに起こる[189]。さらに、アメリカ心臓協会は、「迅速に是正措置を講じなければ、この状態は突然死に進行する。心停止は、上記のような事象を意味し、通常、心肺蘇生および/または除細動、または心臓ペーシングによって回復する場合に使用されるべきである。心臓突然死は、致死的でない事象を表すために使用してはならない」と説明している[189]。
日本では心停止は心肺停止(CPA)と同義と見なされることが多いが[14][190]、国際的には心停止と呼称するのが一般的とされている[14]。
スローコード
「スローコード」とは、心肺蘇生が医学的に有益でないと考えられる場合に、心停止状態にある人に中途半端な心肺蘇生を行うことを指す俗語である[191]。「ショーコード」とは、患者の家族のために蘇生しているフリをすることである[192]。
このような行為は倫理的に論議を呼び[193]、一部の地域では禁止されている。ヨーロッパ蘇生協議会ガイドラインは2021年、臨床医が「スローコード」に参加/関与することは推奨されないとの声明を発表した[191]。アメリカ内科学会によれば、中途半端な蘇生処置は人を欺くものであり、医師や看護師が行うべきでないとする[194]。
脚注
注釈
出典
参考文献
- Mann, Douglas L.; Zipes PL; Libby P; Bonow RO; Braunwald E (2015). Braunwald's Heart Disease: A Textbook of Cardiovascular Medicine (Tenth ed.). Philadelphia, PA: Saunders. ISBN 978-1-4557-5134-1. OCLC 881838985
関連項目
外部リンク
| 分類 | |
|---|---|
| 外部リソース(外部リンクは英語) |






