Калај(II) оксид
Калај(II) оксид (стан оксид) е соединение со формулата SnO. Составен е од калај и кислород каде што калајот има состојба на оксидација од +2. Постојат две форми, стабилна сино-црна форма и метастабилна црвена форма.
 | |
 | |
 | |
Назив според МСЧПХ Калај(II) оксид | |
Други називи Стан оксид, Калај моноксид | |
| Назнаки | |
|---|---|
| 21651-19-4 | |
| EC-број | 244-499-5 |
МХН
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 88989 |
| RTECS-бр. | XQ3700000 |
| |
| UNII | JB2MV9I3LS |
| Својства | |
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | црн или црвен прав кога е безводен, бел кога е хидриран |
| Густина | 6,45 g/cm3 |
| Точка на топење | |
| нерастворлив | |
Магнетна чувствителност (χ) | −19,0·10−6 cm3/mol |
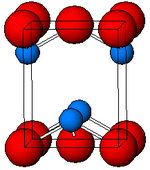
| Структура | |
| Кристална структура | тетрагонал |
| Термохемија | |
| Ст. енталпија на формирање ΔfH | −285 kJ·mol−1[1] |
| Стандардна моларна ентропија S | 56 J·mol−1·K−1[1] |
| Опасност | |
| Температура на запалување | {{{value}}} |
| NIOSH (здравствени граници во САД): | |
PEL (дозволива) | 0[2] |
REL (препорачана) | TWA 2 mg/m3[2] |
IDLH (непосредна опасност) | N.D.[2] |
| Безбедносен лист | ICSC 0956 |
| Слични супстанци | |
| Други анјони | Tin sulfide Tin selenide Tin telluride |
| Други катјони | Carbon monoxide Silicon monoxide Germanium(II) oxide Lead(II) oxide |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Подготовка и реакции

Сино-црниот SnO може да се произведе со загревање на калај (II) оксид хидрат, каде SnO·xH2O (x<1) се таложи кога солта на калај(II) ќе реагира со алкален хидроксид како на пр. NaOH.[3]
Метастабилниот, црвен SnO може да се подготви со нежно загревање на талогот произведен од дејството на воден амонијак на калај(II) солта.[3]
SnO може да се подготви како чиста супстанција во лабораторија, со контролирано загревање на калај(II) оксалат (стан оксалат) во отсуство на воздух или под CO2 атмосфера. Овој метод се применува и за производство на железен оксид и манган оксид.[4][5]
- SnC2O4·2H2O → SnO + CO2 + CO + 2 H2O
Калај (II) оксид гори во воздух со слаб зелен пламен за да формира SnO2.[3]
- 2 SnO + O2 → 2 SnO2
Кога се загрева во инертна атмосфера првично се јавува диспропорционално давајќи Sn метал и Sn3O4 што дополнително реагира и дава SnO2 и Sn метал.[3]
- 4SnO → Sn3O4 + Sn
- Sn3O4 → 2SnO2 + Sn
SnO е амфотеричен, се раствора во силна киселина за да се добијат калај(II) соли и во силна база за да се добијат станити кои содржат Sn(OH).3-.[3] Може да се раствори во раствори на силна киселина за да се добијат јонските комплекси Sn(OH2)32+ и Sn(OH)(OH< sub>2)2+, а во раствори со послаби киселини се добива Sn3(OH)42+.[3] Забележете дека безводните станити, на пр. K2Sn2O3, K2SnO2 се исто така познати.[6][7][8]SnO е редукционо средство и се смета дека го редуцира бакарот(I) во метални кластери во производството на таканареченото „бакарно рубин стакло“.[9]
Структура
Црниот, α-SnO ја прифаќа тетрагоналната структура на слојот PbO која содржи четири координатни квадратни пирамидални атоми на калај.[10] Оваа форма се наоѓа во природата како редок минерал ромархит.[11] Асиметријата обично едноставна и се припишува на стерично активенот пар; сепак, пресметките на густината на електроните покажуваат дека асиметријата е предизвикана од антиврзувачка интеракција на орбиталите Sn(5s) и O(2p).[12] Електронската структура и хемијата на активниот пар ги одредуваат повеќето својства на материјалот.[13]
Не-стехиометрија е забележана кај SnO.[14]
Електронскиот јаз на опсегот е измерен помеѓу 2,5eV и 3eV.[15]
Употреба
Доминантната употреба на калај оксидот е како претходник во производството на други, типично двовалентни, калајни соединенија или соли. Стан оксидот, исто така, може да се користи како средство за намалување и во создавањето на стакло од рубин.[16] It has a minor use as an esterification catalyst.
Цериум(III) оксидот во керамичка форма, заедно со калај(II) оксид (SnO) се користи за осветлување со УВ светлина.[17]