Лимонная кислота
Лимо́нная кислота́ (химическая формула — C6H8O7) — органическая кислота средней силы, относящаяся к классу предельных карбоновых кислот.
| Лимонная кислота | |
|---|---|
  | |
 | |
| Общие | |
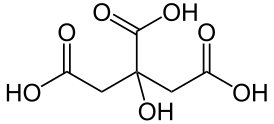
| Систематическое наименование | 3-гидрокси-3-карбоксипентандиовая кислота |
| Традиционные названия | Лимонная кислота |
| Хим. формула | C6H8O7 |
| Рац. формула | HOOC-CH2-C(OH)COOH-CH2COOH |
| Физические свойства | |
| Молярная масса | 192,12532 г/моль |
| Плотность | 1,665 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 153 °C |
| • разложения | 175 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 3,128 4,761 6,388 (25°C) |
| Растворимость | |
| • в воде | 133 г/100 мл |
| Классификация | |
| Рег. номер CAS | 77-92-9 |
| PubChem | 311 |
| Рег. номер EINECS | 201-069-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E330 |
| RTECS | GE7350000 |
| ChEBI | 30769 |
| Номер ООН | 1789 |
| ChemSpider | 305 |
| Безопасность | |
| Краткие характер. опасности (H) | H319 |
| Меры предостор. (P) | P264, P280, P305+P351+P338, P337+P313 |
| Сигнальное слово | осторожно |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
При стандартных условиях лимонная кислота — трёхосновная карбоновая оксикислота, представляющая собой кристаллическое вещество белого цвета.
Открытие
Открытие лимонной кислоты приписывают арабскому алхимику Джабиру ибн Хайяну. Выделить её впервые удалось шведскому аптекарю Карлу Шееле. В 1784 году он осадил её в виде цитрата кальция из лимонного сока.
В 1838 году Юстус фон Либих установил, что в молекуле лимонной кислоты присутствует одна гидроксильная группа и три карбоксильные группы. Собственно лимонная кислота в чистом виде была получена из цитрата кальция в 1860 году в Англии[1][2].
Физические свойства

Систематическое название: 2-гидроксипропан-1,2,3-трикарбоновая кислота или 3-гидрокси-3-карбоксипентандиовая кислота
Рациональная формула: HOOC-CH2-C(OH)COOH-CH2COOH или (HOOCCH2)2C(OH)COOH
Хорошо растворима в воде, растворима в этиловом спирте, малорастворима в диэтиловом эфире. Соли и сложные эфиры лимонной кислоты называют цитратами.
Лимонная кислота представляет собой кристаллическое вещество белого цвета, без запаха и имеющее сильный кислый вкус. Ниже 36,6 °С она кристаллизуется из водного раствора в виде моногидрата, который имеет плотность 1,542 г/см3 и плавится при 100 °С. Его кристаллы имеют орторомбическую сингонию. Безводная лимонная кислота имеет относительную плотность 1,665 г/см3 и плавится при 153 °С.
Моногидрат кристаллизуется в моноклинной сингонии. Перевести моногидрат в безводную форму можно в вакууме в присутствии серной кислоты. В безводном виде гигроскопична и поглощает влагу из воздуха[3].
Химические свойства
При нагревании выше 175 °C лимонная кислота переходит в аконитовую кислоту, а при сухой перегонке отщепляется вода и декарбоксилируется, одновременно образуя ацетон, и даёт ангидриды итаконовой и цитраконовой кислот. Окисление перманганатом калия при 35 °С приводит к ацетондикарбоновой кислоте, а при 85 °С — к щавелевой кислоте.

 — недиссоциированная молекула;
— недиссоциированная молекула; — однозарядный ион;
— однозарядный ион; — двухзарядный ион;
— двухзарядный ион; — трёхзарядный ион
— трёхзарядный ионЛимонная кислота является трёхосновной кислотой средней силы, образует три ряда солей, в растворе подвергается многоступенчатой электролитической диссоциации. Константы диссоциации равны:
| Кa (18 °C)[3] | Ka (25 °C)[4] | |
|---|---|---|
| К1 | 8,2⋅10−4 | 1,3⋅10−3 |
| K2 | 1,8⋅10−5 | 5,8⋅10−4 |
| K3 | 4,0⋅10−6 | 2,4⋅10−6 |
В водном растворе лимонная кислота образует хелатные комплексы с ионами кальция, магния, меди, железа и другими. Иногда в комплексообразовании участвует не одна молекула лимонной кислоты[5].
Лимонная кислота образует сложные эфиры со спиртами в присутствии обычных кислотных катализаторов (серная кислота, пара-толуолсульфокислота, ионообменные смолы) либо без катализатора (с высококипящими спиртами). Некоторые эфиры, например, Триметилцитрат, триэтилцитрат и трибутилцитрат используются в качестве пластификаторов. С двухатомными и многоатомными спиртами лимонная кислота образует полиэфиры[6].
Гидроксильная группа лимонной кислоты при обработке хлорангидридами органических кислот и ангидридами кислот может участвовать в образовании сложных эфиров, а также взаимодействует с эпоксидами[6].
Получение
В промышленности
С середины 1800-х годов лимонную кислоту получали исключительно из сока недозревших лимонов, смешивая его с негашёной известью и осаждая таким образом плохорастворимый цитрат кальция. Обработка цитрата кальция серной кислотой приводит к образованию осадка сульфата кальция, а из надосадочной жидкости кристаллизацией выделяли лимонную кислоту. Выход такого процесса составлял 2—3 масс. % от сухой массы фруктов[6]. В литературе упоминается, что лимонную кислоту в виде кальциевой соли развозили из Сицилии и Южной Италии к местам потребления (преимущественно в Англию, Францию и США), а саму кислоту выделяли уже на месте[7].
В 1893 году был обнаружен первый ферментативный метод получения лимонной кислоты: немецкий химик и миколог Карл Вемер использовал для этого плесневые грибы рода пеницилл. Однако внедрить метод в промышленность не удавалось из-за проблем с очисткой продукта. Успех был достигнут лишь в 1919 году, когда ферментативный процесс был организован в Бельгии. Перевес в пользу ферментативного получения произошёл после Первой мировой войны, когда возникли проблемы с поставкой лимонной кислоты из Италии, а мировые потребности всё более нарастали. В 1923 году фирма Пфайзер коммерциализировала открытый ранее Джеймсом Карри и Чарлзом Томом процесс превращения углеводов в лимонную кислоту под действием плесневых грибов вида Aspergillus niger в присутствии небольшого количества неорганических солей[7].
По состоянию на начало ХХІ века весь объём промышленной лимонной кислоты производится биосинтезом. В качестве сырья используют гидролизат кукурузы (в Северной и Южной Америке и Европе), гидролизат маниока, батата и кукурузы (в Азии), кристаллическую сахарозу (в Южной Америке) и мелассу (в Азии и Европе). В некоторых случаях лимонную кислоту получают из сельскохозяйственных отходов[6].
Этот процесс используется с 1930-х годов. Теоретически, из 100 кг сахарозы можно получить 123 кг моногидрата лимонной кислоты либо 112 кг безводной лимонной кислоты. Фактически выход ниже, так как грибки потребляют часть сахарозы для собственного роста и дыхания. Реальный выход составляет от 60 до 85 % от теоретического. Ферментативный процесс можно проводить в трёх типах:
- твердофазная ферментация;
- поверхностная ферментация;
- глубинная ферментация[8].
При твердофазной ферментации сырьё помещается в желоба́ и смачивается водой. При необходимости в воду добавляют питательные вещества, и затем туда помещают грибковую культуру. После окончания процесса лимонную кислоту вымывают водой, выделяют из раствора и очищают.
Поверхностную ферментацию проводят на специальных лотках, куда помещают субстрат и некоторые неорганические питательные вещества. pH среды регулируют в диапазоне 3—7 в зависимости от вида субстрата, затем проводят стерилизацию и устанавливают необходимую температуру. Затем на лотки наносят культуру грибков, которые размножается и покрывает всю поверхность субстрата, после чего начинается образование лимонной кислоты. По окончании процесса из жидкости выделяют лимонную кислоту.
Глубинная ферментация проводится в больших ёмкостях в два этапа. Сначала 10 % субстрата ферментируют в течение 1 дня в качестве затравки, после чего смесь добавляют в основную массу и ферментируют в течение 3—7 дней. Процесс проводится при постоянной продувке жидкости воздухом с помощью компрессора[8].
После ферментации жидкость фильтруют через мембрану и отделяют лимонную кислоту от белков и остаточных углеводов негашёной известью, экстракцией или хроматографией. По первому, наиболее распространённому способу, лимонная кислота осаждается в виде кальциевой соли, которую затем обрабатывают серной кислотой, получая нерастворимый гипс и раствор очищенной лимонной кислоты. Второй способ основан на использовании специфичного растворителя, в котором лимонная кислота растворяется лучше, чем примеси.
Хроматографическая очистка основана на использовании анионитов: лимонная кислота сорбируется на носителе, а затем вымывается из сорбента разбавленной серной кислотой[9].
После выделения проводят очистку. Для этого загрязнённую лимонную кислоту обрабатывают активированным углём для удаления окрашенных примесей, пропускают через слой ионообменных смол для удаления растворимых солей, фильтруют от нерастворимых примесей и кристаллизуют[8].
В 2012 году мировой объём производства лимонной кислоты составил приблизительно 1,6 млн тонн, из них примерно 0,8—0,9 млн тонн произведено в Китае. Около 70 % от общего производства используется в пищевой промышленности[8].
В России 15 тыс. тонн лимонной кислоты ежегодно производил Белгородский завод лимонной кислоты «Цитробел», но он был закрыт в 2020 году[10]. После закрытия завода Россия ежегодно импортирует около 60 тыс. тонн лимонной кислоты, в основном из Китая. В 2022 году появились сообщения о строительстве двух новых заводов общей производительностью 158 тыс. тонн лимонной кислоты[11].
Лабораторный синтез
В классическом лабораторном синтезе лимонной кислоты в качестве исходного вещества применяют ацетон, который бромируют по метильным группам, затем производят реакцию с циановодородом и гидролизуют[6].
Полный синтез
Впервые лимонную кислоту химическим синтезом получили Гримо (Grimaux) и Адам (Adam) в 1880 году. Исходным соединением в этом синтезе послужил глицерин. Первичные гидроксильные группы молекулы глицерина сначала замещали на атомы хлора, а затем на нитрильные группы, которые при гидролизе давали концевые карбоксильные группы. Вторичную же гидроксильную группу окисляли до кетогруппы, к которой затем присоединяли циановодород; полученный циангидрин также при гидролизе давал карбоксильную группу[12].

Другой подход был предложен в 1890 году. Он был основан на превращении ацетоуксусного эфира, который хлорировали, как предполагалось, по концевому α-положению, затем вводили в то же положение нитрильную группу, которую в итоге гидролизовали до карбоксильной группы. На последней стадии создавали заместители при атоме С2, получая циангидрин и гидролизуя его в кислой среде. Схема этого полного синтеза была подвергнута сомнению: некоторые химики, например, Шарль Прево, высказали предположение, что хлорируется не концевое α-положение ацетоуксусного эфира, а среднее, из-за чего образуется не сама лимонная кислота, а её изомер. Дискуссия, как предполагается, возникла из-за того, что в конце XIX в. ещё не существовало спектроскопических методов, которые позволили бы заметить эту разницу[13].

В 1891 году лимонную кислоту получили присоединением синильной кислоты к моноэтиловому эфиру ацетондикарбоновой кислоты с последующим гидролизом. Правда, само исходное вещество было изначально получено из лимонной кислоты[14].

В 1897 году был предложен подход к синтезу лимонной кислоты, основанный на недавно открытой реакции Реформатского (1895). Согласно этому методу, в реакцию вводились этилбромацетат и диэтилоксалоацетат в присутствии цинка[15].

Из более поздних подходов можно отметить предложенное в 1973 году превращение щавелевоуксусной кислоты, которая при самоконденсации с декарбоксилированием давала цитроилмуравьиную кислоту. Последнюю затем в присутствии пероксида водорода или трет-бутилгидропероксида превращали в лимонную кислоту[16][17].

В 1980 году лимонную кислоту получили по реакции конденсации 3-метилбутен-3-ола-1 и формальдегида с последующим окислением полученного продукта диоксидом азота[18][17].

Вместо 3-метиленпентан-1,5-диола аналогичному окислению может быть подвергнут 4-метилентетрагидропиран, являющийся крупнотоннажным побочным продуктом производства изопрена из изобутилена и формальдегида по реакции Принса.
Нахождение в природе
Лимонная кислота содержится в различных фруктах, в большом количестве — в цитрусовых (примерно до 5 % в плодах и до 9 % в соке). В 100 г лайма содержится 7 г лимонной кислоты; лимона — 5,6 г; малины — 2,5 г; чёрной смородины — 1,2 г; помидоров — 1,0 г; ананаса и клубники — 0,6 г; клюквы — 0,2 г; яблока — 14 мг[2].
Лимонная кислота участвует в цикле трикарбоновых кислот — основном процессе дыхания клетки, поэтому в некоторой заметной концентрации она содержится в организме всех животных и растений[2]. Цикл трикарбоновых кислот (цикл лимонной кислоты, или цикл Кребса) является основным химическим механизмом для получения универсального источника АТФ в митохондриях животных и человека.
Применение
Сама кислота, как и её соли (цитрат натрия, цитрат калия, цитрат кальция, дицитрат трикалия висмута), широко используется в качестве вкусовой добавки, регулятора кислотности и консерванта в пищевой промышленности (пищевые добавки E330—Е333), в производстве плавленых сыров, напитков, сухих смесей для приготовления шипучих напитков.
Применяется в медицине, в том числе в составе средств, улучшающих энергетический обмен в цикле Кребса. При приёме внутрь в небольших дозах, например, при употреблении плодов цитрусовых, активирует цикл Кребса в организме, что способствует ускорению метаболизма.
В косметике используется как регулятор кислотности косметических средств, в качестве буферных растворов, хелатирующий агент, в смесях для приготовления «шипучих» ванн.
В нефтяной добыче при бурении нефтяных и газовых скважин используется для снижения pH бурового раствора после щелочных ванн.
В строительстве лимонную кислоту применяют в качестве добавки к цементному и гипсовому растворам для замедления схватывания[19][20].
Лимонная кислота используется для травления слоя меди на печатных платах[21] в смеси с перекисью водорода.
Широко используется в бытовой химии в качестве очистительного средства нагревательных поверхностей, например, от накипи на дне чайника.
Влияние на здоровье
В конце 1970-х годов в Западной Европе получила распространение мистификация, известная как «вильжюифский список», в котором лимонная кислота была названа сильным канцерогеном[22]. В действительности же при пищевом применении лимонная кислота считается безопасной добавкой.
Согласно европейскому законодательству, лимонную кислоту можно использовать в GMP без ограничений. Американская FDA определяет лимонную кислоту как GRAS (англ. generally recognized as safe и признаётся безопасной)[23].
Сухая лимонная кислота и её концентрированные растворы при попадании в глаза вызывают сильное раздражение, при контакте с кожей возможно слабое раздражение. При единовременном употреблении внутрь больших количеств лимонной кислоты возможны раздражение слизистой оболочки желудка, кашель, боль, кровавая рвота. При вдыхании пыли сухой лимонной кислоты — раздражение дыхательных путей[24].
Примечания
Литература
- Лимонная кислота // Культура питания. Энциклопедический справочник / Под ред. И. А. Чаховского. — 3-е издание. — Мн.: «Белорусская энциклопедия имени Петруся Бровки», 1993. — С. 160. — 540 с. — ISBN 5-85700-122-6.
- Apelblat A. Citric Acid. — Springer, 2014. — ISBN 978-3-319-11233-6. — doi:10.1007/978-3-319-11233-6.
- Verhoff F. H., Bauweleers H. Citric Acid (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a07_103.pub3.
- W. M. Haynes. CRC Handbook of Chemistry and Physics (англ.) // 97th ed. — CRC Press, 2016—2017. — P. 5—90.
Ссылки
- Лимонная кислота — обзор рынка, производство
- Лимонная кислота как пищевая добавка
- Волков А. И., Жарский И. М. Большой химический справочник. — Мн.: Современная школа.
- ГОСТ 31726-2012. Добавки пищевые. Кислота лимонная безводная Е330. Технические условия

