صوديوم
الصوديوم هو عنصر كيميائي رمزه Na (من النطرون) وعدده الذرّي 11. ينتمي العنصر فى الجدول الدوري لمجموعة الفلزّات القلوية كثاني عناصر المجموعة الأولى وضمن عناصر الدورة التالتة. الصوديوم فلزّ طري أبيض اللون، يتميّز بنشاطه الكيميائي الكبير لأنه بيتفاعل فى الهوا وبيتحرق بلهب أصفر، وشديد التفاعل مع الماء والرطوبة الجوّية، عشان كده بيتحفظ فى الزيوت أو مشتقّات النفط زي الكيروسين.[ْ 1]
| ||||
|---|---|---|---|---|
 | ||||
| اتسمى باسم | صداع | |||
| المكتشف | همفرى ديفى [1] | |||
| تاريخ الاكتشاف | 1807[1] | |||
| الرمز | Na[2] | |||
| الصيغه | Na | |||
| مواصفات الادخال النصى المبسط للجزيئات | [Na] | |||
| العدد الذرى | ||||
| توزيع الكترونى | 1s² 2s² 2p⁶ 3s¹، و[Ne] 3s¹ | |||
| الكتله | ||||
| السالبيه الكهربيه | ||||
| المعيار الحرارى المولى | ||||
| رمز يونيكود | 鈉[3] | |||
| تعديل | ||||
| |||||||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي الخطوط الطيفية للصوديوم | |||||||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | صوديوم، 11، Na | ||||||||||||||||||||||||||||
| تصنيف العنصر | فلز قلوي | ||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 1، 3، s | ||||||||||||||||||||||||||||
| الكتلة الذرية | 22.98976928 غ·مول−1 | ||||||||||||||||||||||||||||
| توزيع إلكتروني | Ne] 3s1] | ||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2,8,1 (صورة) | ||||||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 0.968 غ·سم−3 | ||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 0.927 غ·سم−3 | ||||||||||||||||||||||||||||
| نقطة الانصهار | 370.87 ك، 97.72 °س | ||||||||||||||||||||||||||||
| نقطة الغليان | 1156 ك، 883 °س | ||||||||||||||||||||||||||||
| النقطة الحرجة | (قيمة حسابية) 2573 ك، 35 ميغاباسكال | ||||||||||||||||||||||||||||
| حرارة الانصهار | 2.60 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| حرارة التبخر | 97.42 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 28.230 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||||||
| أرقام الأكسدة | +1, 0, -1 (أكاسيده قاعدية قوية) | ||||||||||||||||||||||||||||
| الكهرسلبية | 0.93 (مقياس باولنغ) | ||||||||||||||||||||||||||||
| طاقات التأين | الأول: 495.8 كيلوجول·مول−1 | ||||||||||||||||||||||||||||
| الثاني: 4562 كيلوجول·مول−1 | |||||||||||||||||||||||||||||
| التالت: 6910.3 كيلوجول·مول−1 | |||||||||||||||||||||||||||||
| نصف قطر ذري | 186 بيكومتر | ||||||||||||||||||||||||||||
| نصف قطر تساهمي | 9±166 بيكومتر | ||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 227 بيكومتر | ||||||||||||||||||||||||||||
| خواص تانيه | |||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | ||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | ||||||||||||||||||||||||||||
| مقاومة كهربائية | 47.7 نانوأوم·متر (20 °س) | ||||||||||||||||||||||||||||
| الناقلية الحرارية | 142 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||||||
| التمدد الحراري | 71 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 3200 متر/ثانية (20 °س) | ||||||||||||||||||||||||||||
| معامل يونغ | 10 غيغاباسكال | ||||||||||||||||||||||||||||
| معامل القص | 3.3 غيغاباسكال | ||||||||||||||||||||||||||||
| معامل الحجم | 6.3 غيغاباسكال | ||||||||||||||||||||||||||||
| صلادة موس | 0.5 | ||||||||||||||||||||||||||||
| صلادة برينل | 0.69 ميغاباسكال | ||||||||||||||||||||||||||||
| رقم الكاس | 7440-23-5 | ||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الصوديوم | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
مفيش صوديوم بشكل حرّ فى الطبيعة، وبيتم استخراجه من مركّباته. فى وفرة كبيرة تقريبا للصوديوم، لأنه سادس أكتر العناصر الكيميائية وفرة فى القشرة الأرضية، وموجود فى كتير من المعادن منها الفلدسبار والصوداليت والهاليت. بتتميز أملاح الصوديوم أنّ انحلاليتها كبيرة فى الماء، وأهمها ملح كلوريد الصوديوم، واللي بيعتبر المسبّب الرئيسي لملوحة مياه البحار. للصوديوم نظير واحد مستقر وهو 23Na.
للصوديوم دور حيويّ مهمّ، لأنه مصنّف ضمن العناصر الغذائية الأساسية للإنسان وللحيوانات وبعض النبات. فأيونات الصوديوم +Na هيا الكاتيونات الأساسية فى السائل خارج الخلايا، وليها دور أساسي فى تظبيط ضغط الدم والضغط التناضحي (الإسموزي) فى الجسم، بالإضافة لدوره فى نقل الإشارات العصبية (جهد الفعل).
التاريخ
الاكتشاف وأصل التسمية

على العكس من فلزّ الصوديوم الحرّ اللي تم اكتشافه لحد أوائل القرن ال 19 فإنّ مركّبات الصوديوم كانت معروفة ومتداولة من زمان، وخصوصا ملح الطعام المستخرج من البحر والبحيرات المالحة، وكمان من الأماكن الصخرية. وكان المصريون القدماء بيستخرجوا الأملاح من وادي النطرون، وعشان كده انتشرت كلمة نتر المصرية فى العهد القديم. وانتقلت الكلمة للغة الإغريقية علشان تكون νίτρον (نترون)، واللي استعملها العرب فبقت نطرون، ومنهم خدها الرومان وحوّروها علشان تكون nitrium (نتريوم).[5] وما زالت التسمية اللاتينية للعنصر Natrium وتحويرات منها مستخدمة فى عدّة لغات فى اللغة الألمانية ولغات منطقة إسكندنافيا وده حسب اقتراح من بيرسيليوس. بيتعقد البعض أنّ تسمية صوديوم بيعود أصلها للكلمة اللاتينية sodanum واللي معناها "علاج وجع الرأس"،[6] واللي متاخده من كلمة صداع بالعربي.[7] لكن الرأي ده ضعيف، والأغلب وصل اسم الصوديوم بكلمة صودا، والقادمة من اللاتينية soda اللي كانت بتشيرلنبات مزهر بينمو على الأراضي الملحية، زي نبات السويداء، واللي كان رماده (رماد الصودا) بيستخدم فى الغسيل، واللي من المرجح أن يكون اشتقاق كلمة صودا منه.[8]
اكتشف عنصر الصويوم لأوّل مرّة بشكله الحرّ عن طريق همفري ديفي سنة 1807 وده من التحليل الكهربائي لمصهور هيدروكسيد الصوديوم باستخدام عمود فولتي كمصدر كهربائي.[9][10] حسب اللي ورد فى سجلاّت الجمعية الملكية فى لندن، إنّ ديفي حصل فى عمليّته على ناتجين مختلفين: الناتج الأوّل الموجود فى الصودا سماه صوديوم، والتسمية دي المستخدمة للفلزّ باللغتين الإنجليزية والفرنسية، ومنها اتنقلت لأكتر من لغه تانيه، منها العربية. أمّا الفلزّ التاني المكتشف سماه بوتاسيوم. فى سنة 1809، و عشان توحيد التسمية اقترح العالم الألماني لودفيغ فيلهلم غيلبرت على ديفي استخدام Natronium (ناترونيوم) وKalium (كاليوم) أسمين للعنصرين اللي اكتشفوهم حديثاً.[11] نشر يونس ياكوب بيرسيليوس الرمز الكيميائي للصوديوم لأول مرة سنة 1814 وده ضمن مسعاه لتنظيم رموز العناصر الكيميائية،[12][13] واختار الرمز Na من كلمة Natrium فى اللاتينية الجديدة، واللي أخدها من كلمة نطرون العربية من المصرية القديمة، للإشارة للأملاح المعادن الطبيعية على شكل كربونات صوديوم مميّهة. كانت تسمية نطرون منتشرة فى أوروبا وكان السبب الإستخدام الكبير للمادّة على المستويين الصناعي والمنزلي.[14]
الخواص
يضفي الصوديوم لوناً أصفرلاللهب، وهذه ملاحظة تعودلسنة 1860، قام العالمان غوستاف روبرت كيرشهوف وروبرت بنسن بتدوين هذه الملاحظة فى منشورهم العلمي فى دورية Annalen der Physik.[15]
الوفرة الطبيعية

بسبب النشاط الكيميائي الكبير للعنصر، بقا أن مفيش صوديوم على شكله الحرّ على سطح الأرض، لكن بيدخل فى تركيب عدد كبير من المعادن، واللي بيتميز البعض منها بالانحلالية الكبيرة فى الماء زي الهاليت والنطرون. يعدّ ماء البحر واحد من أهم مصادر الصوديوم، كلّ ليتر منه بيكون موجود فيه حوالي11 غرام من أيونات الصوديوم،[16] وموجود فى المحيطات بحوالي 1.08××10قالب:Val/delimitnum ميليغرام فى كل ليتر.[17] أمّا فى أقلّ انحلالية زي مجموعة معادن الأمفيبول والزيوليتات. يعود ضعف الانحلالية لبعض المعادن الحاوية على الصوديوم زي الكريوليت والفلدسبارلالخاصّة البوليميرية للأنيونات، اللى تكون على شكل بولي سيليكات مثلاً فى الفلدسبار.
تحتوي القشرة الأرضية على الصوديوم بنسبة 2.36% من تركيبها، ممّا يجعله سادس اكتر العناصر وفرة فى القشرة الأرضية،[18] والخامس من ترتيب الفلزات بعد الألومنيوم والحديد والكالسيوم، وبنسبة مقاربة للمغنسيوم، لكن قبل البوتاسيوم.[19] من اكتر المعادن الحاوية على الصوديوم انتشاراً كلّ من الألبيت (NaAlSi3O8 فلدسبار الصوديوم) والأوليغوكلاس Na,Ca)Al(Si,Al)3O8)؛ كما فيه كمان بكمّيّات كبيرة نسبياً فى القباب الملحية على شكل هاليت (ملح الصخر). فيه الصوديوم فى الطبيعة كمان على شكل نترات الصوديوم (يعرف باسم ملح بيتر تشيلي) NaNO3، وهو واحد من المصادر الطبيعية القليلة لمعادن النترات، اللى تنتشر فى المناطق القاحلة مثل صحراء أتاكاما فى تشيلي؛ و ذلك تعدّ مكامن النطرون Na2CO3 · 10 H2O من المصادر المهمّة للصوديوم.
يحتلّ الصوديوم المرتبة 14 من وفرة العناصر فى الكون؛[20] وذلك بنسبة مقاربة للكالسيوم والنيكل. يتمّ التعرّف على الصوديوم فى الكتير من الأجرام السماوية (من ضمنها الشمس) كمان فى الوسط بين النجمي عن طريق الخطّ الطيفي D المميّز. رغم ارتفاع درجة حرارة تبخّره، إلاّ أنّ وفرته فى الغلاف الجوّي لكوكب عطارد مكّنت من كشفه بواسطة مسبار مارينر 10. كما تمكّن علماء الفلك وقت رصدهم مذنب هيل-بوب سنة 1997 من ملاحظة أنّ ذيل المذنب الممتدّ لحوالي 50 مليون كيلومتر يتكوّن من الصوديوم.[21]
الإنتاج والتحضير

يُنتج حوالي 100 ألف طنّ من الصوديوم الفلزّي سنويّاً، ويستخدم جلّ الإنتاج فى تطبيقات اختصاصية. يعود تاريخ إنتاج الصوديوم بشكل تجاريلأواخر القرن التسعتاشر،[22] وذلك بواسطة الاختزال الكربوحراري لمركّب كربونات الصوديوم (النطرون) عند درجات حرارة تفوق 1100 °س، وذلك كخطوة أولى فى عملية ديفيل لإنتاج الألومنيوم:[23][24][25]
إلّا أنّ هذه الطريقة لم تعد تستخدم للحصول على الصوديوم وذلك بعد تطوير عملية هول-هيرو لإنتاج الألومنيوم، اللى استغنت عن إنتاج الصوديوم كخطوة مرحلية. كما تمّ الاستغناء بسبب الكلفة المرتفعة عن عملية كاستنر، اللى طُوّرت سنة 1886، بالاعتماد على التحليل الكهربائي لهيدروكسيد الصوديوم.[26]
يُنتج الصوديوم حالياً بشكل تجاري من التحليل الكهربائي لمصهور كلوريد الصوديوم، اعتماداً على عملية حازت على براءة اختراع سنة 1924.[27][28] تتمّ العملية فى خلية داونز، اللى يمزج فيها ملح كلوريد الصوديوم مع كلوريد الكالسيوم (40% NaCl و60% CaCl2) للحصول على نظام أصهري علشان تخفيض نقطة الانصهار دون 700 °س، واختير الكالسيوم لأنه أقلّ كهرإيجابية من الصوديوم، فلا يترسّب على المهبط.[29] لإنتاج كيلوغرام واحد من الصوديوم يتمّ استهلاك 10 كيلوواط ساعي من التيّار وقت التحليل الكهربائي، وحوالي 12 كيلوواط ساعي فى العملية ككلّ.[30] تتكوّن خلايا التحليل الكهربائي الأسطوانية من مصعد من الغرافيت فى المنتصف، يحيط به مهبط من الحديد، و وجود قفص على شكل جرس لسحب أبخرة الكلور وقت العملية. يُجمّع الصوديوم المتشكّل على المهبط، ويُسحب بواسطة أنبوب صاعد من الخلية ومبرّد خارجها. يتشكّل الكالسيوم كمان كناتج ثانوي للعملية على شكل بلّورات، اللى يعاد تانىلمزيج الصهارة.
- تشكّل الصوديوم على المهبط
- تشكّل الكلور على المصعد
- التفاعل الإجمالي
نظراً للفاعلية الكيميائية الكبيرة لفلز الصوديوم، فهناك صعوبات تقنية ترافق تخزينه ونقله، ممّا أدّىلمحدودية انتشار إنتاجه. فالفلزّ لازم يحفظ إمّا فى جوّ من غاز خامل أو فى زيت معدني لامائي لتجنّب تشكّل طبقة سطحية من أكسيد الصوديوم أو فوق أكسيد الصوديوم.[31]
النظائر
هناك عشرون نظير مكتشف للصوديوم، تتراوح كتلها الذرّية من 18Naل33Na،[32] إلّا أنّه بس فيه نظير واحد مستقر، وهو صوديوم-23 23Na، بالتالي فالصوديوم عنصر أحادي النويدة. يتشكّل النظير 23Na فى عملية احتراق الكربون فى النجوم باندماج ذرّتي كربون، اللى يتطلّب درجات حرارة تتجاوز 600 ميغاكلفن، ونجم له ثلاث كتل شمسية على الأقلّ.[33]
للصوديوم نظيران مشعَّان ذَوا أصلٍ كوني، واللذان يتشكّلان من تشظية الأشعة الكونية وهما: صوديوم-22 22Na، اللى له عمر نصف مقداره 2.6 سنة، وصوديوم-24 24Na، اللى عمر النصف له يبلغ 15 ساعة. أمّا باقي نظائر الصوديوم فعمر النصف ليها أقلّ من دقيقة واحدة.[34] يُستخدم نظيرا الصوديوم 22Na و24Na فى الطب النووي كمواد اقتفاء.
اكتشف مصاوغان نووريان للصوديوم، أطولهما عمراً هو 24mNa (عمر النصف حوالي 20.2 ميلي ثانية. يؤدّي التعرّض للإشعاع النووي فى الحالات الحرجةلتحويل بعض من ذرّات النظير المستقرّ 23Na فى الدمّل24Na، ويمكن معرفة مدى جرعة التعرض للإشعاع النيوتروني بحساب نسبة تركيز النظير 24Naل23Na.[35]
الخواص الفيزيائية

يكون الصوديوم فى الظروف القياسية من الضغط ودرجة الحرارة على شكل فلزّ طري فضّي اللون، اللى يتّحد مع أكسجين الهواء ليشكّل طبقة رمادية اللون من الأكسيد. للحيلولة دون ذلك يتمّ فى العاده غمس الصوديوم الفلزي فى زيت معدني أو واحد من مشتقّات النفط، أو أن يحفظ فى جوّ من غاز خامل. ممكن قطع فلز الصوديوم بسهولة بالسكّين، فله قيمة صلادة تبلغ 0.5 حسب مقياس موس.[36] وهو ناقل جيّد للكهرباء وللحرارة، وذلك بسبب سهولة التخلّص من الإلكترون الوحيد الموجود فى غلاف التكافؤ، بالتالي يؤدّي ده التشكيل الإلكتروني للصوديوملضعف الرابطة الفلزية. بسبب قلّة الوزن الذرّي وكبر نصف قطرذرّة الصوديوم نسبياً، فإنّه يصنّف من الفلزّات الخفيفة، وهو تالت أقلّ الفلزّات كثافة (0.968 غ/سم3) بعد الليثيوم والبوتاسيوم، اللى هيا الوحيدة القادرة من بين الفلزات على العوم على سطح الماء.[37] يقع الصوديوم فى الكتير من خواصه بين الليثيوم والبوتاسيوم، فله نقطة انصهار (97.82 °س) أخفض من الليثيوم (180.54 °س)، إلّا أنّها أعلى من البوتاسيوم (63.6 °س)؛ كمان الأمر بالنسبة فى نقطة الغليان (883 °س) والحرارة النوعية.

يتبلور الصوديوم كما هو الحال مع باقي الفلزّات القلوية وفق نظام بلوري مكعّب مركزي الجسم، له زمرة فراغية Im3m مع وجود وحدتي صيغة لكلّ وحدة خلية. عند درجات حرارة أدنى من 51 كلفن تتغيّر البنية البلّوريةلنظام تعبئة متراصّة سداسية، تبلغ قيمة ثابت الشبكة البلورية ليها a = 376 pm وc = 615 pm.تتغيّر خواص الصوديوم الظاهرية بشكل كبير عند ضغوط مرتفعة؛ فعند ضغط مقداره 1.5 ميغابار يتغيّر اللونلالأسود، وعند ضغط 1.9 ميغابار يصبح ذا لون أحمر شفاف، وعند 3 ميغابار يصبح الصوديوم ذا هيئة صلبة شفافة صافية، وتكون كل هذه المتآصلات عازلة وذات صفة إلكتريدية.[39]
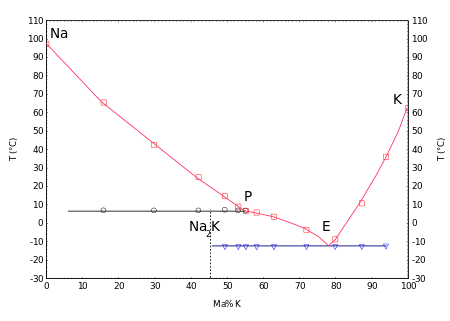
يتكوّن بخار الصوديوم، وهو ذو لون أصفرلأرجواني، من ذرّات فلزّية منفردة، ومن ثنائيات ليها الشكل Na2، والأخيرة تكون بنسبة 16% عند نقطة الغليان. يشكّل الصوديوم مع البوتاسيوم ضمن مجال عريض من التراكيز مزائج سائلة، يظهر المخطّط الطوري عند الدرجة 7 °س(وهي نقطة انصهار لا متطابقة Peritectic) التركيب Na2K، أمّا النقطة الأصهرية فهي عند − 12.6 °س، بوجود تركيز من البوتاسيوم مقداره 77% (كسر كتلي).[40]
الخواص الكيميائية
يظهر التشكيل الإلكتروني للصوديوم وجود 11 إلكترون فى الغلاف الإلكتروني، وهو يزيد بذلك بإلكترون واحد عن التشكيل الإلكتروني عالي الاستقرار للغاز النبيل المجاور وهو النيون. لده السبب، ولانخفاض قيمة طاقة التأيّن الأولى (495.8 كيلوجول/مول)، فإنّ ذرّات الصوديوم تميل لفقدان الإلكترون الأخير الموجود فى غلاف التكافؤ ولتشكيل كاتيون (أيون موجب الشحنة) +Na، وذلك بشكل اكبر من اكتساب إلكترون آخر ليصبح سالب الشحنة.[42] علشان كده فالصوديوم يميللتشكيل مركّبات أيونية، يكون للصوديوم فيها رقم تكافؤ مقداره +1 (طاقة التأيّن التانيه ليها قيمة مرتفعة جدّاً نسبيّاً: 4562 كيلوجول/مول).[43] يكون الصوديوم فى مركّباته الكيميائية مرتبطاً أيونياًلالأنيونات التانيه، ويصنّف أيون الصوديوم من أحماض لويس القاسية.[44]
إنّ الصوديوم اكتر نشاطاً كيميائياً من الليثيوم، لكنّه أقلّ من البوتاسيوم.[45] فهو يتفاعل بسهولة مع الكتير من العناصر وبعض المركّبات، ويكون تفاعله عنيفاً مع اللافلزّات مثل الكلور والكبريت، يترافق ذلك مع لهب أصفر. يعدّ الصوديوم الفلزّي من المختزلات القويّة، إذ يتطلّب اختزال أيونات الصوديوم جهداً مقداره −2.71 فولت،[46] رغم أنّ جهد الاختزال لكلّ من البوتاسيوم والليثيوم ذو قيم سالبة اكبر.[47]
يعدّ تفاعل الصوديوم مع الأكسجين حالة خاصة، إذ أنّ التفاعل بينهما مرهون بوجود الرطوبة، فبغياب الماء لا يتفاعل الصوديوم مع الأكسجين عند درجة حرارة الغرفة، وحتّى عند التسخين لا يتمّ التفاعل بشكل مباشر بينهما، كما ممكن صهر الصوديوم بجوّ من الأكسجين خالٍ من الماء بشكل تامّ دون حدوث تفاعل أيضاً. يتغيّر الأمر تماماً عند وجود الماء (الرطوبة)، فحينئذ يحترق الصوديوم بسهولة ليشكّل بيروكسيد الصوديوم:
يتفاعل الصوديوم مثل باقي الفلزات القلوية مع الماء بتفاعل عنيف ناشر للحرارة، يتشكّل هيدروكسيد الصوديوم وينطلق غاز الهيدروجين. بيّنت صور كاتشارة بسرعات فائقة أنّ تفاعل الفلزّات القلوية مع الماء يحدث بشكل أقرب ما يكون لانفجار كولوم.[48]
يتفاعل الصوديوم بشكل عنيف كمان مع الكحولات، لكن بشكل أخفّ من تفاعله مع الماء، ليشكّل الألكوكستات الموافقة، وغالباً مع انصهار الفلز بسبب حرارة التفاعل. يكون تفاعل الصوديوم عنيفاً كمان مع المذيبات العضوية الكلورية مثل ثنائي كلورو الميثان والكلوروفورم ورباعي كلوريد الكربون.
السبائك
يشكّل الصوديوم سبائك مع الكتير من الفلزّات مثل البوتاسيوم والكالسيوم والرصاص، و عناصر المجموعتين الحادية عشرة والثانية عشرة. يستطيع الصوديوم أن يشكّل مع البوتاسيوم سبيكة NaK، وتتراوح نسبة البوتاسيوم فى تركيبها من 40–90% هيا سائلة فى درجة الحرارة المعتدلة، وتتميّز بأنّ ليها خواص موصلية حرارية وكهربائية ممتازة. تعدّ سبائك صوديوم-كالسيوم منتجات ثانوية وقت إنتاج الصوديوم من عملية التحليل الكهربائي بوجود المزيج الملحي من NaCl-CaCl2، رغم أنّ الكالسيوم يمتزج بشكل جزئي بس مع الصوديوم.
في الحالة السائلة يمتزج الصوديوم مع الرصاص بشكل كامل. هناك الكتير من الوسائل اللى تمكّن من صنع سبائك صوديوم-رصاص، من بينها الصهر المشترك، وتانيه تتمثّل بترسيب الصوديوم كهربائياً على مهابط مصهورة مصنوعة من الرصاص. من الأمثلة على تركيبات سبائك صوديوم-رصاص كل من NaPb3 وNaPb وNa9Pb4 وNa5Pb2 وNa15Pb4.
من الممكن كمان الحصول على سبائك للصوديوم مع الذهب (NaAu2) والفضة (NaAg2). كذلك الأمر مع عناصر الزنك (NaZn13) والكادميوم (NaCd2) والزئبق، والعنصر الأخير يشكل ما يسمى ملغمة صوديوم: NaHg وNaHg4 وNaHg2 وNa3Hg2 وNa3Hg.[49]
المحاليل
يميل الصوديوملتشكيل مركّبات كيميائية منحلّة مثل أملاح الهاليدات والكبريتات والنترات والكربونات والكربوكسيلات. تكون الأنواع الكيميائية المائية الرئيسية على شكل المعقّد: +[Na(H2O)n] وقت عملية الإماهة، n = 4–8، مع العلم أنّ قيمة n = 6 حُدّدت بواسطة بيانات حيود الأشعة السينية والمحاكاة الحاسوبية.[50] للصوديوم انحلالية أقلّ فى المذيبات العضوية، فعلى سبيل المثال ينحلّ بس 0.35 غ/ل من كلوريد الصوديوم فى الإيثانول.[51]

كما هو الحال مع باقي الفلزات القلوية فإنّ الصوديوم ينحلّ فى الأمونيا وبعض الأمينات التانيه ليعطي محاليل ملوّنة غامقة، اللى يعود تلوّنهالالإلكترونات الحرّة اللى يمنحها الصوديوملالمحلول. بالتالي فالمحلول موصل للكهرباء، وعند تمديده يكون ذا مغناطيسية مسايرة.
يؤدّي تبخير هذه المحاليللترك طبقة رقيقة (فيلم) لامعة من الصوديوم الفلزّي. تحوي هذه المحاليل على معقدات تناسقية من النمط +(Na(NH3)6)، تُعاكَس الشحنة الموجبة بشكل مساوٍ عن طريق الإلكتريدات (الإلكترونات كأنيونات). ممكن استخدام الإيثرات التاجية، كحفّازات انتقال طوري؛[52] كما تسمح مركّبات كريبتاند بعزل هذه المعقّدات كمواد صلبة بلّورية، إذ أنّ الصوديوم يشكّل معقّدات معها كمان ومع ربيطات تانيه.[53] على سبيل المثال، فإنّ لمركّب إيثر 15-تاج-5 ألفة عالية تجاه الصوديوم، لأنّ حجم التجويف للمركّب يتراوح بين 1.7–2.2 أنغستروم (Å)، وهو مقدار كافٍ لينحشر أيون صوديوم داخله.[54][55] إنّ الكريبتاندات، مثلها مثل الإيثرات التاجية وحاملات الأيون التانيه، ذات ألفة عالية تجاه أيون الصوديوم، ب ممكن فى النهاية الحصول على مشتقّات من القلويدات −Na (ناتريد Natride: أنيون صوديوم)،[56] بواسطة إضافة مركّبات الكريبتاندلمحاليل من الصوديوم فى الأمونيا عن طريق تفاعل عدم تناسب.[57][58]
المركّبات الكيميائية
تعد المركّبات الكيميائية للصوديوم ذات أهمّيّة كبيرة، وذلك على مرّ التاريخ وخاصّة فى المجال التجاري والصناعي، كان ليها استخدام مركزي خاصّ فى صناعات مختلفة، منها صناعة الزجاج والورق والصابون والنسيج.
اللاعضوية
يعدّ كلوريد الصوديوم (ملح الطعام أو ملح المائدة، NaCl)، هو اكتر مركّبات الصوديوم اللاعضوية شيوعاً، وذلك مع كربونات الصوديوم (رماد الصودا، Na2CO3) وبيكربونات الصوديوم (صودا الخبز، NaHCO3) وهيدروكسيد الصوديوم (الصودا الكاوية، NaOH) ونترات الصوديوم (نتر الصودا، NaNO3)، كمان أملاح فوسفات الصوديوم الثنائية والثلاثية، و ثيوكبريتات الصوديوم (Na2S2O3·5H2O) والبورق (Na2B4O7·10H2O).
- الهاليدات
أشهر هاليدات الصوديوم هو مركب كلوريد الصوديوم NaCl المتوفّر بكثرة، ويعدّ المصدر الأساسي للحصول على الصوديوم فى الطبيعة. أمّا باقي الهاليدات فهي مركّبات ثابتة ومعروفة، وهي: فلوريد الصوديوم NaF، وبروميد الصوديوم NaBr، ويوديد الصوديوم NaI.

- الهيدريدات
للصوديوم مركّبين ينتميانلالهيدريدات وهما هيدريد الصوديوم NaH، وبورهيدريد الصوديوم NaBH4، واللذان يستخدمان فى الاصطناع العضوي كمختزلات.
- المركّبات الأكسجينية
يرتبط الصوديوم مع الأكسجين ليشكّل عدّة أكاسيد أشهرها: أكسيد الصوديوم Na2O، وبيروكسيد الصوديوم Na2O2، وفوق أكسيد الصوديوم NaO2. تستخدم أكاسيد الصوديوم المختلفة فى صناعة الزجاج والورق والنسيج. يعدّ هيدروكسيد الصوديوم NaOH من القلويات الشائعة، يستخدم محلوله بشكل كبير فى الصناعة.
- المركّبات الكبريتية
يعطي الصوديوم مع كبريتيد الهيدروجين ملحين وهما: كبريتيد الصوديوم Na2S وبيكبريتيد الصوديوم NaHS، واللذان يستخدمان فى تعدين الفلزّات الثقيلة. يستخدم كبريتات الصوديوم Na2SO4 فى صناعة الورق، أمّا بيكبريتات الصوديوم فيستخدم فى منتجات التنظيف. من مركّبات الصوديوم الكبريتية كمان مركب ثيوكبريتات الصوديوم اللى يستخدم فى التصوير الضوئي.
- أملاح تانيه
يصنّف مركبا كربونات الصوديوم Na2CO3 وبيكربونات الصوديوم NaHCO3 على أنّهما أملاح صوديومية لحمض الكربونيك، هيا واسعة الانتشار والاستخدام على الصعيدين المنزلي والصناعي، وذلك و نترات الصوديوم NaNO3 ومركّبات فوسفات الصوديوم المختلفة.
إنّ أغلب منتجات الصابون هيا أملاح صوديوم للأحماض الدهنية، تمتاز هذه المنتجات بأنّ ليها قوام صلب متماسك، وذلك بالمقارنة مع نظيراتها من أملاح البوتاسيوم، اللى تدخل فى تركيب الصابون السائل.[59]
العضوية
جرى تحضير الكتير من مركّبات الصوديوم العضوية، وبسبب استقطاب الرابطة الكيميائية بين C-Na فإنّ هذه المركّبات تعدّ كمصدر للكربانيونات. من بين هذه المركّبات حلقي بنتاديينيد الصوديوم NaC5H5 وتريتيل الصوديوم (C6H5)3CNa)).[60]
بسبب كبر حجم وضعف القوة المستقطبة للكاتيون +Na فإنّه يستطيع أن يثبّت الأنيونات العطرية الجذرية الكبيرة القابلة للاستقطاب، مثلما هو الحال فى نفثالينيد الصوديوم −[•Na+[C10H8، وهو مختزل قويّ جدّاً.[61]
الكشف عن الصوديوم
اختبار اللهب

عند إجراء اختبار اللهب يعطي الصوديوم ومركّباته لوناً أصفر مميّز،[62] وذلك بسبب أنّ الإلكترونات فى المدار الذري 3s تتهيّج وتثار بسبب امتصاص الحرارة وتقفزلالمدار 3p، وعند عودتهالالمدار 3s تصدر طاقة على شكل فوتون له طول موجة عند 589.3 نانومتر، ويرمز له الخطّ D فى خطوط فراونهوفر. يؤدّي التآثر المغزلي المداري للإلكتروناتلانفصام الخط Dلخطّين D1 وD2، كما تسبّب البنى فائقة الدقة فى المداراتلالحصول على خطوط ضعيفة تانيه.[63]
الكيمياء التحليلية
من النادر حدوث عملية ترسيب لأملاح الصوديوم، لأنّ ليها ألفة كيميائية عالية تجاه الماء، باستمدح ملح بزموتات الصوديوم (NaBiO3).[64] كما أنّه من الممكن إجراء ترسيب للصوديوم باستخدام ملح مزدوج صوديومي من الكبريتات والبزموت 3Na2SO4*2Bi2(SO4)3*2H2O.[65]
يمكن تحديد المحتوى الصوديومي فى المواد بالمعالجة مع كمّيّة فائضة من أسيتات يورانيل الزنك؛ يترسّب سداسي الهيدرات UO2)2ZnNa(CH3CO2)·6H2O) ويحدد وزنه. لا يتداخل السيزيوم والروبيديوم فى تفاعل الكشف ده، لكن التداخلات تحدث مع عنصري البوتاسيوم والليثيوم.[66] كما ممكن أن يتمّ الكشف بالترسيب باستخدام أسيتات يورانيل الصوديوم والمغنسيوم [67] يعطي راسب أصفر من NaMg(UO2)3(CH3COO)9·9 H2O؛ أو باستخدام سداسي هيدروكسي إثمدات الصوديوم [Na[Sb(OH)6 اللى يعطي راسب عديم اللون.[68]
تحدّد التراكيز الضئيلة من الصوديوم بواسطة مطيافية الامتصاص الذري،[69] أو بإجراء معايرة بمقياس الجهد باستخدام أقطاب انتقائية لأيونات الصوديوم.[70]
الدور الحيوي
للصوديوم دور حيويّ مهمّ فى جسم الإنسان، فهو من العناصر الغذائية الضرورية اللى تلعب أدواراً متنوّعة فى الكتير من العمليّات الفسيولوجية مثل ضغط الدم وحموضة (pH) الوسط فى الجسم، و تنظيم التوازن المائي داخل وخارج الخلايا. فيه الصوديوم فى الجسم على شكل أيونات (+Na)، هيا من الكهارل (الإلكتروليتات) المهمّة فى أداء العصبونات؛ هيا السائدة فى السائل خارج الخلوي،[71] تقوم بضبط الضغط التناضحي (الإسموزي) بين الخلايا وخارجها عن طريق مضخّة الصوديوم والبوتاسيوم (Na+/K+-ATPase)، وهو إنزيم مسؤول عن النقل الفعّال للأيونات عبر القنوات المخصّصة.[72]
- الضبط
يقوم نظام الرينين-أنجيوتنسين بتنظيم كمّيّة السوائل وبالتالي تركيز الصوديوم فى الجسم، وتلعب الكلية الدور الرئيسي فى ذلك.[73] عند انخفاض ضغط الدم وتركيز الصوديوم، فإنّ الجسم يستجيب بإفراز الرينين، اللى بدوره يسبّب إفراز الألدوستيرون والأنجيوتنسين،لأن يصبح تركيز الصوديوم طبيعياً، فينخفض إفراز الرينين.[74] كما يلعب هرمون فازوبرسين والببتيد الأذيني المدرّ للصوديوم دوراً فى عملية التنظيم هذه.[75]
يقع تركيز الصوديوم الطبيعي فى مصل الدم بين حوالي 135–145 ميلي مول/ليتر (mmol/l). توصف الحالات فى الطبّ اللى ترافق حدوث ارتفاع غير عادي من الصوديوم فى الدم باسم فرط صوديوم الدم، اللى يترافق بانكماش الخلايا؛ بالمقابل فإنّ الانخفاض غير العادي يسمى نقص صوديوم الدم، اللى يترافق بازدياد حجم الخلايا. قد يعود سبب هذه الحالات المرضيةلعوامل وراثية أو تقدّم العمر أو الحالات المطوّلة من الإقياء أو الإسهال.[76]
- التوزيع فى الخلايا
لا تتوزّع أيونات الصوديوم +Na فى أجسام الكائنات الحية بانتظام، فهي متفاوتة بين داخل الخلايا وخارجها، ممّا يؤدّي فى النهايةلالتأثير على الجهد الغشائي فيها. يعدّ الجهد الغشائي وتدرّج تراكيز الأيونات من العوامل المؤثّرة على أداء الخلايا، وفي ده السياق تلعب مضخّة الصوديوم والبوتاسيوم دوراً مهمّاً فى ذلك، تُدخل البوتاسيوم وتُخرج الصوديوم بعملية مستهلكة للطاقة.[77]

- الدور العصبي
لأيونات الصوديوم +Na دور مهمّ فى تشكيل ونقل الإثارات الحسّية فى العصبونات، فعند التشابك العصبي (وكذلك عند المشابك العصبية العضلية أيضاً) توجد هناك مستقبلات بروتينية عبر غشائية محدّدة، اللى بعد تحفيزها من النواقل العصبية المفرَزة من الخليّة العصبية المجاورة تقوم بفتح المجال لعبور أيونات الصوديوم. عند مرور تيّار من أيونات الصوديوم يحدث هناك تغيّر موضعي فى الجهد الغشائي للخليّة، يصبح الكمون الداخلي أقل سلبيّة من الكمون الخارجي، ويحدث ما يسمى بعملية إزالة الاستقطاب، اللى تتكرّر على طول المحور العصبي بفتح وإغلاق للقنوات الأيونية، ممّا يؤدّيلحدوث جهد الفعل.
- المصادر والكميّة
يمثّل كلوريد الصوديوم المصدر الرئيسي للصوديوم فى النظام الغذائي للإنسان، يستخدم كملح للطعام، و استخداماته المختلفة فى وسائل حفظ المأكولات المختلفة مثل التخليل والتقديد، كما يستخدم بشكل كبير فى المأكولات سهلة التحضير.[78][ْ 2]
بالإضافةلالمصادر الطبيعية للصوديوم، فإنّ الجسم يحصل عليه من الإضافات الغذائية مثل أحادي غلوتامات الصوديوم (E621) ونتريت الصوديوم (E250) وبنزوات الصوديوم (E211) وصوديوم السكارين وبيكربونات الصوديوم (صودا الخَبْز - ذرور الخبز).[79]
في جسم إنسان متوسّط وزنه 70 كغ فيه حوالي 100 غ من أيونات الصوديوم.[80] إنّ الحدّ الأدنى المتطلّب فسيولوجياً من الصوديوم هو 500 ميليغرام فى اليوم وسطيّاً،[81] وحدّدته الجمعية الألمانية للتغذية بمقدار 550 مغ/اليوم للبالغين، وحوالي 460 مغ/اليوم للأطفال بين عمر السابعة والعاشرة.[82] هناك توصيات من عدّة منظّمات لضبط الكمّيّة الأعظمية من الصوديوم فى الغذاء، حدّدته منظّمة الصحّة العالمية (WHO) بمقدار 2 غ/اليوم،[83] فى حين أنّ الأكاديمية الوطنية الأمريكية للطبّ حدّدت الكمّيّة الغذائية المرجعية (DRI) من الصوديوم بمقدار 2.3 غ يومياً كحدّ أعظمي.[84] بيّنت الدراسات أنّ تقليل كمّيّات الصوديوم المتناولةل2 غ فى اليوم يسهم فى تخفيض ضغط الدم بمقدار 2 - 4 ميليمتر زئبقي؛[85] ممّا يؤدّيلنسبة حالات أقل من ارتفاع ضغط الدم تتراوح ما بين 9 - 17 %؛ مع العلم أنّ ارتفاع ضغط الدم يسبّب 7.6 مليون حالة وفاة مبكّرة سنويّاً حول العالم.[86] بملاحظة أنّ ملح الطعام يحوي على 39.3% من تركيبه على صوديوم،[87] بالتالي فإنّ الحدّ الأعظمي المذكور آنفاً من 2.3 غ صوديوم يكافئ حوالي 6 غ من الملح فى اليوم (ملعقة شاي تقريباً).[88] مع العلم أنّ جمعية القلب الأمريكية [89] توصي بأن تكون كمّيّة الصوديوم فى الغذاء حوالي 1.5 غ يومياً؛ هيا الكمّيّة الموصى بيها من إدارة الغذاء والدواء الأمريكية (FDA) للمصابين بفرط الضغط أو أعراضه. هناك الكثير ممّن يتناولون كمّيّات من الصوديوم اكبر بكثير من اللى يحتاجون ليها،[ْ 3] ممّا يعرّضهم للخطر، لذالازممراقبة تركيز الصوديوم بإجراء ما يسمى اختبار الصوديوم لعينة من الدم،[ْ 4] أو من البول؛[90] إذ بيّنت دراسة أنّ المستويات المرتفعة من الصوديوم فى البول (حوالي 7 غ فى اليوم) عند المصابين بارتفاع الضغط ممكن أن يعرّضهم لأزمات قلبية ويرفع من نسبة حدوث الوفاة.[91]
- النباتات
في النباتات ذات التمثيل الضوئي رباعي الكربون فإنّ الصوديوم يعدّ من المغذيات الأصغرية اللى ليها دور ثانوي لكن مهمّ؛ تسهم فى عملية الاستقلاب، وخاصّة فى إعادة توليد فوسفوإينول حمض البيروفيك واصطناع الكلوروفيل.[92] كما يحلّ الصوديوم مكان البوتاسيوم فى بعض النباتات التانيه، كما هو الحال مع النباتات الملحية، يقوم بالإبقاء على ضغط الامتلاء ويساعد فى فتح وإغلاق الثغور النباتية،[93]
يسبّب ارتفاع تركيز الصوديوم فى التربةلالحدّ والتقليل من استهلاك الماء فى النبات عبر جهد الماء، اللى يؤدّي بدورهلالذبول.[94][95] كما أنّ ارتفاع تركيز الصوديوم فى السيتوبلازم ممكن أن يسبّب تثبيط الإنزيمات، اللى بدوره يؤدّيلالنخر وشحوب الأوراق.[96] كردّ فعل، تقوم بعض النباتات بتطوير آلية للحدّ من استجلاب الصوديوم فى الجذور النباتية، أو بتخزينه فى الفجوات العصارية، أو بالحدّ من نقل الملح من الجذورلالأوراق.[97] تسمّى هذه النباتات اللى تقوم بذلك أنّها كارهة للصوديوم، ومن أمثلتها الفاصولياء الشائعة والذرة.
الاستخدامات

هناك طلب كبير على مركّبات الصوديوم فى الصناعة، وخاصّة أملاح الكلوريد والهيدروكسيد والكربونات لاستخداماتها المتنوّعة، وذلك بشكل اكبر من الطلب على الصوديوم الفلزّي بحدّ ذاته. يستخدم الصوديوم مع البوتاسيوم على شكل أيون فى الكتير من الأدوية والمستحضرات الصيدلانية لتحسين التوافر الحيوي؛ رغم أفضليّة أيون البوتاسيوم فى حالات عدّة، إلّا أنّ الصوديوم هو اللى يتم اختياره لانخفاض سعره ووزنه الذرّي.[98] يستخدم الصوديوم بشكل مباشر فى تحضير مركّبات الصوديوم قليلة الانتشار فى الطبيعة، اللى لا ممكن تحضيرها من كلوريد الصوديوم، وذات التطبيقات البالخصوص مثل بيروكسيد الصوديوم وأميد الصوديوم وسيانيد الصوديوم وهيدريد الصوديوم وبورهيدريد الصوديوم وأزيد الصوديوم؛ و تحضير صبغة النيلة ومركّب ثلاثي فينيل الفوسفين.
كان الصوديوم مستخدماً لوقت طويل فى إنتاج رباعي إيثيل الرصاص من كلورو الإيثان، اللى كان يمزج فى الماضي بكثرة مع وقود السيارات كمانع للخبط فى محركات الاحتراق الداخلي؛ قبل ما يمنع لأسباب صحّية وبيئية فى أغلب دول العالم، ممّا أدّىلانخفاض إنتاج الصوديوم عالميّاً من سبعينات القرن العشرين.[99]
التحفيز
يستخدم الصوديوم فى تحفيز بلمرة 3،1-بوتاديين والإيزوبرين، وفي إنتاج المطّاط الاصطناعي.[100] كان يطلق على المطّاط الاصطناعي المنتَج باستخدام الصوديوم كحفّاز اسم بونا Buna، وكان من أوائل أنواع المطّاط الاصطناعي المنتج فى العالم.[101]
التبريد
يستخدم الصوديوم السائل فى تبريد المفاعلات النووية لقدرته العالية على نقل الحرارة.[ْ 5] فللصوديوم ناقلية حرارية تبلغ 140 واط/م.كلفن، هيا قيمة تفوق اللى للفولاذ (الصلب، 58 واط/م.كلفن)، كما أنّه سهل الانصهار وذو نقطة غليان مرتفعة نسبيّاً ممّا يمكّن من العمل فى المفاعلات تحت ضغوط عادية غير مرتفعة. كما أنّ له مقطع تصادم صغير مع النيوترونات،[102] ممّا يجعله جيّداً للاستخدام كمادة تبريد للمفاعلات النووية مثل مفاعل الاستنسال السريع،[103] اللى لا يستخدم الماء للتبريد فيها لتجنّب كبح النيوترونات.[104]
لكن من مساوئ استخدام الصوديوم فى تبريد المفاعلات النووية هو عدم شفافيّته (اعتامه)، ممّا يعيق إصلاح الأعطال بصرياً، و خطر وقوع حوادث انفجارية.[105] كما ممكن أن يتكوّن النظير صوديوم-24 عبر تنشيط النيوترون وقت التشغيل، ممّا قد يشكّل خطر إشعاع بسيط؛ فالنشاط الإشعاعي يتوقّف بعد عدّة أيام من إزالته من المفاعل.[106] لما تكون هناك الحاجة لإيقاف وإعادة تشغيل المفاعل لعدّة مرات، فإنّه من الاحسن استخدام سبيكة صوديوم-بوتاسيوم (NaK) للتبريد، إذ أنّها سائلة عند درجة حرارة الغرفة، بالتالي لا تتصلّب مادة التبريد فى الأنابيب؛[107] لكن بالمقابل يُخشى من تلقائية اشتعال البوتاسيوم، ممّا يستدعي اتخاذ إجراءات احترازية إضافية.[108]
من التطبيقات الحرارية للصوديوم كمان استخدامه فى الصمّامات القَفَّازة فى محرّكات الاحتراق الداخلي عالية الأداء؛ إذ أنّ ساق الصمام تكون مملوءةً جزئياً بالصوديوم وتعمل كأنبوب حراري لتبريد الصمّام.[109]
الإنارة
لإنارة الشوارع يستخدم أحياناً مصابيح بخار الصوديوم، اللى تتميّز بلونها الأصفر البرتقالي، اللى يتشكّل عند تعريض بخار الصوديوملتفريغ كهربائي.[110]
الاختزال
يتميّز الصوديوم بأنّه من المختزلات القويّة، و علشان كده يستخدم فى تعدين بعض الفلزّات اللى لا ممكن اختزالها بالكربون مثل التيتانيوم والزركونيوم والتانتالوم واليورانيوم والألومنيوم والمغنسيوم، لأنّ هذه الفلزات تشكّل كربيدات ثابتة حرارياً صعبة التفكك. كما ممكن استخدام البوتاسيوم لده الغرض أيضاً.
في المجال المخبري يستخدم الصوديوم كمختزل مهمّ فى الاصطناع العضوي،[111] مثل اختزال بيرتش وتفاعل ازدواج البيناكول.[112] يستخدم ناتج إذابة الصوديوم فى الأمونيا لاختزال الألكايناتلألكينات المفروقة (ترانس).[113][114]
التجفيف
بسبب القابلية المرتفعة للتفاعل لحد مع آثار من الماء، ممكن أن يستخدم سلك مضغوط من الصوديوم كمجفّف للمذيبات العضوية مثل ثنائي إيثيل الإيثر والتولوين. بالمقابل لا ممكن استخدام هذه الطريقة لتجفيف الكحولات أو المذيبات الهالوجينية (مثل ثنائي كلورو الميثان) لأنّ الصوديوم يتفاعل معها. ممكن استخدام NaK لغرض التجفيف أيضاً، تبدي ميّزات نوعية فى ده المجال. يعطي ناتج عملية التجفيف بالصوديوم (أو NaK) لوناً شديد الزرقة مع مركّب بنزوفينون.[115]
احتياطات الأمان
عند التماس مع الماء يشكّل الصوديوم غاز الهيدروجين القابل للاشتعال، و محلول هيدروكسيد الصوديوم الأكّال.[116] بالتالي فإن ابتلاع الصوديوم وتماسّه مع الجلد أو العين أو الأغشية المخاطية يسبّب حروقاً شديدة.[117][118] ينفجر الصوديوم بشكل تلقائي بوجود المؤكسدات.[119]
إنّ مطافئ الحريق ذات الأساس المائي غير مناسبة لإطفاء حرائق الصوديوم، فهي تعمل بالعكس على تسريعها، كما ينبغي تجنّب استعمال مطافئ ذات أساس من ثنائي أكسيد الكربون وبرومو كلورو ثنائي فلورو الميثان (هالون 1211) أيضاً. يستخدم لإطفاء حرائق الفلزّات مطافئ من الصنف D (بودرة جافّة)، اللى يعتمد بعضها مثلاً (Lith-X) على مسحوق من الغرافيت والرمل ومثبّط لهب فوسفاتي عضوي.[120]
تُكافَح حرائق الصوديوم فى المفاعلات النووية بعزل الصوديوم عن الأكسجين بإحاطة أنابيب الصوديوم بغاز خامل.[121] أمّا حرائق الصوديوم ذات النمط البِرَكي فتكافَح بأسلوب مختلف يعتمد على تجميع الصوديوم المتسرّب وسَوقِهلخزّانات استرجاع لعزله عن الأكسجين.
المراجع
باللغة العربية
بلغات أجنبية
لينكات برانيه
- الصوديوم فى فيديوهات الجدول الدوري (من جامعة نوتنجهام)
- أصل كلمة "natrium" – مصدر الرمز Na








