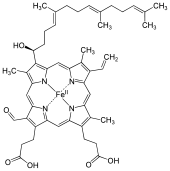
Hemo A
O hemo A é un complexo de coordinación de tipo hemo, que consta dun ligando macrocíclico chamado porfirina, quelado a un ión ferro. O hemo A é unha biomolécula producida por moitos organismos. Está presente, por exemplo, na citocromo c oxidase. Os detalles dos substituítes colgados do anel diferénciano doutros hemos.
| Hemo A | |
|---|---|
 |  |
Outros nomes Ferro citoporfirina IX, formilporfirina | |
| Identificadores | |
| Número CAS | 18535-39-2 |
| PubChem | 5288529 |
| ChemSpider | 21106444 |
| MeSH | Heme+a |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C49H56O6N4Fe |
| Masa molecular | 852,837 |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
Relación con outros hemos
O hemo A difire do hemo B en que o grupo metilo que ten este último unido ao anel na posición 8 está oxidado a grupo formilo no hemo A, e en que ten un grupo hidroxietilfarnesil (unha cadea isoprenoide) unida á cadea lateral vinilo na posición 2 do anel do tetrapirrol. O hemo A parécese ao hemo O en que ten igual ca el esta adición farnesilo na posición 2, pero o hemo O carece do grupo formilo en posición 8 (conserva o metilo). A estrutura correcta do hemo A, baseada en experimentos de Resonancia Magnética nuclear (NMR) e IR da forma reducida, con Fe(II), do hemo, foi publicada en 1975.[1]
Historia
O hemo A foi illado por primeira vez polo bioquímico alemán Otto Warburg en 1951, que demostrou que era un activo compoñente da metaloproteína integral de membrana citocromo c oxidase.[2]
Estereoquímica
A resolución da cuestión estrutural final sobre a configuración xeométrica exacta no primeiro carbono na posición 3 do anel I, que é o carbono unido ao grupo hidroxilo, publicouse recentemente, e tratábase dunha configuración S quiral.[3]
Igual ca o hemo B, o hemo A está a miúdo unido a unha apoproteína por medio de enlaces coordinados entre o ferro hémico e unha cadea lateral de aminoácido conservada. Na importante proteína respiratoria citocromo c oxidase (CCO) este ligando 5 do hemo A no centro de reacción co oxíxeno é un grupo histidil.[4] Este é un ligando común en moitas hemoproteínas, como a hemoglobina e a mioglobina.

Un exemplo de metaloproteína que conteña hemo A é a citocromo c oxidase. Esta proteína enormemente complicada contén hemo A en dous sitios diferentes, cada un cunha función distinta. O ferro do hemo A do citocromo a está hexacoordinado, é dicir, unido a outros seis átomos. O ferro do hemo A do citocromo a3 (que tamén forma parte do complexo) está ás veces unido a cinco átomos e deixa o sesto sitio dispoñible para que se una alí o oxíxeno molecular (O2).[5] Ademais, este encima únese a tres ións cobre, magnesio, cinc, e varios ións potasio e sodio. Crese que os dous grupos hemo A na citocromo c oxidase intercambian doadamente electróns entre eles, e os ións cobre e a proteína fortemente asociada citocromo c.
Tanto o grupo formilo coma a cadea lateral isoprenoide pénsase que xogan importantes papeis na conservación da enerxía da redución do oxíxeno molecular pola citocromo c oxidase, seguramente ao bombear protóns no espazo mitocondrial interno. Crese que tanto o grupo formilo coma o hidroxietilfarnesil do hemo A xogan un importante papel neste proceso crucial como publicou o grupo de S. Yoshikawa.[6]
Notas
Véxase tamén
Outros artigos
- Hemo, Hemo B, Hemo C, Hemo O
- Hemoproteína
- Citocromo c oxidase (Complexo IV da respiración celular)