Berillium-klorid
A berillium-klorid a berillium klórral alkotott vegyülete, képlete BeCl2. Elektrolízissel fém berilliumot lehet belőle előállítani. Színtelen, higroszkópos szilárd anyag, jól oldódik sok poláros oldószerben. Tulajdonságai hasonlóak az alumínium-klorid tulajdonságaihoz.
| berillium-klorid | |||
 | |||
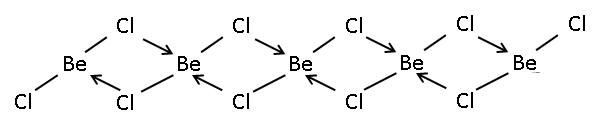
| berillium-klorid polimer | |||
 | |||
| Más nevek | berillium-diklorid berillium(II)-klorid | ||
| Kémiai azonosítók | |||
| CAS-szám | 7787-47-5 | ||
| PubChem | 24588 | ||
| ChemSpider | 22991 | ||
| |||
| |||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | BeCl2 | ||
| Moláris tömeg | 79,9182 g·mol−1 | ||
| Megjelenés | színtelen, folyós kristályok | ||
| Sűrűség | 1,899 g·cm−3 | ||
| Olvadáspont | 405 °C | ||
| Forráspont | 482 °C | ||
| Oldhatóság (vízben) | jól oldódik, 15,1 g/100 ml (20 °C) | ||
| Oldószerei | jól oldódik etanolban, alkoholokban, éterben, benzolban és a szerves oldószerekben, gyengén oldódik kloroformban és kén-dioxidban | ||
| Kristályszerkezet | |||
| Kristályszerkezet | hexagonális | ||
| Termokémia | |||
| Std. képződési entalpia ΔfH | −490,4 kJ/mol | ||
| Standard moláris entrópia S | 63 J/mol K | ||
| Hőkapacitás, C | 7,808 J/K vagy 71,1 J/mol K | ||
| Veszélyek | |||
| Főbb veszélyek | nagyon mérgező, egészségre veszélyes, környezetre veszélyes, | ||
| R mondatok | R49 R25 R26 R36/37/38 R43 R48/23 R51/53 | ||
| S mondatok | S53 S45 S61 | ||
| LD50 | 86–200 mg·kg−1 patkány, szájon át[1] 92 mg·kg−1egér, szájon át[2] | ||
| Rokon vegyületek | |||
| Azonos kation | Berillium-fluorid Berillium-bromid Berillium-jodid | ||
| Azonos anion | Magnézium-klorid kalcium-klorid Stroncium-klorid Bárium-klorid Rádium-klorid | ||
| Az infoboxban SI-mértékegységek szerepelnek. Ahol lehetséges, az adatok standardállapotra (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. Az ezektől való eltérést egyértelműen jelezzük. | |||
Előállítása
Az iparban berillium-oxid, szén és klór reakciójával állítják elő körülbelül 800 °C-on:[3]
Elő lehet állítani berillium és klór reakciójával magas hőmérsékleten:[4]
- Be + Cl2 → BeCl2
De elő lehet állítani fém berillium és hidrogén-klorid reakciójával.
Tulajdonságai
A Be−Cl kötés erősen kovalens jellegű, így az anyag nem alkot ionrácsot. Minden berilliumcentrum körül négy klóratom van tetraéderesen, a szilícium-dioxidhoz hasonlóan. Stabil a száraz levegőn.
A gáznemű berillium-klorid lineáris monomer, vagy dimer. Gyenge π-kötés (viszontkoordináció) történik a klórról a berilliumra, utóbbi elektronhiányos voltát kompenzálandó. A dimerizáció két áthidaló klóratomon keresztül jön létre. A berillium koordinációs száma ilyenkor 3. A Be−Cl kötéstávolság 170 pm.[5] A lineáris alak elüt a 2. csoportban lentebb található elemek által alkotott dihalogenidek monomer formáinak egy részétől, például a CaF2, SrF2, BaF2, SrCl2, BaCl2, BaBr2 és BaI2 egyike sem lineáris szerkezetű.
Szilárd formában 1 dimenziós polimer, szemben a berillium-fluoriddal, mely 3 dimenziós polimer, a kvarcéra hasonlító szerkezettel.[6]
Hidrolízise erősen exoterm, vizes oldata savas kémhatású:

A tetraakva-berillium kationok reagálnak a vízzel és disszociálódnak.
A berillium-klorid Lewis-sav. Alkoholokban vagy éterekben oldva adduktumokat képez.
Hidrolízisekor hidrogén-klorid keletkezik:
- BeCl2 + 2H2O → Be(OH)2 + 2 HCl
Tetrahidrátot képez: BeCl2•4H2O ([Be(H2O)4]Cl2). Oldódik az oxigéntartalmú oldószerekben, például az éterekben.[7]
Nátriummal levegőtől elzártan megolvasztva elemi berilliummá redukálódik.[8]
Felhasználása
Katalizátorként lehet használni Friedel–Crafts-alkilezéseknél. Elektrolízissel fém berilliumot lehet belőle előállítani. Néhány szerves reakcióban katalizátorként használják.
Források
Fordítás
Ez a szócikk részben vagy egészben a Berylliumchlorid című német Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Ez a szócikk részben vagy egészben a Beryllium chloride című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További információk
- Beryllium chloride at IPCS INTOX adatbank
- Properties of BeCl2 from NIST