塩化ベリリウム
塩化ベリリウム(えんかベリリウム、beryllium chloride)は、化学式 BeCl2 で表されるベリリウムの塩化物である。
| 塩化ベリリウム | |
|---|---|
 | |
塩化ベリリウム | |
| 識別情報 | |
| CAS登録番号 | 7787-47-5 |
| PubChem | 24588 |
| RTECS番号 | DS2625000 |
| 特性 | |
| 化学式 | BeCl2 |
| モル質量 | 79.9176 g/mol |
| 外観 | 無色結晶 |
| 密度 | 1.899 g/cm3(無水物) 1,713 g/cm3(四水和物) |
| 融点 | 440 °C, 713 K, 824 °F ([2]) |
| 沸点 | 547 °C, 820 K, 1017 °F |
| 水への溶解度 | 42.24 g/100 g溶液(20℃)[1] |
| 構造 | |
| 結晶構造 | 単斜晶系 |
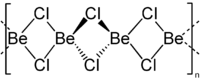
| 分子の形 | 直線状 |
| 熱化学 | |
| 標準生成熱 ΔfH | −495.8 kJ mol−1(β) −490.4 kJ mol−1(α)[3] |
| 標準モルエントロピー S | 75.81 J mol−1K−1(β) 82.68 J mol−1K−1(α) |
| 標準定圧モル比熱, Cp | 62.43 J mol−1K−1(β) 64.85 J mol−1K−1(α) |
| 危険性 | |
| EU分類 | 猛毒 (T+) 環境への危険性 (N) |
| Rフレーズ | R49, R25, R26, R36/37/38, R43, R48/23, R51/53 |
| Sフレーズ | S45, S53, S61 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | フッ化ベリリウム 臭化ベリリウム ヨウ化ベリリウム |
| その他の陽イオン | 塩化マグネシウム 塩化カルシウム 塩化ストロンチウム 塩化バリウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
甘味を有する物質として知られているが、猛毒である。この性質のため、ベリリウムは当初グルシニウム(glucinium, ギリシア語で甘さを意味する glykys から)と呼ばれた。
製法
酸化ベリリウムあるいは水酸化ベリリウムを塩酸に溶解し濃縮すると四水和物が析出する[2]。89℃以上では二水和物が析出する[1]。
無水物は、高温で硫酸ベリリウムと炭素の混合物に塩素を反応させると得られる[2]。
または酸化ベリリウムと炭素の混合物に塩素を反応させても得られる[4]。
性質
無水物は水に易溶性の無色結晶で吸湿性が強く、水に溶解する際、激しく発熱する。無水物は分子性が強く、エタノール、ジエチルエーテル、アセトンおよびアミンなど多くの有機溶媒にも溶解して溶媒が2分子付加した錯体BeCl2·2Aを生成する[2]。ルイス酸としてもはたらき有機反応において塩化アルミニウムと類似の挙動を示す[5]。
水溶液は加水分解により酸性を示す。また四水和物は五酸化二リンを用いても脱水できず、加熱すると100℃付近から分解して塩基性塩を生じさらに強熱により酸化物になる。







