Perak oksida
Perak(I) oksida adalah senyawa kimia dengan rumus Ag2O. Ini adalah bubuk hitam atau coklat gelap halus yang digunakan untuk menyiapkan senyawa perak lainnya.
 | |
 | |
| Nama | |
|---|---|
| Nama IUPAC Perak(I) oksida | |
| Nama lain Silver rust, Argentous oxide, Silver monoxide | |
| Penanda | |
Model 3D (JSmol) | |
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
| MeSH | silver+oxide |
PubChem CID | |
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA) | |
| |
| |
| Sifat | |
| Ag2O | |
| Massa molar | 231,74 g·mol−1 |
| Penampilan | kristal hitam/cokelat |
| Bau | tidak berbau[1] |
| Densitas | 7.14 g/cm3 |
| Titik lebur | 300 °C (572 °F; 573 K) terurai mulai ≥200 °C[3][4] |
| 0.013 g/L (20 °C) 0.025 g/L (25 °C)[2] 0.053 g/L (80 °C)[3] | |
| Hasil kali kelarutan, Ksp pada AgOH | 1.52·10−8 (20 °C) |
| Kelarutan | larut dalam asam, basa tidak larut dalam etanol[2] |
| −134.0·10−6 cm3/mol | |
| Struktur | |
| kubik | |
| Pn3m, 224 | |
| Termokimia | |
| Kapasitas kalor (C) | 65.9 J/mol·K[2] |
| Entropi molar standar (S | 122 J/mol·K[5] |
| Entalpi pembentukan standar (ΔfH | −31 kJ/mol[5] |
| Energi bebas Gibbs (ΔfG) | −11.3 kJ/mol[4] |
| Bahaya | |
| Piktogram GHS |   [6] [6] |
| Keterangan bahaya GHS | {{{value}}} |
| H272, H315, H319, H335[6] | |
| P220, P261, P305+351+338[6] | |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median) | 2.82 g/kg (tikus, melalui mulut)[1] |
| Senyawa terkait | |
Senyawa terkait | Perak(I,III) oksida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Persiapan

Perak(I) oksida diproduksi dengan mereaksikan litium hidroksida dengan larutan perak nitrat yang sangat encerPerak oksida dapat dibuat dengan menggabungkan larutan perak nitrat dan alkali hidroksida.[7][8] Reaksi ini tidak menghasilkan perak hidroksida dalam jumlah yang cukup karena energetik yang disukai untuk reaksi berikut:[9]
2AgOH → Ag2O + H2O (pK = 2.875[10])
Paten AS 20050050990 menjelaskan persiapan Ag2O dengan sifat-sifat yang cocok untuk digunakan sebagai pengisi pasta konduktif berbutir halus.
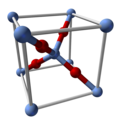
Struktur dan properti
Ag2O memiliki pusat Ag dua-koordinat linier yang dihubungkan oleh oksida tetrahedral. Ini isostruktural dengan Cu2O. Ini "larut" dalam pelarut yang menurunkannya. Ini sedikit larut dalam air karena pembentukan ion Ag(OH)2– dan produk hidrolisis yang mungkin terkait.[11] Ini larut dalam larutan amonia untuk memberikan turunan larut. Bubuk Ag2O mudah diserang oleh asam:
Ag2O + 2 HX → 2 AgX + H2O
di mana HX = HF, HCl, HBr, atau HI, HO2CCF3. Ini juga akan bereaksi dengan larutan alkali klorida untuk mengendapkan perak klorida, meninggalkan larutan alkali hidroksida yang sesuai.[11][12]
Seperti banyak senyawa perak, oksida perak adalah fotosensitif. Ini juga terurai pada suhu di atas 280 °C.[13]
Penggunaan
Oksida ini digunakan dalam baterai perak-oksida. Dalam kimia organik, oksida perak digunakan sebagai zat pengoksidasi ringan. Misalnya, ia mengoksidasi aldehida menjadi asam karboksilat. Reaksi semacam itu sering kali bekerja paling baik ketika oksida perak dibuat in situ dari perak nitrat dan alkali hidroksida.