Нейропластичність
Нейропласти́чність (англ. Neuroplasticity) або пластичність мозку — здатність мозку змінюватися та адаптуватися протягом життя. Це процес, за допомогою якого мозок реорганізується у відповідь на новий досвід, навчання та вплив навколишнього середовища.[1][2]

Нейропластичність є ключовим механізмом, що лежить в основі навчання та пам’яті. Коли людина чи тварина дізнається щось нове, мозок формує нові зв’язки між нейронами або зміцнює існуючі зв’язки, щоб зберігати та відтворювати цю інформацію. З часом повторне навчання може призвести до тривалих змін у структурі та функціях мозку.[1]
Нейропластичність також відіграє важливу роль у відновленні після травм головного мозку або неврологічних розладів. У деяких випадках мозок може реорганізуватися, щоб компенсувати пошкоджені або втрачені функції, дозволяючи людям відновити функціональність.[3]
Дослідження нейропластичності є вагомим та інформативним для розвитку таких галузей, як освіта, медицина (лікування і реабілітація)[4], психічне здоров'я[5] та нейронаукові дослідження.[1][2] Дослідники продовжують вивчати нейропластичність, прагнучи розкрити її повний потенціал у покращенні навчання, лікуванні неврологічних захворювань і покращенні загальної функції мозку протягом усього життя.
Історія
Термінологія
Термін «пластичність» вперше застосував до поведінки в 1890 році Вільям Джеймс у «Принципах психології», де цей термін використовувався для опису «структури, достатньо слабкої, щоб зазнати впливу, але достатньо сильної, щоб не піддатися всім одразу».[3]
Хоча на початку 1900-х років мозок зазвичай розглядався як невідновлюваний орган, Сантьяго Рамон-і-Кахаль, використовував термін «нейрональна пластичність» для опису непатологічних змін у структурі мозку дорослих.[6] Базуючись на своїй «Доктрині нейронів», Кахаль вперше описав нейрон як фундаментальну одиницю нервової системи, яка згодом послужила суттєвою основою для розробки концепції нейронної пластичності. Він використовував термін пластичність стосовно своєї роботи щодо виявлення дегенерації та регенерації в центральній нервовій системі, зокрема, після досягнення людиною дорослого віку. Багато нейробіологів використовували термін «пластичність» лише для пояснення регенеративної здатності периферичної нервової системи, і концептуальне перенесення цього терміну Кахалем викликало суперечливу дискусію.[7]
Першим, хто використав термін «нейропластичність», був польський нейробіолог Єжи Конорський.[8]
Дослідження та відкриття
У XIX столітті Чарлз Дарвін вважав, що пластичність інстинктів, що виникає з мінливості їх вроджених морфологічних основ і дає «матеріал» для дії природного добору, є достатньою для еволюції інстинктивної поведінки, — і є поведінкою взагалі.[9]
У 1923 році Карл Лешлі провів експерименти на мавпах-резусах, які продемонстрували зміни в нейронних шляхах, які, як він дійшов висновку, є доказом пластичності. Незважаючи на це та інші дослідження, які свідчили про пластичність, нейробіологи того часу не сприйняли ідею нейропластичності.[10]
У 1949 році Дональд Гебб стверджував, що нейронні зв'язки не є статичними — їх можна покращувати кожного разу, коли вони активуються. Ця гіпотеза відома як «правило Гебба». Воно передбачає, що процес навчання не є результатом фіксованої властивості нейронів; це залежна від часу функція їх змінних зв'язків. Основна ідея, яка лежить в основі правила Гебба, полягає в тому, що скупчення нейронів мають тенденцію збуджуватися разом, коли сприймається подразник. Їх коливальна активність може тривати і після припинення дії подразника. Таким чином, подія, яка спричинила одночасне коливання групи нейронів, фіксується в пам’яті у вигляді групи синхронізованих нейронів.[11]
Лише в 1960-х роках нейробіологи усвідомили, що жертви інсульту часто відновлювали певні когнітивні функції, якщо вони виконували адекватні розумові та/або фізичні вправи під медичним контролем після інсульту. Меріан Даймонд з Каліфорнійського університету в Берклі надала перші наукові докази анатомічної пластичності мозку пацюків, опублікувавши своє дослідження в 1964 році.[12][13] Пол Бах-і-Ріта показав, що різні ділянки нашого мозку можуть реорганізовуватись для компенсації різних сенсорних областей, пошкоджених інсультом.[14] Він створив прилади, які дозвляли сліпим людям "бачити" спиною, а паціентам з пошкодженим вестибулярним апаратом утримувати рівновагу.[15] Це було яскравим доказом того, що мозок здатний реорганізовуватися, змінюючи нейронні зв’язки і в зрілому віці.
У 1983 році Майкл Мерценіч і Джон Каас, досліджуючи мозок мавп, отримали значні експериментальні результати, які підтверджують гіпотезу про те, що мозок має «пластичну поведінку» протягом усього життя.[16][17]
У 21-му столітті концепція нейропластичності широко прийнята в нейронауках. Вагомий історичний огляд концепції нейропластичності, разом із цікавими історіями випадків про здатність нашого мозку змінювати власну структуру, надає в своїх книгах психіатр і психоаналітик Норман Дойдж. Автор описує, як нейронні ланцюги мозку дорослої людини можуть перебудовуватися протягом усього життя. Наприклад, аналіз зображень мозку студентів університету, які готувалися до іспитів, продемонстрував, що їх сіра речовина збільшилася в задній і латеральній тім’яній корі протягом декількох місяців.[10]
Природа та механізми нейропластичності


Нейропластичність — це здатність нервової системи адаптуватися і змінюватися у відповідь на досвід. Різні наукові дисципліни вивчають і пояснюють нейропластичність на різних рівнях організації — на молекулярному, клітинному і системному.
Одним із ключових механізмів нейропластичності є посилення та ослаблення сили синапсів — зв’язків між нейронами. Цей процес відомий як синаптична пластичність. Синаптична пластичність буває короткочасна і довгострокова.[18]
Короткочасна пластичність може виникати швидко та тимчасово (секунди-хвилини) у відповідь на зміни пресинаптичної активності. Вона включає зміни в ефективності вивільнення нейромедіатора в пресинаптичній терміналі або зміни в чутливості або кількості постсинаптичних рецепторів.
Довгострокова пластичність, зазвичай, виникає у відповідь на повторну або тривалу стимуляцію синапсу. Довгострокова пластичність формується протягом годин і зберігається протягом тривалого часу. Вона включає зміни в структурі та/або функції синапсів, такі як зміни в кількості рецепторів, зміни в кількості мітохондрій поблизу синапсу та зміни в морфології дендритних шипиків. Такі зміни полегшують або ускладнюють проведення імпульсу між конкретними нейронами.
Як короткочасну, так і довгострокову пластичність можна спостерігати за допомогою електрофізіологічних вимірювань синаптичної передачі, таких як зміни амплітуди або частоти синаптичних струмів або потенціалів.[19] Крім того, довгострокову пластичність також можна спостерігати через структурні та функціональні зміни в синапсах за допомогою методів візуалізації, таких як електронна мікроскопія або двофотонна мікроскопія.[20][21]
Молекулярний рівень

Одним із ключових механізмів нейропластичності є посилення та ослаблення синапсів, які є зв’язками між нейронами. Цей процес відомий як синаптична пластичність і опосередковується змінами властивостей іонних каналів, рецепторів нейромедіаторів і внутрішньоклітинних сигнальних шляхів, які призводять до змін в експресії генів і синтезі білків.
Короткочасна синаптична пластичність

Короткочасна синаптична пластичність, як правило, пов’язана зі змінами в ефективності вивільнення нейромедіаторів і може виникати швидко та тимчасово у відповідь на зміни пресинаптичної активності.[22] Одним з механізмів, що лежить в основі короткочасної пластичності, є активація пресинаптичних кальцієвих каналів потенціалами дії, що призводить до збільшення припливу кальцію в пресинаптичну терміналь.[23] Таке підвищення рівня кальцію може активувати низку низхідних сигнальних шляхів, включаючи активацію Ca2+/кальмодулін-залежної протеїнкінази II (CaMKII) і протеїнкінази C, що може призвести до збільшення ймовірності вивільнення нейромедіатора або підвищення чутливості постсинаптичних рецепторів.[24][25]
Іншим механізмом короткочасної пластичності є короткочасна фасилітація та короткочасна депресія: деякі синапси призводять до короткочасної фасилітації, коли амплітуда постсинаптичної відповіді збільшується у відповідь на повторну пресинаптичну стимуляцію. Це може статися через зміни властивостей пресинаптичних везикул, наприклад збільшення кількості нейромедіатора, що виділяється на везикулу, або збільшення кількості вивільнених везикул. І навпаки, короткочасна депресія може виникнути через виснаження пресинаптичних везикул або зниження ймовірності вивільнення везикул.[26][27]
Ще одним механізмом короткочасної пластичності є модуляція рецепторів та іонних каналів — як пресинаптичних, так і постсинаптичних. Пресинаптичні іонні канали, такі як напругозалежні кальцієві канали, можуть модулюватися різними сигнальними шляхами, щоб впливати на ймовірність вивільнення нейромедіатора. Наприклад, активація пресинаптичних метаботропних глутаматних рецепторів (mGluRs) може призвести до зниження ймовірності вивільнення нейромедіатора шляхом інгібування припливу кальцію в пресинаптичну термінал.[28][29][30] Постсинаптичні рецептори також можна модулювати, щоб впливати на амплітуду та тривалість постсинаптичних відповідей. Наприклад, активація рецепторів, зв’язаних з G-протеїном (GPCR), може призводити до змін у провідності постсинаптичних іонних каналів, впливаючи на величину постсинаптичної відповіді. Крім того, зміни у властивостях постсинаптичних рецепторів, такі як зміни в стані фосфорилювання рецепторів, можуть впливати на їх чутливість до нейромедіатора.[31]
Довгострокова синаптична пластичність
Довгострокова синаптична пластичність є власне тип процесом який сприяє довгостроковій реорганізації мозку, тобто довгостроковій пам'яті. Вона пов’язана зі змінами в структурі та функції синапсів і може відбуватися протягом тривалого періоду часу у відповідь на стійкі зміни в пресинаптичній активності — тобто на тривале і повторне збудження.
Одним із добре вивчених механізмів довгострокової синаптичної пластичності є довготривале потенціювання, яке вважається клітинним механізмом, що лежить в основі навчання та пам’яті. Довготривале потенціювання ініціюється активацією рецепторів N-метил-D-аспартату (NMDA-рецепторів) нейромедіатором глутаматом, що призводить до збудження і надходження кальцію в постсинаптичний нейрон. Цей приплив кальцію може активувати низку низхідних сигнальних шляхів, що призводить до активації кіназ, які можуть фосфорилювати білки та змінювати їхню функцію, включаючи активацію CaMKII та CREB, що може призводити до змін у структурі та функції синапсів, таких як збільшення кількості або чутливості постсинаптичних рецепторів, змін у властивостях іонних каналів, і змін у розмірі та формі дендритних шипиків.[32]
CREB активується сигнальним каскадом, який запускається підвищеними рівнями внутрішньоклітинного цАМФ, який може бути індукований, крім нейромедіаторів як глутамат, також факторами росту та нейромодуляторами. Після активації, CREB зв’язується зі специфічними послідовностями ДНК, відомими як елементи відповіді цАМФ (CRE), розташовані в регуляторних областях цільових генів.[33] Це зв’язування призводить до рекрутування білків-коактиваторів, які, у свою чергу, сприяють транскрипції цільових генів у інформаційну РНК (мРНК), яка може транслюватись у білки, необхідні для посилення синаптичної сили — укріплення довгострокової пам'яті. Багато генів, які беруть участь у нейропластичності, регулюються CREB прямо чи опосередковано. Наприклад, кілька ранніх генів (IEG), які беруть участь у синаптичній пластичності та формуванні пам’яті, включаючи c-fos, Arc і Egr1, регулюються CREB.[34] Крім того, гени, які кодують фактори росту, — члени родини BDNF, такі як нейротрофін-3 (NTF-3) і нейротрофін-4/5 (NTF-4/5), також регулюються CREB.[35][36] Таким чином, CREB є критично важливим регулятором експресії генів залучених в механізмах довгострокової синаптичної пластичності.
Іншим важливим механізмом довгострокової синаптичної пластичності є утворення нових синапсів. Цей процес включає ріст нових дендритних шипиків і утворення нових зв’язків між нейронами. Це може бути спровоковано вивільненням факторів росту, таких як нейротрофічний фактор мозку (BDNF), який може сприяти зростанню нових синапсів і посилювати синаптичну пластичність.[37]
Також, вважається, що регуляція мітохондріального біогенезу та функцій мітохондрій відіграє ключову роль у забезпеченні енергією, необхідною для підтримки клітинних процесів, які лежать в основі довгострокової синаптичної пластичності.[38][39] У нейронах мітохондрії виконують різноманітні функції, такі як виробництво енергії у формі АТФ, буферизація кальцію та генерація активних форм кисню.[39] Одним з важливих механізмів збільшення кількості мітохондрій в активних синапсах є активація коактиватора транскрипції PGC-1α (гамма-коактиватор 1-альфа рецептора, що активується проліфератором пероксисом), який, як відомо, регулює мітохондріальний біогенез і функціонує у відповідь на підвищену потребу в енергії. PGC-1α активується фактором транскрипції NRF-1 (ядерний респіраторний фактор 1), який зв’язується з промоторними ділянками мітохондріальних генів, що кодуються в ядрах, і посилює їх експресію. Це призводить до збільшення мітохондріального біогенезу, і щойно синтезовані мітохондрії спрямовуються до синапсів, які відчувають підвищену потребу в енергії.[40] Інший механізм включає активацію протеїнкінази AMPK (AMP-активована протеїнкіназа), яка є ключовим регулятором гомеостазу клітинної енергії. Активація AMPK призводить до фосфорилювання кількох наступних мішеней, включаючи PGC-1α, що посилює мітохондріальний біогенез.[41] Крім того, AMPK також може регулювати транспортування мітохондрій до синапсу шляхом фосфорилювання мітохондріального моторного білка Miro, який контролює рух мітохондрій уздовж мікротрубочок.[42][43][44] Нарешті, дослідження також показали участь процесів поділу та злиття мітохондрій у регуляції розподілу мітохондрій у синапсах.[45][46][47] Ці процеси контролюються декількома білками, включаючи DRP1 (пов’язаний з динаміном білок 1) і MFN1/2 (мітофузин 1/2), і вважається, що вони відіграють певну роль у регулюванні кількості мітохондрій у синапсах.[48][49][50][51] Простими словами — повторна й тривала активація певного синапсу призводить до поступового збільшення кількості мітохондрій в нейронних відростках синапсу, що спрощує проведення імпульсу між нейронами синапсу, і закріплює довгострокову пам'ять. Чим частіше і регулярніше повторення — тим легше проведення імпульсу.
Типи нейропластичності
Jordan H. Grafman виділив 4 типи кортикальної нейропластичності (макрорівень):
- адаптація гомологічної зони — при пошкодженні ділянки мозку з одного боку, її функція переноситься до гомологічної ділянки у протилежній півкулі мозку (як приклад, при пошкодженні правої тім'яної ділянки її функцію перебирає ліва тім'яна ділянка).
- компенсаційний маскарад — мозок виробляє альтернативну стратегію виконання завдання коли початкова стратегія не може бути дотримана через її недоціль ність або порушення одного з її етапів (як приклад, здійснення переміщення за допомогою не просторової орієнтації, яка є порушеною, а за допомогою словесних інструкцій)
- перехресне перепризначення — адаптаційна реорганізація нейронів для інтеграції функцій двох або більше сенсорних систем (як приклад, незрячі від народження можуть формувати уявлення про навколишній світ на основі не зорових, а дотикових подразників)
- розширення карти — гнучкість ділянок мозку, які призначені для виконання одного типу функцій або зберігання певної форми інформації (як приклад, постійні заняття з навчання грі на скрипці стимулюють розширення слухової зони кори)
Сучасні дослідження
Нейронауки
Молекулярна нейронаука
Молекулярна нейронаука вивчає молекулярні механізми, які лежать в основі змін у синаптичному зв’язку та функції нейронів у відповідь на новий досвід і навчання. Молекулярна нейронаука охоплює широкий діапазон досліджень, включаючи регуляцію експресії генів, синтез білків та посттрансляційні модифікації. Дослідження молекулярного рівня пластичності мозку охоплює численні специфічні білки (ферменти, рецептори, структурні білки тощо), які беруть участь у багатьох координованих і взаємодіючих сигнальних і метаболічних процесах; їхня модуляція утворює молекулярну основу для пластичності мозку.[53][54]

Експресія генів і синтез білків: Одним із ключових напрямків дослідження нейропластичності в молекулярній нейронауці є дослідження того, як зміни в експресії генів і синтезі білків сприяють формуванню та зміцненню синаптичних зв’язків між нейронами. Наприклад, як фактори транскрипції та інші регуляторні молекули контролюють експресію генів, які беруть участь у синаптичній пластичності та навчанні.[56][57][58][59][60]
Щільність рецепторів: ще одним напрямом дослідження нейропластичності в молекулярній нейронауці є вивчення того, як сигнальні системи клітин та посттрансляційні модифікації регулюють активність іонних каналів і рецепторів, які опосередковують синаптичну передачу. Наприклад, як фосфорилювання, убіквітинування та інші модифікації впливають на функцію глутаматних рецепторів та інших ключових білків, залучених до синаптичної пластичності.[61][62][63][64]

Психопластогени: крім того, молекулярна нейронаука може бути використана для розробки втручань, спрямованих на конкретні молекулярні механізми для підвищення синаптичної пластичності та сприяння відновленню після травми головного мозку або захворювання. Наприклад, дослідники можуть використовувати невеликі молекули або інші фармакологічні агенти для модуляції активності ключових сигнальних шляхів або ферментів, які беруть участь у синтезі білка, для підвищення синаптичної пластичності та покращення когнітивних функцій (див. Психопластогени, Психоделічніа психотерапія).[65][66][67][68][69]
Мітохондріальна щільність: перспективними є також дослідження мітохондріального біогенезу та мітохондріальної динаміки в активних нейронах. Мітохондрії відіграють вирішальну роль у регулюванні синаптичної пластичності, і останні дослідження показали, що зміни в динаміці мітохондрій (наприклад, поділ і злиття) можуть впливати на синаптичну функцію та пластичність. Розуміння молекулярних механізмів, що лежать в основі цих процесів, може створити нові цілі для терапевтичного втручання при неврологічних розладах.[70][71]
Мультиоміка нейрона – це комплексний підхід у молекулярній нейронауці, який об’єднує дані з епігеноміки[43][44][45][46], геноміки[47][48], транскриптоміки[49][50][51], протеоміки[53][54][56][57], метаболоміки та інших -омік, щоб зрозуміти ансамбль молекулярних взаємодій в мозку з точку зору нормальної фізіології[58][72] чи патології[59], включно з методами дослідження та впливу на механізми нейропластичності. Геномні та епігеномні дослідження підкреслюють, як генні варіації та епігеномні надстройки, спричинені навколишнім середовищем та способом життя, впливають на пластичність мозку, тоді як транскриптоміка виявляє складні моделі експресії генів. Протеомний і метаболомічний аналізи висвітлюють ключові шляхи білків і метаболіти, залучені до нейрональних змін. Інтеграція цих мультиомічних даних, та їх аналіз з допомогою машинного навчання та штучного інтелекту, може дати цінну інформацію для лікування неврологічних розладів чи посилення інтелекту.[60][61][72]
Клітинна нейронаука
Клітинна нейронаука вивчає клітинні механізми, які лежать в основі змін у синаптичних зв’язках та функції нейронів у відповідь на досвід і навчання. Клітинна нейронаука охоплює різноманітні напрямки досліджень, включаючи властивості окремих нейронів, організацію нейронних ланцюгів і взаємодію між різними типами нейронів.
Одним із ключових напрямків дослідження клітинної нейронауки нейропластичності є дослідження того, як зміни синаптичної сили та пластичності сприяють навчанню та пам’яті. Наприклад, як довготривала потенціація (LTP) і довготривале пригнічення (LTD) синаптичної передачі сприяють формуванню та консолідації спогадів.[73][74][75][76][77]
Іншим напрямком дослідження клітинної нейронауки нейропластичності є вивчення того, як різні типи нейронів і гліальних клітин сприяють формуванню та підтримці нейронних ланцюгів.[78][79] Наприклад, як різні типи гальмівних інтернейронів регулюють активність збудливих нейронів і сприяють функціонуванню нейронних ланцюгів.[80][81][82]
Крім того, клітинна нейронаука може бути використана для розробки втручань, спрямованих на конкретні клітинні механізми для підвищення синаптичної пластичності та сприяння відновленню після травми головного мозку або захворювання. Наприклад, дослідники можуть використовувати оптогенетику або інші методи, щоб маніпулювати активністю певних типів нейронів, щоб посилити або загальмувати їхню активність і вплинути на функцію нейронних ланцюгів.[83][84][85][86][87]
Поведінкова нейронаука
Поведінкова нейронаука нейропластичності вивчає як зміни в поведінці та досвіді можуть впливати на структуру та функції мозку на клітинному та системному рівнях. Поведінкова нейронаука охоплює широкий спектр дослідницьких областей, включаючи навчання та пам'ять, сенсорну обробку та руховий контроль.
Одним із ключових напрямків дослідження нейропластичності в поведінковій нейронауці є дослідження того, як різні типи досвіду та навчання можуть впливати на формування та зміцнення синаптичних зв’язків між нейронами.[88] Наприклад, дослідники можуть вивчати, як вплив нових подразників або збагачення середовища може підвищити синаптичну пластичність і покращити когнітивні функції.[89][90][91][92][93]
Ще одним напрямом дослідження нейропластичності в поведінковій нейронауці є вивчення того, як спричинені досвідом зміни в мозку сприяють розвитку неврологічних розладів.[94] Наприклад, як хронічний стрес або психологічна травма можуть призвести до змін у нейронних ланцюгах, які сприяють розвитку депресії чи тривожних розладів.[95][96][97][98][99][100]
Крім того, поведінкова нейронаука нейропластичності може бути використана для розробки втручань, які сприяють адаптаційним змінам у мозку та покращують когнітивні функції.[101] Більше того, поведінкові втручання, такі як когнітивне навчання або фізичні вправи[101], можуть бути застосовані, щоб підвищити синаптичну пластичність і сприяти відновленню після травм та патологій нервової системи.[102][103] З’являється все більше доказів того, що регулярні фізичні вправи можуть сприяти мітохондріальному біогенезу в мозку, що може сприяти покращенню когнітивних функцій і настрою. Це призвело до зацікавленості у використанні фізичних вправ як немедикаментозного втручання для нейродегенеративних розладів та інших неврологічних станів.[104][105]
Когнітивна нейронаука
Когнітивна нейронаука вивчає як досвід і навчання формують нейронні ланцюги, та вивчає когнітивні процеси, які лежать в основі сприйняття, уваги, пам’яті, мови та інших вищих когнітивних функцій.
Однією з ключових сфер досліджень когнітивної нейронауки нейропластичності є дослідження того, як різні області та мережі мозку сприяють певним когнітивним процесам. Наприклад, використання функціональної магнітно-резонансної томографії (фМРТ) або електроенцефалографії (ЕЕГ), щоб дослідити, як зміни нейронної активності сприяють покращенню цих когнітивних функцій.[106]
Також, когнітивна нейронаука може бути використана для розробки втручань, спрямованих на певні когнітивні процеси та нейронні ланцюги для покращення когнітивних функцій і лікування неврологічних розладів. Наприклад, дослідники можуть використовувати неінвазивні методи стимуляції мозку, такі як транскраніальна магнітна стимуляція (TMS) або транскраніальна стимуляція постійним струмом (tDCS), щоб модулювати нервову активність у певних областях мозку та покращувати когнітивні функції.[107][108][109]
Системна нейронаука

Системна нейронаука нейропластичності — це область, яка вивчає організацію та функціонування нейронних ланцюгів та мереж на рівні систем, а також те, як ці системи змінюються у відповідь на досвід і навчання. Системна нейронавка передбачає вивчення того, як нейронні ланцюги та мережі працюють разом, щоб обробляти інформацію та генерувати поведінку.
Дослідники системної нейронауки нейропластичності використовують нейровізуалізацію та поведінкове тестування, щоб дослідити, як зміни нейронної активності та зв’язків в різних областях мозку пов’язані зі змінами в поведінці.[110][111] Вони також можуть використовувати такі інструменти, як оптогенетика та хемогенетика, щоб маніпулювати нейронною активністю в певних ланцюгах і досліджувати їхню роль у поведінці.[112][113][114]
Однією з ключових сфер дослідження системної нейронауки нейропластичності є вивчення сенсорної обробки та сприйняття. Дослідники досліджують, як сенсорна інформація з навколишнього середовища кодується нейронами в сенсорних областях мозку і як ця інформація інтегрується та обробляється в областях вищого рівня для створення сприйняття.[115][116][117]
Ще одним напрямом дослідження системної нейронауки нейропластичності є вивчення моторного контролю та навчання. Дослідники досліджують, як моторні команди генеруються та виконуються нейронними ланцюгами в мозку, і як ці ланцюги адаптуються та змінюються у відповідь на навчання та практику.[118][119]
Крім того, системна нейронаука нейропластичності може бути використана для дослідження того, як нервові ланцюги порушуються при неврологічних і психічних розладах. Наприклад, дослідники можуть дослідити, як зміни в зв’язках і активності нейронних ланцюгів у мозку сприяють виникненню симптомів таких розладів, як шизофренія, депресія та хвороба Альцгеймера.[2][120][121]
Загалом, системна нейронаука нейропластичності прагне зрозуміти, як зміни нейронної активності та зв’язку в різних областях мозку викликають поведінку, і як ці зміни можуть модулюватися досвідом і навчанням. Досліджуючи ці механізми, дослідники зможуть розробити нові підходи до покращення когнітивних функцій і лікування неврологічних і психічних розладів.
Міждисциплінарні науки
Нейрогенетика
Нейрогенетика нейропластичності досліджує як генетичні фактори впливають на здатність нейронних мереж зазнавати адаптивних змін у відповідь на новий досвід і навчання.
Однією з ключових сфер досліджень у нейрогенетиці нейропластичності є ідентифікація генів, які беруть участь у регуляції синаптичної пластичності та розвитку нейронів.[122][123] Наприклад, використання повногеномного дослідження асоціацій (GWAS), щоб ідентифікувати загальні генетичні варіанти, пов’язані з індивідуальними відмінностями в когнітивних здібностях, таких як пам’ять або увага.[124]
Іншим напрямком досліджень нейрогенетики нейропластичності є вивчення епігенетичних механізмів, які регулюють епігеном (див. Епігеноміка), який впливає на експресію генів у відповідь на сигнали навколишнього середовища.[125] Наприклад, як метилювання ДНК або модифікації гістонів впливають на експресію генів[126][127], залучених до синаптичної пластичності та навчання.[128][129][130][131][132][133]
Крім того, сферою досдіджень нейрогенетики нейропластичності є розробка персоналізованих втручань, спрямованих на конкретні генетичні фактори, які сприяють когнітивній дисфункції або неврологічним розладам. Наприклад, викорисання генотерапії для доставки терапевтичних генів або модуляції експресії генів у певних нейронних ланцюгах, щоб підвищити синаптичну пластичність і сприяти відновленню після травми головного мозку або захворювання.[134][135][136][137][138]
Нейроінформатика
Нейроінформатика нейропластичності передбачає використання обчислювальних та інформаційних інструментів для аналізу та моделювання складних нейробіологічних процесів, які лежать в основі нейропластичності. Ці інструменти можуть допомагають інтегрувати та аналізувати великі обсяги даних із багатьох джерел, зокрема генетики, нейровізуалізації, мультиоміки та поведінкових досліджень.
Одним із ключових напрямків нейроінформатичних досліджень, пов’язаних із нейропластичністю, є розробка обчислювальних моделей синаптичної пластичності. Ці моделі можуть допомогти дослідникам зрозуміти складну взаємодію між процесами на молекулярному, клітинному та системному рівнях, які регулюють ріст і зміцнення синапсів у відповідь на новий досвід і навчання.[139][140][141][142]
Іншим напрямком нейроінформатичних досліджень, пов’язаних з нейропластичністю, є розробка методів добування даних і машинного навчання для аналізу великомасштабних даних нейровізуалізації. Ці методи можуть допомогти дослідникам ідентифікувати моделі мозкової активності та зв’язків, які пов’язані з певними когнітивними функціями, такими як навчання та пам’ять.[144][145][146][147]
Крім того, інструменти нейроінформатики можна використовувати для інтеграції та аналізу даних з багатьох джерел для визначення біомаркерів і предикторів нейропластичності та когнітивних функцій.[148][149][150] Наприклад, дослідники можуть використовувати генетичні дані та дані нейровізуалізації, щоб ідентифікувати осіб, які, швидше за все, отримають користь від певного когнітивного втручання або програми реабілітації.[151][150]
Мультиоміка – це комплексний підхід у молекулярній нейронауці, який об’єднує дані з епігеноміки[43][44][45][46], геноміки[47][48], транскриптоміки[49][50][51], протеоміки[53][54][56][57], метаболоміки та інших -омік, щоб зрозуміти ансамбль молекулярних вхаємодій в мозку з точку зору нормальної фізіології[58][72] чи патології[59], включно з методами дослідження та впливу на механізми нейропластичності. Геномні та епігеномні дослідження підкреслюють, як генні варіації та епігеномні надстройки, спричинені навколишнім середовищем та способом життя, впливають на пластичність мозку, тоді як транскриптоміка виявляє складні моделі експресії генів. Протеомний і метаболомічний аналізи висвітлюють ключові шляхи білків і метаболіти, залучені до нейрональних змін. Інтеграція цих мультиомічних даних, та їх аналіз з допомогою машинного навчання та штучного інтелекту, може дати цінну інформацію для лікування неврологічних розладів чи посилення інтелекту.[60][61][72]
Нейрорадіологія

Нейрорадіологія — це медична дисципліна, яка використовує різні методи нейровізуалізації для візуалізації та діагностики захворювань і станів мозку та нервової системи, і відіграє важливу роль у вивченні нейропластичності.[153]
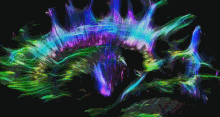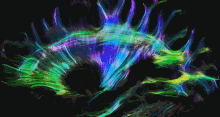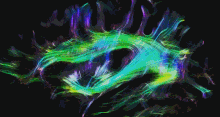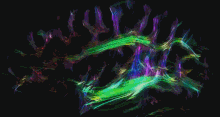
Одним із найбільш часто використовуваних методів візуалізації в нейрорадіології нейропластичності є функціональна МРТ (фМРТ) — це тип МРТ, який може виявляти зміни кровотоку в різних областях мозку, надаючи інформацію про мозкову активність.[154][155] Інші методи візуалізації, що використовуються в нейрорадіології, включають звичайну МРТ, комп’ютерну томографію (КТ), позитронно-емісійну томографію (ПЕТ) і дифузійну тензорну візуалізацію (DTI). DTI — це спеціалізований тип дифузійної МРТ, який може візуалізувати шляхи білої речовини в мозку, які є нервовими шляхами, що з’єднують різні ділянки мозку. DTI можна використовувати для вивчення змін зв’язності білої речовини, які відбуваються в результаті нейропластичності.[156][157]
Нейрорадіологія відіграє важливу роль як у діагностиці та моніторингу станів, які впливають на нейропластичність, таких як інсульт, черепно-мозкова травма та нейродегенеративні захворювання[158], так і для моніторингу ефектів втручань, спрямованих на підвищення нейропластичності, таких як когнітивне навчання або фізіотерапія.[159][160]
Нейролінгвістика
Нейролінгвістика — це галузь прикладної лінгвістики, що досліджує мозкові механізми мовленнєвої діяльності, а також зміни у процесах мовлення, що виникають при ураженнях мозку.[161] (див. також Психолінгвістика)
Дослідження показали, що вивчення мови та практика можуть призвести до змін у структурі та функціях цих областей мозку, а також до змін у зв’язку між ними. Наприклад, дослідження виявили, що вивчення другої мови може призвести до збільшення обсягу сірої речовини в мовних областях мозку, а також до змін у трактах білої речовини, які з’єднують ці області.[162]
Нейропластичність також відіграє важливу роль у відновленні від мовних розладів, таких як афазія, яка може виникнути після інсульту чи іншої травми головного мозку. Доведено, що підходи до терапії, такі як терапія афазії, викликаної примусом, і мелодійна інтонаційна терапія, викликають нейропластичні зміни в мозку, що призводить до покращення мовної функції.[163][164][165]
Нейрокібернетика та нейроінженерія
Нейрокібернетика — це наукова дисципліна, яка поєднує принципи нейронауки, кібернетики, біокібернетики та інформатики для розробки моделей і алгоритмів для розуміння та контролю поведінки нейронних систем. У контексті нейропластичності нейрокібернетику можна використовувати для вивчення того, як нейронні ланцюги мозку адаптуються та реорганізуються у відповідь на досвід і навчання. В практичній діяльності, нейрокібернетика тісно пов'язана з нейроінженерією.[167]
Нейроінженерія — це наукова дисципліна, яка поєднує нейронаучні та біомедично-інженерні методи й підходи для розуміння, відновлення, заміни, покращення або використання властивостей нейронних систем, а також для розробки рішень для проблем, пов’язаних з неврологічними обмеженнями та дисфункцією.[168]Одним із ключових напрямів досліджень у нейрокібернетиці та нейроінженерії, пов’язаних із нейропластичністю, є розробка нейронних інтерфейсів із замкнутим циклом, які використовують зворотний зв’язок від мозку в реальному часі для зміни доставки сенсорної чи моторної стимуляції. Наприклад, використання нейронних інтерфейсів замкнутого циклу для забезпечення зворотного зв’язку у осіб з обмеженими руховими можливостями під час реабілітаційних вправ, що може підвищити пластичність рухових мереж і покращити функціональні результати.[169][170][171][172]
Іншим напрямком досліджень у нейрокібернетиці та нейроінженерії, пов’язаних із нейропластичністю, є використання нейрокомп'ютерних інтерфейсів (НКІ) для сприяння нейропластичності та відновлення після травм головного мозку. НКІ дозволяє людям керувати зовнішніми пристроями, такими як протези кінцівок або комп’ютерні курсори, використовуючи нейронні сигнали, записані з мозку. Забезпечуючи мозок зворотним зв’язком щодо успіху чи невдачі цих рухів, НКІ може сприяти зростанню та зміцненню нейронних мереж, залучених до моторного контролю та навчання.[173][174][175][176][177]
Ще один напрямок досліджень — розробка замкнутих систем нейромодуляції, в яких нервова стимуляція доставляється у відповідь на зворотний зв’язок від мозку в реальному часі. Наприклад, дослідники можуть використовувати нейромодуляцію із замкнутим контуром для підвищення пластичності нейронних мереж, залучених до пам’яті та навчання, що може мати застосування для лікування когнітивних розладів, таких як хвороба Альцгеймера.[178][179]
Інженерія нервової тканини
Інженерія нервової тканини — це міждисциплінарна галузь, що поєднує в собі принципи біомедичної інженерії, нейронауки, матеріалознавства, а також клітинної та молекулярної біології. Мета інженерії нервової тканини — відновлення, підтримка та покращення функціональності нервової системи, які були втрачені через травму, хворобу чи вік, з метою сприяння нейропластичності, здатності мозку змінюватися та адаптуватися.

Органоїди головного мозку, також відомі як церебральні органоїди або міні-мозки, — це тривимірні моделі клітинної культури, отримані з плюрипотентних стовбурових клітин, які повторюють деякі аспекти функціонування та розвитку людського мозку.[180][181] Такі органоїди пропонують платформу in vitro для вивчення складних процесів, зокрема нейропластичності.
Мозок людини, що розвивається, демонструє високий ступінь пластичності, що дозволяє йому адаптувати свою структуру та функції у відповідь на подразники або пошкодження. Органоїди мозку були використані як моделі для спостереження цих явищ у контрольованих лабораторних умовах. Вони пропонують унікальну можливість дослідити складну взаємодію між генетикою, навколишнім середовищем і нейропластичністю.
Однією з переваг органоїдів мозку для дослідження нейропластичності є можливість генетично модифікувати їх (див. також Редагування генома, Генотерапія, Генетична інженерія) або вводити різні біохімічні чи фізичні стимули, а потім оцінити, як ці зміни впливають на структуру та функцію органоїду.[182][183] Ця здатність маніпулювати «міні-мозком» і спостерігати за результатами змін у нейронних зв’язках і поведінці може дати цінну інформацію про механізми, що лежать в основі нейропластичності.[184]
Дослідження з використанням органоїдів мозку також показали потенціал для розуміння відновлення нейронних зв’язків після травми. Механізми відновлення та пластичності органоїдів головного мозку після травми та фактори, які можуть сприяти або перешкоджати цьому процесу, можуть надати важливу інформацію для терапевтичних підходів до покращення відновлення після пошкодження мозку.[185][186] (див. також Нейрореабілітація, Медична реабілітація) Наприклад, дослідження на мишах, опубліковане в травні 2023 року в npj Regenerative Medicine, що досліджувало використання мозкових органоїдів для відновлення функціональної нервової тканини в місці ураження після ішемічного інсульту, показало[187]:
"...Через кілька місяців ми виявили, що трансплантовані органоїди добре вижили в ураженому інфарктом ядрі, диференціювалися в цільові нейрони, відновлювали інфарктну тканину, посилали аксони до віддалених мішеней мозку та інтегрувалися в нейронний ланцюг господаря, тим самим усуваючи сенсомоторні дефекти поведінки мишей, які перенесли інсульт..."

Крім того, органоїди головного мозку можна використовувати для моделювання розладів нервової системи та нейродегенеративних розладів[189][190][191][192], дозволяючи дослідникам досліджувати, як ці стани впливають на нейропластичність і як сприяння нейропластичності може допомогти пом’якшити ці розлади та сприяти дослідженню нових ліків[193][194], персоналізованому лікуванню[195] та омолодженню мозку[196][197]. Розвиток нейроінженерних нанотехнологій (наноматеріали, наносенсори, біомолекулярна електроніка) може сприяти успіхам в дослідженнях на церебральних органоїдах.[198][199]
На органоїдах можку також досліджується, так званий, оргіноїдний інтелект (ОІ) — нейронні мережі з справжніх живих нейронів органоїдів. Біобчислювальні системи на основі OI мають потенціал для швидшого прийняття рішень, безперервного навчання під час виконання завдань і більшої ефективності використання енергії та даних, ніж обчислення на основі кремнію та штучного інтелекту. Розвиток OI може покращити наше розуміння нейропластичності, розвитку мозку, навчання, пам’яті та потенційно допоможе знайти лікування неврологічних розладів, таких як деменція. OI включає збільшення органоїдів мозку в складні, міцні 3D-структури, збагачені клітинами та генами, пов’язаними з навчанням, підключення їх до пристроїв введення та виведення наступного покоління та систем ШІ/машинного навчання. Для цього потрібні нові моделі, алгоритми та технології інтерфейсу, щоб спілкуватися з органоїдами мозку, розуміти, як вони навчаються та обчислюють, а також збирати, обробляти та зберігати великі обсяги даних, які вони генерують.[188][200]
Дивись також
Література
Книги
- Пластичність мозку. Приголомшливі факти про те, як думки здатні змінювати структуру та функції нашого мозку / Норман Дойдж. — ISBN 978-611-01-2009-8.
- Самовідновлення мозку / Норман Дойдж — Київ : Наш формат, 2020. — ISBN 978-617-7866-03-8 (папер. вид.). — ISBN 978-617-7866-04-5 (електрон. вид.).
- Dynamic Brains and the Changing Rules of Neuroplasticity: Implications for Learning and Recovery / P. Voss, M. E. Thomas, J. M. Cisneros-Franco, É. de Villers-Sidani. — 2017.
- Advances in CNS Repair, Regeneration, and Neuroplasticity: From Basic Mechanisms to Therapeutic Strategies] / ed. by Shuxin Li, Junfang Wu, Andrea Tedeschi. — Lausanne : Frontiers Media SA, 2022. — 399 p. — ISBN 978-2-88974-633-0. — ISSN 1664-8714. — DOI 10.3389/978-2-88974-633-0.
Журнали
Посилання
- Neuroplasticity / Arrowsmith School. — Дата звернення: 24.02.2020.
- What is Neuroplasticity? : [відео] / Dr Michael Merzenich. — 2021.