Епігеноміка
Епігенóміка — це розділ епігенетики, що зосереджується на глобальному аналізі епігенома — епігенетичних модифікацій всього генома. Епігеноміка прагне дати повну картину молекулярних подій, які змінюють функціонування клітинної лінії, певної тканини або цілого організму поза генетичним рівнем — на рівні епігенома.[1][2][3][4] Епігеном впливає на експресію генів і клітинну функцію, «вмикаючи» чи «вимикаючи» певні гени, що впливає на більшість біологічних процесів, таких як розвиток, старіння й омолодження, формування пам’яті, навчання, розвиток хвороб й одужання від них тощо.[5][6][7]
У той час як геноміка відноситься до вивчення структури, функціонування, картографування та редагування геномів, епігеноміка зосереджується на розумінні загальних епігенетичних модифікацій, які відбуваються в геномі. Геномні послідовності залишаються незмінними протягом життя організму, тоді як епігеном може змінюватися в результаті факторів навколишнього середовища та способу життя.[8]
Дослідження епігеноміки має глибокі наслідки в багатьох галузях біології, включаючи біологію розвитку, фізіологію, нейронауку та патологію захворювань, зокрема онкопатологій, автоімунних, неврологічних та серцево-судинних захворювань. Епігеноміка допомагає пояснити механізми, що стоять за різноманітними захворюваннями людини, і дає нове розуміння стратегій лікування за межами традиційних генетичних підходів.[9][10]
Вивчаючи епігеноміку, дослідники можуть краще зрозуміти, як фактори навколишнього середовища та спосіб життя впливають на експресію генів, і потенційно розробити втручання для зміни цих епігенетичних модифікацій. Оскільки розуміння цих процесів зростає, стає все більш очевидним, що галузь епігеноміки відіграватиме вирішальну роль у майбутніх терапевтичних стратегіях та персоналізованій медицині, особливо з розвитком технологій епігенетичного перепрограмування та редагування епігенома[en].[11][12]
Історія

Історія епігеноміки сягає корінням у відкриття метилювання ДНК і модифікацій гістонів.
Дослідження метилювання ДНК
Про метилювання ДНК вперше було повідомлено в 1940-х і 50-х роках Ролліном Хочкіссом[en] при дослідженні ДНК Escherichia coli.[13][14]
Піонерські дослідження Холлідея[en] та П’ю (1975) заклали основу для розуміння моделей метилювання ДНК та їх ролі в регуляції активності генів.[15] Дослідження Берда (2002)[16] і Єніша[en] та Берда (2003)[17], що з’ясовували вплив метилювання ДНК на мовчання генів, продемонстрували його значення в контролі транскрипції.
Відкриття модифікації гістонів
Ацетилювання гістонів було відкрито в 1960-х роках Вінсентом Алфрі та його колегами як форму модифікації гістонів, яка може регулювати транскрипцію.[18][19]
Фундаментальне дослідження Алліса[en] та ін. у 2007 році окреслило вплив модифікацій гістонів на структуру хроматину та регуляцію генів, підкресливши динамічну взаємодію між модифікаціями гістонів і транскрипційною активністю.[20]
Дослідження некодуючих РНК
Дослідження Лі та ін. (1993)[21] і Фаєра та ін. (1998)[22] розкрили ключову роль некодуючих РНК в епігенетичній регуляції, розширюючи розуміння їхньої участі в модуляції експресії генів.
Проект епігенома людини (HEP)
Започаткований у 2003 році Проєкт Епігенома Людини[en] (Human Epigenome Project) мав на меті скласти карту та зрозуміти епігенетичний ландшафт геному людини, за аналогією Проєкту геному людини. Ініціативи HEP, у тому числі проект «Дорожня карта епігеноміки», створили комплексні епігенетичні карти для різних типів клітин і тканин.
Розвиток епігеномних технологій
Розвиток високопродуктивних методів секвенування в кінці 2000-х, зробив революцію в епігеномних дослідженнях.[23][24] Ці технології уможливили повногеномний аналіз метилювання ДНК і модифікацій гістонів, значно просунувши сферу епігеноміки.
Молекулярні основи
Тіло людини містить, за деякими оцінками, 400 основних типів клітин[en][25] — але всі ці типи мають однакову послідовність ДНК — їх відрізняють зміни в епігеномі.
Метилювання ДНК

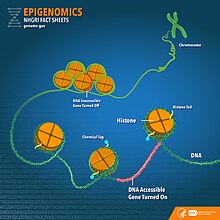
Метилювання ДНК — це біохімічний процес, який включає додавання метильної групи до молекули ДНК, як правило, до цитозину або аденіну. Метилювання ДНК може змінити активність сегмента ДНК без зміни його послідовності. Коли метилювання ДНК відбувається в промоторі гена, це, зазвичай, пригнічує транскрипцію гена, фактично «вимикаючи» ген.[26][27]
Модифікація гістонів
Гістони — це білки, навколо яких накручується ДНК, що дозволяє їй поміститися в ядрі клітини. Гістони можуть бути хімічно модифіковані додаванням або видаленням різних типів функціональних груп, включаючи ацетильні, метильні та фосфатні групи. Ці модифікації можуть впливати на експресію генів, роблячи ДНК більш або менш доступною для механізму транскрипції.[28][29]
Ремоделювання хроматину
Ремоделювання хроматину — це процес, який передбачає динамічну модифікацію архітектури хроматину, щоб забезпечити доступ конденсованої геномної ДНК до білків регуляторної транскрипції, і таким чином контролювати експресію генів. На зміни в структурі хроматину впливає хімічна модифікація білків гістонів і метилювання ДНК.[30]
Некодуючі РНК та їх роль
Некодуючі РНК (нкРНК) — це функціональні молекули РНК, які транскрибуються з ДНК, але не транслюються в білки. Найвідомішими прикладами нкРНК є транспортні РНК (тРНК) і рибосомні РНК (рРНК), але останнім часом було виявлено, що інші нкРНК, такі як мікроРНК, довгі некодуючі РНК і кільцеві РНК, які також відіграють важливу роль у регуляції генів, включаючи епігенетичну регуляцію. Вони залучені до різноманітних біологічних процесів, включаючи імпринтинг, дозову компенсацію та модуляцію структури хроматину.[31]
Методи та інструменти
Секвенування імунопреципітацією хроматину (ChIP)
Секвенування ChIP (ChIP-seq) — це метод, який використовується для аналізу взаємодії білка з ДНК. Він поєднує в собі імунопреципітацію хроматину (ChIP) із масивним паралельним секвенуванням ДНК для ідентифікації сайтів зв’язування ДНК-асоційованих білків. Його можливо використовувати для точного відображення глобальних сайтів зв’язування для будь-якого цікавлячого білка. Цей метод широко використовується в епігеноміці для ідентифікації місць модифікацій гістонів.[32]
Бісульфітне секвенування
Бісульфітне секвенування[en] — це техніка, яка використовується для визначення патерну метилювання ДНК. Бісульфіт натрію (Натрій гідросульфіт) перетворює неметильовані цитозини в урацил, тоді як метильовані цитозини протистоять перетворенню. Подальша ПЛР і секвенування дозволяють ідентифікувати неперетворені (метильовані) залишки і таким чином надати детальну карту метилювання ДНК.[33][34]
Бісульфітне повногеномне секвенування
Бісульфітне повногеномне секвенування[en] (Whole-genome bisulfite sequencing, WGBS) — це метод бісульфітного секвенування, який може створити повну та неупереджену картину статусу метилювання в усьому геному. Це дозволяє дослідникам вивчати метилювання ДНК з роздільною здатністю однієї основи та вважається золотим стандартом для вивчення метилювання ДНК у всьому геному.[35][36][37][38]
Бісульфітне секвенування зі зниженим представленням
Бісульфітне секвенування зі зниженим представленням[en] (Reduced Representation Bisulfite Sequencing, RRBS) — це техніка, яка дозволяє ефективно секвенувати сайти метилювання в геномі. Він використовує рестриктази для розрізання ДНК у певних місцях, збагачуючи ділянки з високим вмістом CpG. Обробка бісульфітом і секвенування дозволяють виявити метилювання ДНК.[39][40]
Імунопреципітаційне секвенування метильованої ДНК (MeDIP-Seq)
MeDIP-Seq — це метод, який використовується для збагачення метильованих послідовностей ДНК. Методика використовує антитіло проти 5-метилцитозину для імунопреципітації метильованої ДНК. Потім осаджену ДНК секвенують, забезпечуючи повногеномний профіль метилювання ДНК.[41][42][43]
Аналіз хроматину, доступного для транспозази (ATAC-seq)
ATAC-seq[en] — це техніка, яка використовується для вивчення доступності хроматину. Він використовує гіперактивну транспозазу Tn5 для вставки адаптерів секвенування в доступні ділянки хроматину. Області вставки потім можна секвенувати, забезпечуючи карту доступності хроматину, яку можна використовувати для визначення розташування потенційних регуляторних областей.[44][45][46]
Високопродуктивні методи, біоінформатика та мультиоміка
Високопродуктивні методи, такі як секвенування наступного покоління (секвенування Illumina[en], піросеквенування та іонне напівпровідникове секвенування)[47] та мікроматриці, разом із передовими інструментами біоінформатики значно просунули сферу епігеноміки, дозволивши проводити епігенетичні дослідження в масштабах генома та інтегрувати епігеномні дані з іншими типами -омічних даних, щоб отримати більше повне розуміння геномної функції (див. Мультиоміка).[48][49][50]
Епігеноміка та здоров'я людини
Епігеноміка та захворювання
Епігеномні зміни пов’язані з різними захворюваннями, особливо онкопатології.[51][52][53][54][55] Інші захворювання, такі як неврологічні розлади[56][57][58][59][60], аутоімунні захворювання[61][62][63][64] та серцево-судинні захворювання[65][66][67][68][69], також мають значні епігенетичні компоненти. Нещодавні досягнення в розумінні епігенома дають нові знання про механізми, що лежать в основі цих захворювань, і можуть призвести до розробки нових терапевтичних стратегій.
Онкопатології
Було показано, що зміни в епігеномі відіграють ключову роль у виникненні та прогресуванні різних типів раку.[70] Ці зміни можуть включати шаблони метилювання ДНК, модифікації гістонів і зміни в некодуючих РНК, усі вони можуть істотно змінити шаблони експресії генів у ракових клітинах.[51][52][53][54][55]
Неврологічні розлади
Епігенетичні зміни також пов’язані з низкою неврологічних[56][57][58][59][60] і психіатричних[71][72][73][74][75] розладів, включаючи хворобу Альцгеймера[76][77][78], шизофренію[72][79][80][81] та аутизм[82][83][84][85][86]. Ці зміни можуть впливати на експресію генів у мозку, потенційно сприяючи патології захворювання.
Аутоімунні захворювання
Аутоімунні захворювання, такі як вовчак[87][88][89], ревматоїдний артрит[90][91][92] і розсіяний склероз[93][94][95], також були пов’язані зі змінами в епігеномі. Ці зміни можуть вплинути на імунну функцію та сприяти неадекватній імунній відповіді, яка спостерігається при цих захворюваннях.[61][62][63][64]
Cерцево-судинні захворювання
Епігенетичні зміни все частіше визнаються ключовими факторами розвитку та прогресування багатьох серцево-судинних захворювань[65][66][67][68][69], включаючи артеріальну гіпертензію[96][97][98][99][100], атеросклероз[101][102][103][104], серцеву недостатність[105][106] та інші. Епігенетичні зміни можуть змінювати експресію генів, які беруть участь у регуляції артеріального тиску, метаболізмі холестерину та запальній реакції, серед іншого. Це зростаюче розуміння відкриває нові можливості для профілактики, діагностики та лікування цих захворювань.
Метаболічні захворювання
Епігеномні зміни пов’язують із метаболічними захворюваннями, такими як ожиріння[107] та діабет 2 типу[108][109][110]. Епігенетичні маркери можуть впливати на чутливість до інсуліну й інсулінорезистентність[111], адипогенез[112] та енергетичний гомеостаз[113], і потенційно можуть бути цільовими для стратегій лікування[114].
Офтальмологічні захворювання
Епігенетичні зміни пов’язані з багатьма офтальмологічними захворюваннями[115], включаючи вікову макулярну дегенерацію[116][117], глаукому[118], діабетичну ретинопатію[119] та катаракту[115][120]. Ці зміни в першу чергу включають метилювання ДНК і модифікацію гістонів, забезпечуючи потенційні мішені для терапевтичних втручань. Таким чином, розуміння цих епігенетичних змін може революціонізувати лікування захворювань і стратегії лікування, даючи нову надію на запобігання втраті зору.[121]
Вікові захворювання
Старіння пов’язане з рядом епігенетичних змін (див. Механізми старіння). Таким чином, епігеномні втручання можуть відігравати важливу роль як у лікуванні захворювань, пов’язаних із віком, включаючи певні форми деменції та остеоартрозу, так і в омолоджені per se.[122][123][124]
Епігеномна терапія
Епігенетичні ліки
Поле епігеноміки забезпечило новий набір цілей для терапевтичного втручання. Це призвело до розробки низки «епігенетичних ліків», спрямованих на скасування патологічних епігенетичних змін. До них належать препарати, які інгібують ДНК-метилтрансферази або гістондеацетилази, які є ферментами, які додають метильні або ацетильні групи до ДНК або гістонів відповідно.[125][126][127][128][129][130][131]
Нутрігеноміка
Водночас галузь нутрігеноміки, яка досліджує взаємодію між поживними речовинами та геномом[132], визначила способи, за допомогою яких дієта може впливати на епігеном. Поживні речовини можуть впливати на моделі метилювання та модифікації гістонів, тим самим впливаючи на експресію генів. Інтеграція нутрігеноміки з підходами до персоналізованої медицини може призвести до індивідуальних дієтичних рекомендацій для профілактики та лікування захворювань.[133][134][135]
Епігенетичне перепрограмуванння

Епігенетичне перепрограмування означає стирання та ремоделювання епігенетичних позначок в молекулах ДНК, таких як метилювання ДНК. Таке ремоделювання змінює активність певних генів, на рівні епігенома.
Феномен клітинного перепрограмування викликав зміну парадигм в галузі молекулярної біології, що має далекосяжні наслідки для регенеративної медицини, моделювання захворювань і розуміння біології розвитку. Завдяки епігенетичному перепрграмуванню можливо утворювати індуковані плюрипотентні стовбурові клітини з, майже, будь-яких диференційованих соматичних клітин.[137] За це відкриття Джон Гердон, який у 1962 році продемонстрував, що диференційовані соматичні клітини можуть бути перепрограмовані назад у ембріональний стан, та Сін'я Яманака, який з командою відкрили та описали методику перетворення соматичних клітин в стовуброві, отримали Нобелівську премію з медицини 2012 року.[136]
Епігеноміка та еволюція
Епігенетичне успадкування
Епігенетичні модифікації іноді можуть успадковуватися поколіннями у феномені, відомому як «епігенетичне успадкування[en]».[138] Цей процес, який передбачає передачу інформації від батьків до нащадків, яка не закодована в самій послідовності ДНК, додає ще один рівень складності до нашого розуміння еволюції та природного відбору. Це відкриває розуміння того, що фактори навколишнього середовища, яких зазнає одне покоління, можуть впливати на риси наступних поколінь.[139][140][141]
Епігеноміка та видоутворення
Епігеномні зміни також можуть сприяти процесу видоутворення — утворенню нових і відмінних видів у ході еволюції. Епігенетичні варіації, впливаючи на моделі експресії генів, можуть сприяти фенотипічному різноманіттю, яке спричиняє дивергенцію видів.[142][143]
Епігеноміка та адаптація
Епігеномні модифікації можуть допомогти організмам швидко адаптуватися до змін середовища. На відміну від генетичних мутацій, епігенетичні зміни можуть відбуватися швидко у відповідь на подразники навколишнього середовища, дозволяючи організмам коригувати моделі експресії генів і, отже, свої фенотипи протягом життя.[144]
Епігеноміка та еволюційна теорія
Наслідки епігеноміки для еволюції є глибокими, що потенційно вимагає переосмислення традиційної еволюційної теорії. Це передбачає інтеграцію концепції «епігенотипу» в наше розуміння еволюційних процесів поряд із традиційним фокусом на генотипі.[145][146]
Епігеноміка в біології розвитку

Тіло людини містить, за деякими оцінками, 400 основних типів клітин[en] у 60 підтипах тканин[147] — але кожен тип клітин має однакову молекулу ДНК — їх відрізняють саме зміни в епігеномі.
Епігенетична регуляція ембріонального розвитку
Епігенетичні модифікації мають вирішальне значення для контролю експресії генів під час ембріогенезу, впливаючи на такі процеси, як клітинна диференціація та органогенез. Ці зміни, які включають метилювання ДНК, модифікації гістонів і механізми на основі РНК, забезпечують правильну просторово-часову експресію генів, уможливлюючи розвиток складних багатоклітинних організмів із однієї заплідненої яйцеклітини.[148][149]
Епігеноміка та клітинна диференціація
На клітинну диференціацію, процес, за допомогою якого клітина змінює один тип на інший, сильно впливають модифікації епігенома. Епігенетичні модифікації можуть «заблокувати» профілі експресії генів диференційованих клітин, гарантуючи, що клітина шкіри, наприклад, продовжує поводитися як клітина шкіри, навіть коли вона ділиться і її нащадки розмножуються.[150]
Епігенетичне перезавантаження в розвитку ссавців
Унікальною особливістю розвитку ссавців є «епігенетичне перезавантаження», яке відбувається незабаром після запліднення та під час формування статевих клітин. Це передбачає стирання та подальше відновлення епігенетичних позначок, процес, який є критично важливим для підтримки цілісності генома через покоління.[151][152]
Роль некодуючих РНК у розвитку
Було виявлено, що некодуючі РНК, включаючи мікроРНК і довгі некодуючі РНК, відіграють вирішальну роль у процесах розвитку. Вони можуть модулювати експресію генів на різних рівнях, впливаючи на структуру хроматину, транскрипцію та трансляцію, і тим самим формуючи результати розвитку.[153]
Перспективні напрямки та технології
Епігеномна терапія
Епігенетичні зміни лежать в основі багатьох захворювань, що створює можливості для терапевтичного втручання. Майбутні перспективи включають розробку ліків, які можуть модулювати епігеном, відомих як «епі-ліки» (з англ. «epi-drugs») з метою повернення специфічних для захворювання епігенетичних змін і відновлення нормальної функції гена.[125]
Персоналізована медицина
Персоналізована медицина, адаптована до унікальних генетичних та епігенетичних особливостей людини, має значні перспективи. Майбутні досягнення можуть включати розробку персоналізованих епігенетичних профілів, які можуть прогнозувати ризик захворювання, інформувати про вибір лікування та контролювати прогресування захворювання або відповідь на лікування.[11][12][154][155]
Редагування епігенома
Для точного редагування епігенома[en] з’являються нові методи, такі як методи на основі CRISPR (див. також Редагування генома). Ці інструменти потенційно можуть бути використані для спеціальної зміни епігенетичних позначок у точних місцях генома, забезпечуючи нові ефективні підходи для фундаментальних досліджень і терапевтичних застосувань.[156][157][158][159]
Епігенетичне перепрограмування
Епігенетичне перепрограмуваня відкриває значні перспективи для регенеративної медицини, моделювання захворювань і розуміння біології розвитку. Завдяки епігенетичному перепрграмуванню можливо утворювати індуковані плюрипотентні стовбурові клітини з, майже, будь-яких диференційованих соматичних клітин.[137]
Штучний інтелект в епігеноміці
Застосування штучного інтелекту та машинного навчання для вивчення епігенома може дати розуміння складних закономірностей і передбачити потенційні епігенетичні зміни, потенційно призводячи до раннього виявлення захворювань і більш ефективного лікування.[160][161][162][163][154][155]
Інтегративні епігеномні дослідження
Майбутні дослідження, ймовірно, будуть зосереджені на інтегративних епігеномних дослідженнях, поєднуючи кілька рівнів епігенетичної інформації, такої як метилювання ДНК, модифікації гістонів і некодуючі РНК, щоб забезпечити більш повне розуміння складної епігенетичної регуляції експресії генів. Цей комплексний підхід дозволить дослідникам виявити взаємодію та залежності між різними типами епігенетичних модифікацій, забезпечуючи більш цілісне уявлення про епігеном.[164][165][166][167]
Мультиоміка
Зростаюче усвідомлення того, що складні захворювання неможливо зрозуміти, дивлячись на окремі шари біологічної інформації, підштовхнуло наукову спільноту до інтеграції всіх даних -омік (епігеноміка, геноміка, транскриптоміка, протеоміка, метаболоміка та інші) в комплексне інтегративне дослідження — мультиоміку. Інтегруючи різні типи даних омік, вчені можуть отримати більш цілісне розуміння механізмів захворювання, ідентифікувати нові біомаркери захворювання та розробити більш ефективні терапевтичні стратегії. Зокрема, інтеграція епігеномних даних з іншими даними омік може допомогти з’ясувати складні регуляторні мережі, які лежать в основі здоров’я та хвороб.[168][169][170]
Крім того, мультиомічні підходи можуть допомогти пролити світло на складну взаємодію між геномом, епігеномом і факторами навколишнього середовища, що веде до кращого розуміння того, як ці взаємодії сприяють сприйнятливості та прогресуванню захворювання.[170]
Одноклітинна епігеноміка
Технології, що дозволяють розпізнавати епігеномні (та інші -омічні) особливості в одній клітині[en], швидко розвиваються.[171][172] Це забезпечить безпрецедентне розуміння гетерогенності епігенетичних модифікацій у тканинах, висвітлюючи епігенетичну динаміку в окремих клітинах під час розвитку, прогресування захворювання та у відповідь на подразники навколишнього середовища.[173][174][175][176][177]
Епігеноміка навколишнього середовища
Зростає інтерес до вивчення епігеноміки навколишнього середовища, зосереджуючись на тому, як фактори навколишнього середовища та способу життя, такі як харчування (див. Нутрігеноміка), стрес і токсини, можуть викликати епігенетичні зміни, що впливають на здоров’я та захворювання. Розуміння впливу навколишнього середовища на епігеном може призвести до втручань, які змінюють ці впливи для зміцнення здоров’я та запобігання захворюванням.[178][179][180][181]
Епігеноміка старіння, омолодження та довголіття
Роль епігенетичних змін у старінні, розвитку вікових захворювань, омолоджені й довголітті є новою областю досліджень. У міру кращого розуміння того, як епігеном змінюється з часом і його впливу на старіння, можуть з’явитися можливості для розробки втручань, які уповільнюють процес старіння або знижують ризик вікових захворювань.[182][123][124]
Див. також
Додаткова література
Книги
- Hatada Izuh; Horii Takuro (2023). Epigenomics: methods and protocols. Methods in molecular biology. New York, NY: Humana Press; Springer. ISBN 978-1-0716-2723-5.
- Yujing Li та ін. (2023). Epigenomic and Epitranscriptomic Basis of Development and Human Disease (відкритий доступ: pdf, epub). Frontiers in Cell and Developmental Biology. ISBN 978-2-83251-817-5.
- Appasani Krishnarao (2012). Epigenomics, from chromatin biology to therapeutics. Cambridge (GB): Cambridge University Press. ISBN 978-1-107-00382-8.
Журнали
Статті
- Wang Kevin C.; Chang Howard Y. (2018). Epigenomics: Technologies and Applications. Circulation Research (англ.) 122 (9). doi:10.1161/CIRCRESAHA.118.310998.
- Feinberg Andrew P. (2018). The Key Role of Epigenetics in Human Disease Prevention and Mitigation. New England Journal of Medicine (англ.) 378 (14). doi:10.1056/NEJMra1402513.