Персоналізована медицина
Персоналізована медицина, медицина рівня P3 (син. прецизійна, прицільна, індивідуалізована, персоніфікована) — це медична модель, що полягає на виборі медичних рішень та практик на основі прогнозованої реакції конкретного пацієнта та ризику розвитку у нього захворювання, на відміну від активної моделі «один препарат, який підходить усім».[1]
Хоча концепція персоналізованого підбору лікування бере свій початок ще за часів Гіппократа[2], популярності вона набула лише в останніх роках завдяки новим технологіям. Для виявлення хвороб та вибору оптимальної терапії прицільна медицина використовує діагностичні тестування генетичної, молекулярної і клітинної інформації.[3] Геноміка сприяє створенню доказової бази для стратифікації (групування) подібних між собою пацієнтів.[4][5][6]
Термінологія
Терміни персоналізована, персоніфікована, прецизійна, прицільна та індивідуалізована медицина часто використовуються як синоніми, хоча між цими поняттями існують певні розбіжності.[7] Так, наприклад, прицільна медицина – це модель системи охорони здоров’я, в якій медичні заключення та види лікування адаптовані під окремі групи пацієнтів, залежно від схильності до певного захворювання, особливостях перебігу і ефективності лікування. Такий підхід дозволить фокусувати профілактичні та лікувальні заходи на тих пацієнтах, кому вони будуть корисні, заощаджуючи витрати та зменшуючи небажані наслідки для решти осіб. В той же час, «прицільна медицина» також займається створенням медичних продуктів для конкретних осіб, наприклад, «...індивідуально створені чи підібрані тканини та органи для лікування кожного окремого пацієнта».[8] Тому в широкій практиці поняття прицільної і персоналізованої медицини вважаються синонімами.[9]
Переваги
Прицільна медицина допомагає краще розуміти навколишнє середовище, спосіб життя та спадковість. Ця інформація дозволяє точніше передбачити, які методи лікування будуть найбільш ефективними та безпечними, а, можливо, і запобігти початку хвороби. Інші переваги полягають на:
- зміщенні акценту в медицині з лікування на профілактику
- ранній діагностиці захворювань
- точнішому виборі ліків та їх дозування
- передбаченню та уникненню побічних наслідків
- зменшенню часу, вартості і рівня невдач фармацевтичних клінічних випробувань
Практика
Можливість прицільного лікування в звичайних клінічних умовах залежить від доступності тестів молекулярного профілювання (наприклад генотипування ДНК зародкової лінії).[10] У дослідницькому середовищі вивчаються різні аспекти прицільйної медицини (наприклад, протеом, мікробіом), але в рутинній практиці використовуються не всі. Здатність втілювати в життя висновки досліжень залежить від наявних баз знань, які допомагають клініцистам інтерпретувати отримані результати для модифікації лікування.[11][12][13] Ранні дослідження із застосуванням прицільної медицини на основі оміків для когорт осіб із недіагностованим захворюванням показали частоту діагностики ~35% із ~1 із 5 нових діагностованих пацієнтів, які отримували рекомендації щодо зміни терапії.[14]
Діагностика та лікування
Генотипування — це процес отримання послідовності ДНК.[15] Послідовність ДНК кожної людини можна буде порівняти з еталонним геномом, таким як « Проект геному людини», щоб оцінити існуючі генетичні варіації, які можуть призвести до різних захворювань. Низка приватних компаній, таких як 23andMe, Navigenics і Illumina, створили загальнодоступне секвенування геному Direct-to-Consumer.[16]
Іншим важливим аспектем є фармакогеноміка, яка використовує геном людини для кращого підбору ліків.[17] Детальний облік генетичної інформації людини допоможе запобігти побічним наслідкам, дозволить підібрати відповідні дози та досягти максимальної ефективності при призначенні ліків.[16] Візьмемо для прикладу варфарин (пероральний антикоагулянт). Через значну індивідуальну варіабельність фармакокінетики та фармакодинаміки варфарину, частота його побічних реакцій є однією з найвищих серед усіх препаратів.[18] Однак, завдяки відкриттю поліморфних варіантів у генотипах CYP2C9 і VKORC1 (гени, які кодують індивідуальну антикоагулянтну реакцію),[19][20] лікарі можуть використати генний профіль пацієнтів для призначення відповідних доз варфарину, які забезпечать оптимальну терапевтичну ефективність та допоможуть уникнути побічніх реакцій.[18]
Персоналізована медицина сприяє прогресу профілактичної допомоги. Наприклад, вже зараз багатьом жінкам, з обтяженою спадковістю відносно раку молочних залоз чи яєчників, рекомендують тестування для виявлення мутації в генах BRCA1 і BRCA2.[21] Чим більше причин захворювань нанесено на карту генних мутацій, тим простіше їх ідентифікувати серед населення, і вжити заходів, щоб запобігти розвитку захворювання.
Тераностика
Тераностика — це персоналізований підхід до лікування раку. Слово «тераностика» походить від поєднання слів «терапія» і «діагностика». Одним із перших прикладів є використання радіоактивного йоду для лікування хворих на рак щитоподібної залози. Інші приклади включають радіоактивно мічені анти-CD20 антитіла (наприклад, Bexxar) для лікування лімфоми, Radium-223 для лікування метастазів у кістки, Lutetium-177 DOTATATE для лікування нейроендокринних пухлин і Lutetium-177 PSMA для лікування раку простати. Найбільш часто використовуваним реагентом є фтордезоксиглюкоза з використанням ізотопу фтор-18.[22]
Мультиоміка

Персоналізована медицина являє собою зміну парадигми від універсального підходу до більш орієнтованої на пацієнта методології. Вона зосереджений на визначенні підходів, які будуть ефективними для пацієнтів на основі генетичних факторів, чинників навколишнього середовища та способу життя. Поява технологій "омік" значно розширила можливості персоналізованої медицини.[23]
Мультиоміка трансформує персоналізовану медицину, надаючи цілісне уявлення про стан здоров’я пацієнта на молекулярному рівні.[24] Інтеграція геноміки, епігеноміки, транскриптоміки, епітранскриптоміки, протеоміки, метаболоміки та інших даних оміксних технологій дозволяє точніше діагностувати, прогнозувати та лікувати захворювання.[25] Надзвичайно великі, швидко зростаючі колекції даних оміксних технологій та клінічних даних створюють виклики та можливості для їх аналізу та інтерпретації та відкривають нові обчислювальні шлюзи для вирішення цих проблем. Розробка нових надійних алгоритмів, які найбільше підходять для належного аналізу цих великих даних, уможливила прогрес персоналізованої медицини.[26]
Дані мультиоміки можуть покращити діагностику та прогноз захворювання шляхом визначення біомаркерів та підтипів захворювання. Це може призвести до раннього виявлення та втручання, покращуючи результати пацієнтів. Крім того, мультиоміка може допомогти виявити пацієнтів із високим ризиком розвитку певних захворювань, уможливлюючи профілактичні заходи.[27]
Розуміючи унікальний молекулярний профіль пацієнта, медичні працівники можуть пристосувати лікування до конкретної людини. Мультиомічний аналіз може надавати інформацію про потенційні мішені ліків[28][29][30], прогнозувати реакцію на ліки[31][32] та контролювати прогрес лікування. Це може підвищити ефективність терапії та мінімізувати побічні ефекти.[33][23]
Незважаючи на перспективу мультиоміки в прецизійній медицині, залишається кілька проблем. До них належать питання, пов’язані з інтеграцією даних та їх інтерпретацією.[33][34][35][36]
Геноміка

Геном кожної людини унікальний.[16] Здоров’я напряму залежить від генетичних варіацій, способу життя та впливу навколишнього середовища.[37][38] Індивідуальні відмінності молекулярної патології та експосому впливають на перебіг хвороби шляхом інтерактому у тканинному мікросередовищі. В якості теоретичної основи прицільної медицини лежить «принцип унікальної хвороби»[39], який вперше був використаний для опису неопластичних захворювань як «принцип унікальної пухлини».[40]
Щоб дізнатися чи певна геномна мутація пов’язана з конкретною хворобою, дослідники проводять «дослідження загальногеномних асоціацій» (GWAS). Ціль дослідження — знайти ідентичні мутації серед групи хворих з однаковою патологією. Виявлені таким чином мутації, пов’язані із певним захворюванням, можна використовувати для майбутньої діагностики пацієнтів. Перше GWAS, проведене в 2005 році, вивчало пацієнтів з віковою дегенерацією жовтої плями (ARMD).[41] Воно виявило дві різні мутації, кожна з яких містить варіацію лише в одному нуклеотиді (так звані однонуклеотидні поліморфізми або SNP). Станом на початок 2014 року було проведено понад 1300 досліджень GWAS.[42]
Геноміка раку

Протягом останніх десятиліть дослідження раку допомогли вивчити генетичну різноманітність типів раку, які проявляються однаково в традиційній патології. Зростає усвідомлення гетерогенності пухлини або генетичної різноманітності в одній пухлині.
«Персоналізована онкогеноміка» — це застосування персоналізованої медицини до геноміки раку. Онкогеноміка є однією з найперспективніших галузей геноміки, особливо через її значення для медикаментозної терапії. Приклади цього:
- Трастузумаб (торговельні назви Herclon, Herceptin) — препарат із моноклональними антитілами, який впливає на рецептор HER2/neu . Його основне використання - лікування деяких видів раку молочної залози. Цей препарат використовується лише в тому випадку, якщо рак пацієнта тестується на надмірну експресію рецептора HER2/neu. Два тести на типування тканин використовуються для перевірки пацієнтів на можливу користь від лікування Герцептином. Тканинні тести включають імуногістохімію (IHC) і флуоресцентну гібридизацію in situ (FISH)[43]. Лише пацієнти з Her2+ отримуватимуть терапію Герцептином (трастузумаб).[44]
- Інгібітори тирозинкінази, такі як іматиніб (продається як Gleevec), були розроблені для лікування хронічного мієлоїдного лейкозу (ХМЛ), у якому злитий ген BCR-ABL (продукт реципрокної транслокації між хромосомою 9 і хромосомою 22) присутній у >95% випадків і створює гіперактивовану білкову сигналізацію, керовану abl. Ці ліки спеціально пригнічують білок тирозинкінази Еблесона (ABL) і, таким чином, є яскравим прикладом «раціонального дизайну ліків», заснованого на знанні патофізіології захворювання.[45]
- Звіт FoundationOne CDx, підготовлений Foundation Medicine, який вивчає гени в біопсії пухлини окремих пацієнтів і рекомендує конкретні ліки.
- Високий мутаційний тягар свідчить про відповідь на імунотерапію, а також специфічні моделі мутацій пов’язані з попереднім впливом цитотоксичних препаратів проти раку.[46]
Епігеноміка
Персоналізована медицина, адаптована до унікальних генетичних та епігенетичних особливостей людини, має значні перспективи. Майбутні досягнення в епігеноміці можуть включати розробку персоналізованих епігенетичних профілів, які можуть прогнозувати ризик захворювання, інформувати про вибір лікування та контролювати прогресування захворювання або відповідь на лікування.[47][48][49][50] (див. Епігеноміка)
Респіраторна протеоміка

Хронічні легеневі захворювання (наприклад, астма, хронічна обструктивна хвороба легенів, ідіопатичний легеневий фіброз, та інші) і рак легенів негативно впливають на значну частину населення. Ці стани дуже неоднорідні і вимагають ранньої діагностики, але початкові симптоми неспецифічні, тому клінічний діагноз часто встановлюється пізно. За останні роки респіраторна протеоміка досягла значного прогресу в розробці персоналізованої медицини. Наприклад, у дослідженні, проведеному Lazzari et al. у 2012 році підхід, заснований на протеоміці, суттєво покращив ідентифікацію багатьох біомаркерів раку легенів, які можна використовувати для адаптації індивідуального лікування для окремих пацієнтів.[51] Протягом останніх кількох років у персоналізованій медицині почали використовувати протеоміку для аналізу серії експресій білка замість одного біомаркера.[52] Білки контролюють біологічну діяльність організму, включаючи здоров’я та хвороби, тому протеоміка допомагає в ранній діагностиці. У випадку респіраторного захворювання протеоміка аналізує кілька біологічних зразків, включаючи сироватку, клітини крові, рідини бронхоальвеолярного лаважу (BAL), рідини назального лаважу (NLF), мокротиння тощо. Ідентифікація та кількісна оцінка повної експресії білка з цих біологічних зразків проводяться за допомогою мас-спектрометрії та передових аналітичних методів.[53]
Розробка та застосування ліків
Наявність геномної інформації про людину може значно допомогти в розробці ліків. Здатність визначити пацієнтів, які отримають найбільшу користь в процесі клінічного випробування, підвищить безпеку пацієнтів відносно несприятливих наслідків, викликаних продуктом під час тестування, і дозволить проводити менші та швидші випробування, що призведе до зниження загальних витрат на часу необхідного для розробки і введення препарату на ринок.[54] Крім того, препарати, які вважаються неефективними для більшої частини населення, можуть отримати схвалення FDA завдяки персональним геномам, використаним для оцінки ефективності та потреби в цьому конкретному препараті чи терапії, навіть якщо вони знадобляться лише невеликому відсотку населення.[55][56]
Лікарі часто використовують стратегію "проб і помилок", поки не знайдуть найефективніше лікування.[55] Персоналізована медицина дозволяє передбачити ефективність лікування на основі геному конкретної людини.[57] Такий підхід також є більш економічно ефективним і вигідним.[55] Наприклад, тамоксифен раніше був препаратом, який призначали жінкам з ER+ раком молочної залози, але у 65% осіб розвивалась резистентність. Після досліджень Девіда Флокхарта, було виявлено, що жінки з мутацією в гені CYP2D6, не здатні ефективно розщеплювати Тамоксифен, що робить його неефективним.[58]
Ще однією сферою активних досліджень є ефективна доставка персоналізованих ліків до хворих ділянок тіла.[59] Наприклад, дослідники намагаються сконструювати наноносії, які можуть точно націлюватися на конкретне місце в організмі, використовуючи зображення в реальному часі та аналізуючи фармакодинаміку ліків.[60] Досліджується кілька потенційних наноносіїв: наночастинки оксиду заліза, квантові точки, вуглецеві нанотрубки, наночастинки золота та наночастинки кремнезему.[61] Зміна хімічного складу поверхні дозволяє завантажувати ці наночастинки ліками, а також уникати імунної відповіді організму, що робить можливою тераностику на основі наночастинок.[59][61] Стратегії націлювання наноносіїв відрізняються залежно від захворювання. Наприклад, якщо в лікуванні раку загальним підходом є ідентифікація біомаркера, що експресується на поверхні ракових клітин, і завантаження пов’язаного з ним націлюючого вектора на наноносій для досягнення розпізнавання та зв’язування; масштаб розміру наноносіїв також буде розроблено для досягнення ефекту підвищеної проникності та утримування (EPR) при націлюванні на пухлину.[61] Якщо хвороба локалізована в конкретному органі, такому як нирка, поверхня наноносіїв може бути покрита певним лігандом, який зв’язується з рецепторами всередині цього органу, щоб досягти доставки ліків до органу та уникнути неспецифічного поглинання.[62] Система доставки ліків на основі наночастинок має великий потенціал і прогрес у цій галузі ще попереду, поки що наноносії все ще досліджуються та модифікуються відповідно до клінічних стандартів.[60][61]
Скринінг населення
Завдяки використанню технологій геноміки (мікроматриці), протеоміки (матриця тканин) і візуалізації (фМРТ, мікро-КТ) можна легко отримати інформацію про пацієнтів на молекулярному рівні. По суті, популяційний геномний скринінг можна використовувати для виявлення людей із групою ризику захворювання, що може допомогти в профілактичних зусиллях.[63]
Генетичні дані можна використовувати для побудови полігенних балів, які оцінюють такі ознаки, як ризик захворювання, шляхом підсумовування передбачуваних ефектів окремих варіантів, виявлених за допомогою GWAS. Вони використовувалися для багатьох захворювань, таких як рак, діабет та ішемічна хвороба серця.[64][65] Багато генетичних варіантів пов’язані з походженням, і залишається проблемою як створити точні оцінки, так і відокремити біологічно значущі варіанти від тих, які випадково пов’язані. Оцінки, отримані на основі однієї сукупності, зазвичай погано переносяться на інші, тому потрібні складні методи та більш різноманітні й глобальні дані.[66][67] Більшість досліджень використовували дані тих, хто має європейське походження, що призвело до закликів до більш справедливих методів геноміки, щоб зменшити розбіжності у здоров’ї.[68] Крім того, хоча полігенні оцінки мають певну прогностичну точність, їх інтерпретації обмежуються оцінкою індивідуального процентилю, а для клінічного використання необхідні трансляційні дослідження .[69]
Штучний інтелект
Штучний інтелект швидко зміщує парадигму в бік прицільної медицини.[70] Алгоритми машинного навчання використовуються для визначення та аналізу генної інформації величезної кількості пацієнтів.[71] У статті 2021 року повідомлялося, що завдяки машинному навчанню вдалося передбачити результати III фази клінічних випробувань (для лікування раку простати) з точністю 76%.[72]
Органоїди та органи на чіпі
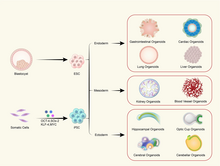
Органоїди — це тривимірні (3D) клітинні структури, вирощені зі стовбурових клітин у лабораторних умовах, які імітують властивості справжніх органів.[74] Ці мініатюрні та спрощені версії структури органу пропонують значний потенціал у галузі персоналізованої медицини.[75]
Близькими до дослідження органоїдів є дослідження органів на чипі. Мікрофлюїдні пристрої «орган-на-чіпі» (органний чіп), облицьовані живими клітинами, культивованими під потоком рідини, можуть з високою точністю повторювати фізіологію та патофізіологію на рівні органів.[76][77][78]
Моделювання захворювань

Органоїди широко використовуються в моделюванні захворювань, оскільки вони можуть повторити складні фізіологічні характеристики органів людини. Вони служать цінними інструментами для вивчення механізмів захворювання на клітинному рівні, особливо таких захворювань, як рак, де пухлини окремих пацієнтів можна моделювати за допомогою органоїдів, отриманих з пухлин.[79]
Пошук ліків і персоналізоване лікування
Органоїди також відіграють вирішальну роль у відкритті ліків і індивідуальних стратегіях лікування. Здатність тестувати реакцію на ліки в органоїдах пацієнта перед введенням їх пацієнту може допомогти передбачити найбільш ефективний метод лікування, мінімізуючи підходи методом проб і помилок. Наприклад, пухлинні органоїди можна використовувати для перевірки чутливості конкретних типів раку до різних хіміотерапевтичних препаратів, потенційно керуючи персоналізованим лікуванням раку.[80][81][82][83][84][85]
В регенеративній медицині

У регенеративній медицині органоїди є перспективними для їх потенційного використання у відновленні тканин і трансплантації органів. Наприклад, дослідження на мишах 2023 року, опубліковане в npj Regenerative Medicine, що досліджувало використання мозкових органоїдів для відновлення функціональної нервової тканини в місці ураження після ішемічного інсульту, показало[87]:
"...Через кілька місяців ми виявили, що трансплантовані органоїди добре вижили в ураженому інфарктом ядрі, диференціювалися в цільові нейрони, відновлювали інфарктну тканину, посилали аксони до віддалених мішеней мозку та інтегрувалися в нейронний ланцюг господаря, тим самим усуваючи сенсомоторні дефекти поведінки мишей, які перенесли інсульт, тоді як трансплантація дисоційованих окремих клітин з органоїдів не привела до відновлення ураженої інфарктом тканини."
Хоча це застосування в основному знаходиться на експериментальній фазі, є надія, що одного дня органоїди можуть стати джерелом тканин і органів для трансплантації, зменшуючи залежність від донорів органів. (Див. також Тканинна інженерія, Інженерія нервової тканини, Друк органів)
Виклики
Оскільки персоналізована медицина практикується все ширше, виникає низка проблем. Нинішні підходи до прав інтелектуальної власності, політики відшкодування, конфіденційності пацієнтів, упередженості та конфіденційності даних, а також регуляторного нагляду необхідно буде переглянути та реструктурувати, щоб відповідати змінам, які персоналізована медицина принесе в охорону здоров’я.[88] Наприклад, опитування, проведене у Великій Британії, показало, що 63% дорослих у Великій Британії не влаштовують використання їхніх особистих даних для використання ШІ в медичній сфері.[89] Крім того, аналіз отриманих діагностичних даних є недавнім викликом персоналізованої медицини та її впровадження.[11] Наприклад, генетичні дані, отримані в результаті секвенування наступного покоління, перед аналізом потребують інтенсивної комп’ютерної обробки даних .[90] У майбутньому знадобляться відповідні інструменти для прискорення впровадження персоналізованої медицини в інші галузі медицини, що потребує міждисциплінарної співпраці експертів із конкретних галузей досліджень, таких як медицина, клінічна онкологія, біологія та штучний інтелект .
Регуляторний нагляд
Управління з продовольства і медикаментів США (FDA) вже почало виступати з ініціативами щодо інтеграції персоналізованої медицини в свою регуляторну політику. Звіт FDA у жовтні 2013 року під назвою «Прокладаючи шлях до персоналізованої медицини: роль FDA у новій епосі розробки медичних продуктів», у якому вони окреслили кроки, які вони мають зробити, щоб інтегрувати генетичну інформацію та інформацію про біомаркери для клінічного використання та розробки ліків.[91] Вони визначили, що їм доведеться розробити спеціальні нормативні наукові стандарти, методи дослідження, довідкові матеріали та інші інструменти, щоб включити персоналізовану медицину в свою поточну нормативну практику. Наприклад, вони працюють над «геномною довідковою бібліотекою» для регулюючих органів, щоб порівнювати та перевіряти валідність різних платформ секвенування з метою підтримки надійності.[91] Основним викликом для тих, хто регулює персоналізовану медицину, є спосіб продемонструвати її ефективність порівняно з поточним стандартом медичної допомоги. Нову технологію необхідно оцінити як на клінічну, так і на економічну ефективність, і в поточному стані регуляторні органи не мають стандартизованого методу.[92]
Право інтелектуальної власності
Як і будь-які інновації в медицині, на інвестиції та інтерес до персоналізованої медицини впливають права інтелектуальної власності.[88] Було багато суперечок щодо патентного захисту діагностичних засобів, генів і біомаркерів. У червні 2013 року Верховний суд США постановив, що природні гени не можуть бути запатентовані, тоді як «синтетичну ДНК», яка була відредагована або створена штучно, все ще можна запатентувати. Патентне відомство зараз розглядає низку питань, пов’язаних із патентним законодавством для персоналізованої медицини, наприклад, чи можуть «підтверджуючі» вторинні генетичні тести після первинного діагнозу мати повний імунітет від патентного законодавства. Ті, хто виступає проти патентів, стверджують, що патенти на послідовності ДНК є перешкодою для поточних досліджень, у той час як прихильники вказують на звільнення від досліджень і наголошують, що патенти необхідні для залучення та захисту фінансових інвестицій, необхідних для комерційних досліджень, а також розвитку та просування пропонованих послуг.[93]
Політика відшкодування
Політику відшкодування необхідно буде переглянути, щоб відповідати змінам, які персоналізована медицина принесе в систему охорони здоров’я. Деякі з факторів, які слід враховувати, це рівень ефективності різноманітних генетичних тестів у загальній популяції, економічна ефективність по відношенню до переваг, як мати справу з платіжними системами для надзвичайно рідкісних захворювань і як переосмислити концепцію страхування «спільного ризик», щоб включити ефект новішої концепції «індивідуальних факторів ризику».[88] У дослідженні « Перешкоди для використання персоналізованої медицини при раку молочної залози » використовувалися два різні діагностичні тести: BRAC Analysis і Oncotype DX. Ці тести тривають понад десять днів, що призводить до невдачі та затримок у лікуванні. Пацієнти не отримують відшкодування за ці затримки, що призводить до непризначення тестів. Зрештою, це призводить до того, що пацієнти змушені платити за лікування зі своєї кишені, оскільки страхові компанії не хочуть брати на себе пов’язані з цим ризики.[94]
Конфіденційність
Мабуть, найбільш критичною проблемою комерціалізації персоналізованої медицини є захист пацієнтів. Однією з найбільших проблем є страх і потенційні наслідки для пацієнтів, які після генетичного тестування схильні або не реагують на певні види лікування. Це включає психологічний вплив на пацієнтів через результати генетичного тестування. Іншим питанням є право членів сім’ї, які не дають прямої згоди, враховуючи, що генетична схильність і ризики є спадковими. Слід також враховувати наслідки для певних етнічних груп і наявність загального алеля.[88]
Крім того, ми можемо посилатися на питання конфіденційності на всіх рівнях персоналізованої медицини від відкриття до лікування. Одним із провідних питань є згода пацієнтів на використання їхньої інформації в алгоритмах генетичного тестування, насамперед у алгоритмах ШІ. Згода установи, яка надає дані для використання, також має важливе значення.[89] У 2008 році було прийнято Закон про недискримінацію генетичної інформації (GINA), щоб мінімізувати страх пацієнтів, які беруть участь у генетичних дослідженнях, гарантуючи, що їхня генетична інформація не буде використана роботодавцями чи страховими компаніями.[88] 19 лютого 2015 року FDA випустило прес-реліз під назвою: «FDA дозволяє продавати перший тест на генетичне носійство для синдрому Блума безпосередньо споживачеві.[3]
Упередженість алгоритмів
Упередженість алгоритмів аналізу баз даних також відіграють важливу роль у персоналізованій медицині. Важливо переконатися, що зразок тестованих генів походить від різних популяцій. Це робиться для того, щоб у зразках не виявлялися ті самі людські упередження, які ми використовуємо під час прийняття рішень.[95]
Отже, якщо розроблені алгоритми для персоналізованої медицини є упередженими, то результат алгоритму також буде упередженим через відсутність генетичного тестування в певних популяціях.[96] Наприклад, результати Фремінгемського дослідження серця призвели до необ’єктивних результатів прогнозування ризику серцево-судинних захворювань. Це пояснюється тим, що зразок тестували лише на білих людях, а при застосуванні до небілого населення результати були упередженими з переоцінкою та недооцінкою ризиків серцево-судинних захворювань.[97]
Реалізація
Перш ніж запровадити персоналізовану медицину, необхідно вирішити кілька проблем. Дуже мало геному людини було проаналізовано, і навіть якби медичні працівники мали доступ до повної генетичної інформації пацієнта, дуже мало її можна було б ефективно використати для лікування.[98] Проблеми також виникають під час обробки таких великих обсягів генетичних даних. Навіть за низького рівня помилок 1 на 100 кілобаз обробка геному людини може мати приблизно 30 000 помилок.[99] Така кількість помилок, особливо при спробі ідентифікації конкретних маркерів, може ускладнити відкриття та перевірку. Існують методи подолання цього, але вони обчислювальні та дорогі. Існують також проблеми з точки зору ефективності, оскільки після обробки геному необхідно проаналізувати функцію варіацій між геномами за допомогою загальногеномних досліджень. Хоча вплив SNP, виявлених у таких дослідженнях, можна передбачити, потрібно зробити більше, щоб контролювати величезну кількість варіацій, які можуть виникнути через розмір досліджуваного геному.[99] Щоб ефективно рухатися вперед у цій галузі, необхідно вжити заходів, щоб переконатися, що дані, що аналізуються, є якісними, і має бути прийнято ширше бачення з точки зору аналізу кількох SNP для фенотипу. Найактуальнішим питанням впровадження персоналізованої медицини є застосування результатів генетичного картування для покращення системи охорони здоров’я. Це пов’язано не лише з інфраструктурою та технологіями, необхідними для централізованої бази даних геномів, але й тому, що лікарі, які мали б доступ до цих інструментів, ймовірно, не змогли б повністю ними скористатися.[99] Для того, щоб по-справжньому запровадити персоналізовану систему охорони здоров’я, необхідно провести наскрізні зміни.
Копенгагенський інститут досліджень майбутнього та компанія Roche створили FutureProofing Healthcare [100], яка розробляє персоналізований індекс здоров’я, оцінюючи ефективність різних країн за 27 різними індикаторами персоналізованого здоров’я за чотирма категоріями під назвою «Життєві показники». Вони провели конференції в багатьох країнах, щоб перевірити свої висновки.[101][102]
Питання про те, хто отримує вигоду від геноміки, що фінансується державою, є важливим питанням охорони здоров’я, і необхідно звернути увагу на те, щоб впровадження геномної медицини не посилювало проблеми соціальної справедливості.[103]
Досягнення персоналізованої медицини створять більш уніфікований підхід до лікування, специфічний для людини та її геному. Персоналізована медицина може забезпечити кращу діагностику з раннім втручанням, ефективнішу розробку ліків і більш цілеспрямовану терапію
Дивіться також
Література
Книги
- Pingitore, Alessandro; Iacono, Alfonso Maurizio (2023). The patient as a person: an integrated and systemic approach to patient and disease. Cham, Switzerland: Springer Nature. ISBN 978-3-031-23852-9.
- Beneduce, Chiara; Bertolaso, Marta (2022). Personalized medicine in the making: philosophical perspectives from biology to healthcare. Cham: Springer Nature. ISBN 978-3-030-74804-3.
- Yahaya, Badrul Hisham (2022). Organoid technology for disease modelling and personalized treatment. Cham. ISBN 978-3-030-93056-1.