Nātrija karbonāts
- Šis raksts ir par kalcinēto sodu. Par citām jēdziena soda nozīmēm skatīt nozīmju atdalīšanas lapu.
Nātrija karbonāts jeb kalcinētā soda (Na2CO3) ir balta kristāliska viela, kas labi šķīst ūdenī. Nātrija karbonāta kristālhidrātu ar 10 molekulām ūdens sauc par mazgājamo sodu. Nosaukums "soda" cēlies no auga Salsola soda (no tā pelniem ieguva nātrija karbonātu), bet "kalcinētā" nozīmē "izkarsētā" (senie alķīmiķi karsēšanu augstā temperatūrā dēvēja par kalcinēšanu un kalcinētās sodas iegūšanā tika izkarsēts tās kristālhidrāts).
| Nātrija karbonāts | |
|---|---|
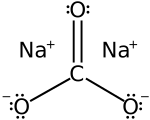 Nātrija karbonāta struktūrformula  Nātrija karbonāta kristālrežģis | |
| Citi nosaukumi | kalcinētā soda, ogļskābais nātrijs |
| CAS numurs | 497-19-8 |
| Ķīmiskā formula | Na2CO3 |
| Molmasa | 105,9884 g/mol |
| Blīvums | 2540 kg/m3 |
| Kušanas temperatūra | 851 °C |
| Viršanas temperatūra | 1600 °C |
| Šķīdība ūdenī | 21,8g/100ml pie 20 °C |
Atrašanās dabā
Na2CO3 ir sastopams dabā dažu ezeru ūdenī (piemēram, Natrona ezerā Tanzānijā), kā arī augu, it sevišķi jūras aļģu, pelnos.
Nātrija karbonāta minerāli
- Nahkolīts NaHCO3
- Trons Na2CO3·NaHCO3·2H2O
- Natrons Na2CO3·10H2O
- Termonatrīts Na2CO3·Н2O.
Iegūšana
Senāk sodu ieguva galvenokārt no ūdensaugu pelniem.Vēlāk tika izstrādātas 3 galvenās sodas iegūšanas metodes.
Leblāna metode
To patentējis franču ķīmiķis Nikola Leblāns (Nicolas Leblanc) 1791. gadā kā paņēmienu glaubersāls pārvēršanai sodā un tas pamatojās uz nātrija sulfāta jeb glaubersāls karsēšanu 1000 °C temperatūrā kopā ar krītu vai kaļķakmeni un kokogli. Ogle reducē nātrija sulfātu līdz sulfīdam:
- Na2SO4 + 2C → Na2S + 2CO2↑
Nātrija sulfīds reaģē ar kalcija karbonātu:
- Na2S + СаСО3 → Na2CO3 + CaS
Iegūto kausējumu šķīdina ūdenī - soda izšķīst, bet nešķīstošo kalcija sulfīdu var nofiltrēt. Šķīdumu pēc tam ietvaicē, iegūstot nātrija karbonāta kristālhidrātu, kuru var atūdeņot izkarsējot.
Nātrija sulfātu savukārt var iegūt, apstrādājot akmenssāli (nātrija hlorīdu) ar sērskābi:
- 2NaCl + H2SO4 → Na2SO4 + 2HCl↑
Reakcijas gaitā izdalījušos hlorūdeņradi šķīdina ūdenī, iegūstot sālsskābi.
Kad tika izstrādāta daudz ekonomiskākā Solveja metode (tā nedod kalcija sulfīda blakusproduktu), ar Leblāna paņēmienu strādājošās rūpnīcas tika slēgtas. 1900. gadā 90% sodas rūpnīcu jau strādāja pēc Solveja metodes.
Solveja metode
Beļģu inženieris ķīmiķis Ernests Solvejs (Ernest Solvay) 1861. gadā patentēja jaunu sodas ieguves paņēmienu, ko sauc arī par amonjaka metodi, jo tas pamatojas uz amonjaka un ogļskābās gāzes reakciju ar nātrija hlorīdu:
Relatīvi mazšķīstošās (9,6 g uz 100 g ūdens pie 20 °C) nātrija hidrogēnkarbonāta nogulsnes nofiltrē un karsē pie 140—160 °C:
- 2NaHCO3 → Na2CO3 + CO2↑ + H2O
Veidojas nātrija karbonāts un CO2. Ogļskābo gāzi no jauna izmanto ražošanas ciklā, tāpat kā amonjaku, kuru izdala no atsāļņa ar kalcija hidroksīda palīdzību:
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
Ogļskābo gāzi iegūst arī, karsējot kalcija karbonātu:
- CaCO3 → CaO + CO2↑
Savukārt no kalcija oksīda rodas amonjaka reģenerēšanai nepieciešamais kalcija hidroksīds:
- CaO + H2O → Ca(OH)2
Mūsdienās šo metodi plaši izmanto visā pasaulē.
Hou metode
Šo paņēmienu izstrādājis ķīniešu ķīmiķis Hou Debangs (Hou Debang) 1930. gados. Tā ir modificēta Solveja metode, kurā neizmanto kalcija karbonātu, bet amonija hlorīdu atdala no šķīduma, to atdzesējot līdz 10 °C.
Īpašības

Karsējot nātrija karbonātu, tas sadalās par nātrija oksīdu un ogļskābo gāzi. Ūdens šķīdumos, reaģējot ar oglekļa dioksīdu, nātrija karbonāts veido nātrija hidrogēnkarbonātu NaHCO3.
Izmantošana
Nātrija karbonāts ir viena no stikla pamatizejvielām. To lieto arī ziepju un sintētisko mazgāšanas līdzekļu ražošanā. Izmanto ūdens mīkstināšanai tehnikā (tvaika katlos) un sadzīvē, metālu attaukošanai, čuguna desulfatēšanai domnās. No sodas iegūst nātrija hidroksīdu, boraku, nātrija hidrogēnfosfātu. Pārtikas rūpniecībā to izmanto kā skābuma regulētāju, irdinātāju un pretsalipes vielu (E500).
Sodu izmanto dzelzi saturošu metāla virsmu un detaļu papildus apstrādei pēc iedarbības ar smilšu, skrošu vai citu abrazīvu strūklu. No atmosfēras brīvā mitruma, tam savienojoties ar atmosfērā esošo oglekļa dioksīdu, veidojas ogļskābe, kas veicina dzelzs oksidēšanos jeb rūsēšanu. Izmantojot apstrādi ar sodu, tā veido skābes neitralizējošu slāni līdz brīdim, kad virsma tiek nomazgāta.[1]
Skatīt arī
- Soda
- Nātrija hidrogēnkarbonāts (dzeramā soda)
Atsauces
| Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Nātrija karbonāts |