Indium
Indium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang In dan nomor atom 49. Ini adalah logam pasca transisi yang menyusun 0,21 ppm dari kerak bumi. Indium sangat empuk dan lunak, memiliki titik lebur lebih tinggi daripada natrium dan galium, tetapi lebih rendah daripada litium dan timah. Secara kimiawi, indium mirip dengan galium dan thallium, dan sebagian besar sifatnya berada di antara galium dan thallium.[6] Indium ditemukan pada tahun 1863 oleh Ferdinand Reich dan Hieronim Theodor Richter dengan metode spektroskopi. Mereka menamainya sesuai garis indigo dalam spektrumnya. Indium diisolasi pada tahun berikutnya.
| Indium | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Batang indium murni, masing-masing memiliki berat kira-kira satu pon | |||||||||||||||||||||
Garis spektrum indium | |||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||
| Nama, lambang | indium, In | ||||||||||||||||||||
| Pengucapan | /indium/[1] | ||||||||||||||||||||
| Penampilan | abu-abu berkilau keperakan | ||||||||||||||||||||
| Indium dalam tabel periodik | |||||||||||||||||||||
| |||||||||||||||||||||
| Nomor atom (Z) | 49 | ||||||||||||||||||||
| Golongan | golongan 13 | ||||||||||||||||||||
| Periode | periode 5 | ||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||
| Kategori unsur | logam miskin | ||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||
| Konfigurasi elektron | [Kr] 4d10 5s2 5p1 | ||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 18, 3 | ||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||
| Titik lebur | 429,7485 K (156,5985 °C, 313,8773 °F) | ||||||||||||||||||||
| Titik didih | 2345 K (2072 °C, 3762 °F) | ||||||||||||||||||||
| Kepadatan mendekati s.k. | 7,31 g/cm3 | ||||||||||||||||||||
| saat cair, pada t.l. | 7,02 g/cm3 | ||||||||||||||||||||
| Titik tripel | 429,7445 K, ~1 kPa[2] | ||||||||||||||||||||
| Kalor peleburan | 3,281 kJ/mol | ||||||||||||||||||||
| Kalor penguapan | 231,8 kJ/mol | ||||||||||||||||||||
| Kapasitas kalor molar | 26,74 J/(mol·K) | ||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||
| Bilangan oksidasi | −5, −2, −1, +1, +2, +3[3] (oksida amfoter) | ||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,78 | ||||||||||||||||||||
| Energi ionisasi | ke-1: 558,3 kJ/mol ke-2: 1820,7 kJ/mol ke-3: 2704 kJ/mol | ||||||||||||||||||||
| Jari-jari atom | empiris: 167 pm | ||||||||||||||||||||
| Jari-jari kovalen | 142±5 pm | ||||||||||||||||||||
| Jari-jari van der Waals | 193 pm | ||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||
| Struktur kristal | tetragon acuan dasar | ||||||||||||||||||||
| Kecepatan suara batang ringan | 1215 m/s (suhu 20 °C) | ||||||||||||||||||||
| Ekspansi kalor | 32,1 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||
| Konduktivitas termal | 81,8 W/(m·K) | ||||||||||||||||||||
| Resistivitas listrik | 83,7 nΩ·m (suhu 20 °C) | ||||||||||||||||||||
| Arah magnet | diamagnetik[4] | ||||||||||||||||||||
| Suseptibilitas magnetik molar | −64,0×10−6 cm3/mol (298 K)[5] | ||||||||||||||||||||
| Modulus Young | 11 GPa | ||||||||||||||||||||
| Skala Mohs | 1,2 | ||||||||||||||||||||
| Skala Brinell | 8,8–10,0 MPa | ||||||||||||||||||||
| Nomor CAS | 7440-74-6 | ||||||||||||||||||||
| Sejarah | |||||||||||||||||||||
| Penemuan | F. Reich dan Hieronymous T. Richter (1863) | ||||||||||||||||||||
| Isolasi pertama | Hieronymous T. Richter (1864) | ||||||||||||||||||||
| Isotop indium yang utama | |||||||||||||||||||||
| |||||||||||||||||||||
Indium adalah komponen minor dalam bijih seng sulfida dan diproduksi sebagai produk sampingan dari penghalusan seng. Logam ini digunakan terutama dalam industri semikonduktor, pada logam paduan dengan titik lebur rendah seperti solder, pada segel vakum bertekanan tinggi, dan dalam produksi pelapis konduktif transparan indium timah oksida (ITO) pada kaca. Indium tidak memiliki peran biologis, meski senyawanya agak beracun saat disuntikkan ke dalam aliran darah. Sebagian besar paparan kerja adalah melalui pencernaan, yang penyerapan senyawa indiumnya kurang baik, dan inhalasi, yang cukup baik penyerapannya.
Sifat fisika dan kimia
Sifat fisika

Indium adalah logam pasca transisi berwarna putih-keperakan yang sangat ulet dengan kilau terang.[7] Ia sangat empuk (kekerasan Mohs 1,2) seperti natrium, dan bisa dipotong menggunakan pisau. Ia juga meninggalkan garis yang terlihat di atas kertas.[8] Ia adalah anggota golongan 13 pada tabel periodik dan sifat-sifatnya sebagian besar berada di antara tetangga vertikalnya, galium dan thallium. Seperti timah, suara melengking bernada tinggi terdengar saat indium ditekuk – suara berderak akibat pengembaran kristal.[7] Seperti galium, indium mampu membasahi kaca. Seperti keduanya, indium memiliki titik leleh rendah, 156,60 °C (313,88 °F); lebih tinggi daripada homolognya yang lebih ringan, galium, tapi lebih rendah daripada homolognya yang lebih berat, thallium, dan lebih rendah daripada timah.[9] Titik didihnya adalah 2072 °C (3762 °F), lebih tinggi daripada thallium, tapi lebih rendah dari galium, terbalik dengan kecenderungan titik leleh pada umumnya, tetapi kecenderungan menurunnya sesuai dengan golongan logam pasca transisi lainnya karena lemahnya ikatan logam dengan sedikit elektron terdelokalisasi.[10]
Densitas indium adalah 7,31 g/cm3, lebih besar daripada galium, tapi lebih rendah daripada thallium. Di bawah temperatur kritis, 3,41 K, indium menjadi superkonduktor. Pada suhu dan tekanan standar, indium mengkristal dalam sistem kristal tetragonal yang berpusat pada muka pada kelompok ruang I4/mmm (parameter kisi: a = 325 pm, c = 495 pm):[9] ini adalah struktur en:face-centered cubic yang sedikit terdistorsi, di mana masing-masing atom indium memiliki empat tetangga pada jarak 324 pm dan delapan tetangga sedikit lebih jauh (336 pm).[11] Indium menampilkan respons viskoplastik ulet, yang ditemukan sebagai ketegangan dan kompresi yang tidak tergantung pada ukuran. Namun, ini memiliki efek ukuran dalam pembengkokan dan lekukan, terkait dengan skala panjang pada tingkat 50-100 μm,[12] relatif besar bila dibandingkan dengan logam lainnya.
Sifat kimia
Indium memiliki 49 elektron, dengan konfigurasi elektron [Kr]4d105s25p1. Dalam senyawa, indium paling sering menyumbangkan tiga elektron terluarnya menjadi indium(III), In3+. Dalam beberapa kasus, pasangan elektron 5s tidak disumbangkan, menghasilkan indium(I), In+. Stabilisasi keadaan monovalen terkait dengan efek pasangan inert, di mana efek relativistik menstabilkan orbital 5s, yang teramati pada unsur yang lebih berat. Thallium (homolog indium yang lebih berat) menunjukkan efek yang lebih kuat, menyebabkan oksidasi menjadi thallium(I) menjadi lebih memungkinkan daripada menjadi thallium(III),[13] sedangkan gallium (homolog indium yang lebih ringan) biasanya hanya menunjukkan tingkat oksidasi +3. Jadi, walaupun thallium(III) adalah oksidator yang cukup kuat, namun tidak demikian dengan indium(III), bahkan banyak senyawa indium(I) adalah reduktor kuat.[14] Sementara energi terendah yang dibutuhkan untuk memasukkan elektron s ke dalam ikatan kimia adalah untuk indium di antara logam golongan 13, energi ikatan menurun sepanjang golongan dari atas ke bawah sehingga untuk indium, energi yang dilepaskan dalam membentuk dua ikatan tambahan dan mencapai keadaan +3 tidak selalu cukup untuk melampaui energi yang dibutuhkan untuk melibatkan elektron 5s.[15] Indium(I) oksida dan hidroksida bersifat lebih basa sedangkan indium(III) oksida dan hidroksida bersifat lebih asam.[15]
Sejumlah potensial elektrode standar indium yang dilaporkan, tergantung pada reaksi yang diteliti,[16] mencerminkan penurunan stabilitas tingkat oksidasi +3:[11]
| −0,40 | In2+ + e− | ↔ In+ |
| −0,49 | In3+ + e− | ↔ In2+ |
| −0,443 | In3+ + 2 e− | ↔ In+ |
| −0,3382 | In3+ + 3 e− | ↔ In |
| −0,14 | In+ + e− | ↔ In |
Logam indium tidak bereaksi dengan air, namun dioksidasi oleh oksidator kuat seperti halogen, menghasilkan senyawa indium(III). Ia tidak membentuk suatu borida, silisida, atau karbida, dan hidridanya InH3 berada pada kondisi transisi terbaiknya dalam larutan eter pada suhu rendah, dan tidak cukup stabil untuk dipolimerisasi secara spontan tanpa koordinasi.[14] Indium bersifat sedikit basa dalam larutan akuatik, hanya menunjukkan sedikit karakteristik amfoter, dan tidak seperti homolognya yang lebih ringan, aluminium dan galium, ia tidak larut dalam larutan alkali.[17]
Isotop
Indium memiliki 39 isotop yang diketahui, dengan rentang nomor massa antara 97 sampai 135. Hanya dua isotop yang terjadi secara alami sebagai nuklida purba: indium-113, satu-satunya isotop stabil, dan indium-115, yang memiliki waktu paruh 4,41×1014 tahun, empat orde besarnya lebih besar daripada umur alam semesta dan hampir 50.000 kali lebih besar daripada thorium alami.[18] Waktu paruh 115In sangat lama karena peluruhan beta menjadi 115Sn adalah spin-terlarang.[19] Indium-115 menyusun 95,7% dari total indium. Indium adalah satu dari tiga unsur yang diketahui (yang lain adalah telurium dan renium) di mana isotop stabil kurang berlimpah di alam daripada radioisotop primordial berumur panjang.[20]
Isotop buatan paling stabil adalah indium-111, dengan waktu paruh kira-kira 2,8 hari. Semua isotop lainnya memiliki waktu paruh lebih pendek dari 5 jam. Indium juga memiliki 47 keadaan meta, di antaranya indium-114m1 (waktu paruh sekitar 49,51 hari) adalah yang paling stabil, lebih stabil daripada keadaan dasar setiap isotop indium selain isotop primordial. Semua peluruhan merupakan transisi isomerik. Isotop indium yang lebih ringan daripada 115In terutama meluruh melalui tangkapan elektron atau emisi positron untuk membentuk isotop kadmium, sedangkan isotop indium lainnya mulai 115In dan yang lebih besar didahului peluruhan peluruhan beta minus untuk membentuk isotop timah.[18]
Senyawa
Indium(III)
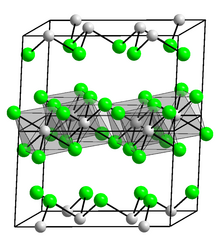
Indium(III) oksida, In, terbentuk saat logam indium dibakar di udara atau bila hidroksida atau nitratnya dipanaskan.[21] In mengadopsi struktur seperti alumina dan bersifat amfoter, yaitu mampu bereaksi dengan asam maupun basa. Indium bereaksi dengan air menghasilkan indium (III) hidroksida, yang mudah larut dan bersifat amfoter; dengan alkali menghasilkan indat(III); dan dengan asam menghasilkan garam indium(III):
- In(OH) + 3 HCl → InCl + 3 H
Diketahui juga seskuikalsogenida analognya dengan belerang, selenium, and telurium.[22] Indium membentuk trihalida. Klorinasi, brominasi, dan iodinasi In menghasilkan InCl3 dan InBr3 yang tak berwarna, serta InI3 yang berwarna kuning. Senyawanya merupakan asam Lewis, agak mirip dengan trihalida aluminium yang lebih dikenal. Sekali lagi seperti senyawa alumunium terkait, InF3 dapat membentuk polimer.[23]
Reaksi langsung indium dengan pniktogen menghasilkan semikonduktor III-V yang berwarna abu-abu atau semimetalik. Banyak dari mereka perlahan terdekomposisi di udara lembap, sehingga penyimpanan senyawa semikonduktor secara hati-hati untuk mencegah kontak dengan atmosfer sangat diperlukan. Indium nitrida mudah diserang oleh asam maupun basa.[24]
Indium(I)
Senyawa indium(I) tidak umum. Klorida, bromida, dan iodidanya sangat berwarna, tidak seperti trihalida nya yang merupakan bahan bakunya. Fluoridanya dikenal sebagai senyawa gas yang tidak stabil.[25] Bubuk hitam indium(I) oksida dihasilkan saat oksida indium(III) terdekomposisi pada pemanasan sampai 700 °C.[21]
Tingkat oksidasi lain
Kadang-kadang, indium membentuk senyawa dengan tingkat oksidasi +2 dan bahkan tingkat oksidasi fraksional. Biasanya materials semacam itu memiliki ikatan In-In, terutama pada halida In dan [In''";,[26] dan berbagai subkalkogenida seperti In.[27] Beberapa senyawa lain diketahui merupakan kombinasi antara indium(I) dan indium(III), seperti InI6(InIIICl,[28] InI5(InIIIBr(InIIIBr6),[29] InIInIIIBr4.[26]
Senyawa organoindium
Senyawa organoindium memiliki ikatan In–C. Sebagian besar merupakan turunan In(III), tetapi ada perkecualian yaitu siklopentadienilindium(I). Ini merupakan senyawa organoindium(I) yang pertama kali diketahui,[30] dan dapat bersifat polimerik, dengan rantai zigzag dan berseling antara atom indium dan kompleks siklopentadienil.[31] Kemungkinan, senyawa organoindium yang paling terkenal adalah trimetilindium, In(CH''";, yang digunakan untuk membuat bahan semikondukter tertentu.[32][33]
Sejarah
Pada tahun 1863, kimiawan Jerman Ferdinand Reich dan Hieronymous Theodor Richter menguji bijih dari pertambangan di sekitar Freiberg, Saxony. Mereka melarutkan mineral pirit, arsenopirit, galena, dan sfalerit dalam asam klorida serta mendistilasi seng klorida mentah. Reich, yang merupakan seorang penderita buta warna, mengangkat Richter sebagai asistennya untuk mendeteksi warna garis spektrum. Mereka mengetahui bahwa bijih dari area tersebut kadang-kadang mengandung thallium, mereka mencari garis spektrum emisi thallium yang berwarna hijau. Tidak disangka, mereka malah menemukan garis biru terang. Oleh karena garis biru tersebut tidak cocok dengan unsur yang telah dikenal, mereka membuat hipotesis adanya unsur baru dalam mineral. Mereka menyebutnya indium, dari warna indigo yang mereka lihat dalam spektrum tersebut, sesuai nama Latinnya, indicum.[34][35][36][37]
Richter mengisolasi logam tersebut pada tahun 1864.[38] Sebuah batang logam seberat 05 kg (11 pon) dipresentasikan dalam World Fair 1867.[39] Reich dan Richter kemudian tumbang saat orang terakhir mengaku sebagai satu-satunya penemu.[37]
Keberadaan

Indium terbentuk melalui proses s (tangkapan neutron lambat) yang berlangsung sangat lama (mencapai ratusan tahun) dalam bintang bermassa rendah hingga sedang (rentang massa antara 0,6 dan 10 kali massa matahari). Ketika atom perak-109 (isotop yang menyusun sekitar separuh dari seluruh perak yang ada) menangkap neutron, ia mengalami peluruhan beta menjadi kadmium-110. Penangkapan neutron lebih lanjut, akan membentuk kadmium-115, yang meluruh menjadi indium-115 melalui peluruhan beta lainnya. Hal ini menjelaskan alasan isotop radioaktif lebih melimpah daripada isotop stabilnya.[40] Isotop indium stabil, indium-113, adalah salah satu dari inti-p, yang asal usulnya tidak sepenuhnya dipahami; meskipun indium-113 diketahui merupakan produk langsung dari proses s dan proses r (tangkapan elektron cepat), dan juga merupakan turunan dari kadmium-113 yang berumur sangat panjang (dengan waktu paruh sekitar delapan kuadriliun tahun), hal ini tidak juga menyingkap seluruh tabir indium-113.[41][42]
Di kerak bumi, indium jarang berada sebagai butiran logam bebas, terlalu langka dan kecil untuk kepentingan komersial.[43] Indium adalah unsur paling melimpah di kerak bumi kira-kira 160 ppb, kira-kira sama melimpahnya seperti kadmium.[44] Kurang dari 10 mineral indium yang diketahui dan tidak ada satupun endapan yang bermakna. Dua di antaranya adalah dzhalindite (In(OH)) dan indit (FeIn).[45]
Indium cenderung berada bersama dengan seng dalam mineral sulfida karena kedua unsur tersebut memiliki jari-jari atom dan sifat kimia yang serupa.[46] Berdasarkan kandungan indium dalam bijih seng, total cadangan indium yang layak secara ekonomis sekitar 6.000 ton,[47] dan Royal Society of Chemistry mengingatkan risiko serius bahwa pasokan indium akan habis dalam satu abad.[48] Namun, Indium Corporation, pengolah indium terbesar, menyatakan, berdasarkan peningkatan rendemen selama ekstraksi, bahwa pemulihan dimungkinkan dari rentang logam dasar yang lebih lebar (deposit timah, tembaga, dan polimetalik lainnya) dan dari investasi pertambangan, serta pasokan jangka panjang indium dapat berkelanjutan, andal, dan cukup untuk memenuhi tuntutan masa depan yang semakin meningkat.[49]
Produksi

Keterbatasan deposit mineral indium dan adanya fakta bahwa indium banyak dalam deposit sulfida timbal, timah, tembaga, besi, dan terutama seng, membuat produksi seng dan timbal menjadi sumber utama indium. Indium diluluhkan dari terak (slag) dan debu produksi seng. Pemurnian lanjutan dilakukan dengan cara elektrolisis.[51] Proses pastinya bervariasi sesuai komposisi tepatnya dari terak dan debu.[7][39]
Produksi utama indium berasal dari residu yang dihasilkan selama pemrosesan bijih seng, tetapi juga ditemukan dalam bijih besi, timbal, dan tembaga.[7] China merupakan produsen utama indium (390 ton pada tahun 2012), diikuti Kanada, Jepang, dan Korea Selatan dengan masing-masing 70 ton.[52] Pabrik pengolahan Teck Cominco di Trail, British Columbia, adalah produsen indium salah satu sumber tunggal terbesar, dengan produksi sebesar 32,5 ton pada tahun 2005, 41,8 ton pada tahun 2004 dan 36,1 ton pada tahun 2003. Tambang Malku Khota di Bolivia yang dioperasikan oleh South American Silver Corporation adalah sebuah sumber indium besar dengan cadangan terlihat 1.481 ton dan cadangan rekaan sebesar 935 ton.[53] Tambang Mount Pleasent di New Brunswick, Kanada, yang dioperasikan oleh Adex Mining Inc memegang sebagian besar sumber daya indium dunia.[54]
Konsumsi utama indium di seluruh dunia adalah produksi Liquid Crystal Display, (LCD). Produksi di seluruh dunia pada tahun 2007 adalah 475 ton per tahun dari pertambangan dan 650 ton per tahun dari daur ulang.[49] Permintaan meningkat tajam beberapa tahun terakhir seiring dengan meningkatnya popularitas monitor komputer dan televisi LCD, yang saat ini terhitung 50% dari konsumsi indium.[55] Meningkatnya efisiensi pabrikasi dan daur ulang (terutama di Jepang) menjaga keseimbangan antara permintaan dan pasokan. Menurut UNEP, tingkat daur ulang indium kurang dari 1%.[56] Menurut prakiraan, pasokan indium tinggal untuk kurang dari 14 tahun lagi, berdasarkan laju ekstraksi saat ini, sehingga memerlukan kebutuhan daur ulang tambahan.[57]
Aplikasi

Pada tahun 1924, indium ditemukan memiliki sifat yang berharga yaitu untuk menstabilkan logam non-besi, dan itu menjadi penggunaan signifikan pertama unsur tersebut.[58] Aplikasi indium berskala besar pertama adalah untuk pelapisan bantalan pada mesin pesawat terbang berkinerja tinggi selama Perang Dunia II, untuk melindungi dari kerusakan dan korosi; namun ini tidak lagi menjadi penggunaan utama unsur ini.[51] Penggunaan baru ditemukan pada aloy terleburkan (Inggris: fusible alloy), solder, dan elektronik. Pada tahun 1950an, butiran kecil indium digunakan untuk pemancar dan pengumpul PNP transistor sambungan dwikutub. Pada pertengahan dan akhir 1980an, pengembangan semikonduktor indium fosfida dan film tipis indium timah oksida untuk penampil kristal cair (LCD) membangkitkan banyak minat. Pada tahun 1992, aplikasi film tipis telah menjadi penggunaan akhir terbesar.[59][60]
Indium(III) oksida dan indium timah oksida (ITO) digunakan sebagai pelapis konduktif transparan pada substrat kaca dalam panel elektroluminesen.[61] Indium timah oksida digunakan sebagai filter cahaya di lampu uap natrium bertekanan rendah. Radiasi inframerah dipantulkan kembali ke lampu, yang meningkatkan suhu di dalam tabung dan meningkatkan kinerja lampu.[60]
Indium memiliki banyak aplikasi yang berhubungan dengan semikonduktor. Beberapa senyawa indium, seperti indium antimonida dan indium fosfida,[62] adalah semikonduktor dengan sifat yang berguna: satu prekursor biasanya trimetilindium (TMI), yang juga digunakan sebagai semikonduktor dopan dalam semikonduktor majemuk II-VI.[63] InAs dan InSb digunakan untuk transistor dengan suhu rendah dan InP untuk transistor dengan suhu tinggi.[51] Semikonduktor majemuk InGaN dan InGaP digunakan di diode pemancar cahaya (LED) dan diode laser.[64] Indium digunakan dalam fotovoltaik sebagai semikonduktor tembaga indium galium selenida (Copper Indium Gallium Selenide, CIGS), yang disebut juga sel surya CIGS, suatu jenis sel surya film tipis generasi kedua.[65] Indium digunakan dalam PNP transistor sambungan dwikutub dengan germanium: bila disolder pada suhu rendah, indium tidak menekan germanium.[51]

Kabel Indium digunakan sebagai segel segel vakum dan konduktor termal pada aplikasi kriogenik dan vakum ultra-tinggi, dalam aplikasi manufaktur seperti gasket yang berubah bentuk untuk mengisi celah.[66] Indium adalah bahan dalam paduan galium-indium-timah galinstan, yang cair pada suhu kamar dan menggantikan raksa dalam beberapa termometer.[67] Paduan lain dari indium dengan bismut, kadmium, timbal, dan timah, yang memiliki titik leleh yang lebih tinggi, namun masih rendah, (antara 50 dan 100 °C), digunakan dalam sistem penyemprot api dan regulator panas.[51]
Indium adalah salah satu dari banyak pengganti raksa dalam baterai alkaline untuk mencegah seng dari korosi dan melepaskan gas hidrogen.[68] Indium ditambahkan ke beberapa campuran amalgam gigi untuk mengurangi tegangan permukaan raksa dan memungkinkan amalgamasi yang lebih mudah dengan penghunaan raksa yang lebih sedikit.[69]
Penampang tangkapan neutron tinggi Indium untuk neutron termal membuatnya sesuai untuk digunakan dalam batang kendali pada reaktor nuklir, biasanya dalam paduan perak 80%, indium 15%, dan kadmium 5%.[70] Dalam teknik nuklir, reaksi (n,n') 113In digunakan untuk menentukan besarnya fluks neutron.[71]
Peran biologis dan tindakan pencegahan
Indium tidak memiliki peran metabolik dalam organisme apapun. Dengan cara yang sama seperti garam aluminium, ion indium(III) dapat menjadi racun bagi ginjal bila diberikan melalui suntikan.[72] Indium timah oksida dan indium fosfida membahayakan sistem pulmonari dan kekebalan tubuh, terutama melalui indium ionik,[73] meskipun hidrat oksida indium empat puluh kali lebih beracun saat disuntikkan, diukur melalui jumlah indium yang dimasukkan.[72] Indium-111 yang bersifat radioaktif (dalam jumlah sangat kecil menurut kimia) digunakan dalam uji kedokteran nuklir, sebagai pelacak radioaktif untuk mengikuti pergerakan protein berlabel dan sel darah putih di dalam tubuh.[74][75] Senyawa Indium sebagian besar tidak terserap jika tertelan dan terserap dengan tingkat sedang jika terhirup; mereka cenderung disimpan sementara di dalam otot, kulit, dan tulang sebelum diekskresikan. Waktu paruh biologis indium pada manusia adalah sekitar dua minggu.[76]
Orang bisa terkena indium di tempat kerja dengan cara terhirup, tertean, terkena kulit, dan terkena mata. National Institute for Occupational Safety and Health telah menetapkan batas paparan yang direkomendasikan (REL) 0,1 mg/m3 selama 8 jam kerja.[77]
Lihat juga
Referensi
Sumber
- Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 0-08-022057-6.
Pranala luar
- (Inggris) Indium at The Periodic Table of Videos (University of Nottingham)
- (Inggris) Reducing Agents > Indium low valent
- (Inggris) NIOSH Pocket Guide to Chemical Hazards (Centers for Disease Control and Prevention)

