代謝
代謝(たいしゃ、英: metabolism)とは、生物の生存と機能に不可欠な一連の化学反応である。代謝の主な機能は大きく3つあり、食物を細胞プロセスを実行するためのエネルギーに変換すること、食物をタンパク質、脂質、核酸および一部の炭水化物の合成に必要な構成成分に変換すること、そして代謝廃棄物を排出することである。酵素が触媒するこれらの反応によって生物は成長し、繁殖し、構造を維持し、環境に対応することができる。また、代謝という言葉は、消化、細胞内外・細胞間の物質輸送など、生体内で起こるすべての化学反応の全体を指すこともある。この文脈において、上記のような細胞内で起こる一連の反応を中間代謝(英: intermediary metabolism)と呼ぶ。
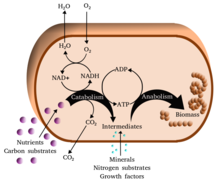

代謝反応は、化合物の分解を伴う異化作用(例:細胞呼吸によるグルコースからピルビン酸への変換)と、化合物(タンパク質、糖質、脂質、核酸など)の合成を伴う同化作用(生合成ともいう)に大別される。一般に、異化作用はエネルギーを放出し、同化作用はエネルギーを消費する。
代謝経路は、ある化学物質が別の化学物質に変換される一連の化学反応で、それぞれの段階は特定の酵素によって促進される。酵素は、エネルギーを必要とし、自然には起こらない望ましい反応を、エネルギーを放出する自発的な反応と結びつけることで、生物が推進することを可能にするため、極めて重要な役割を担っている。酵素は触媒として働き、反応速度を速めるとともに、細胞の環境の変化や他の細胞からのシグナルに応答するなど、代謝反応を調節することができる。
どの物質が栄養になり、どの物質が毒になるかは、その生物に固有の代謝系によって決まる。たとえば、ある種の原核生物は硫化水素を栄養とすることができるが、このガスは動物にとっては有毒なものである[1]。生物の基礎代謝率は、こうしたすべての化学反応によって消費されるエネルギー量の尺度である。
さまざまな生物種において、基本的な代謝経路が驚くほど類似していることは、代謝の顕著な特徴である[2]。たとえば、クエン酸回路の中間体としてよく知られている一連のカルボン酸は、知られているすべての生物に存在し、単細胞の大腸菌(Escherichia coli)からゾウのような巨大な多細胞生物にいたるまで見い出されている[3]。このような代謝経路の類似性は、生命の歴史の中で早くから出現し、その有効性によって持続しているためと考えられる[4][5]。II型糖尿病、メタボリックシンドローム、がんなどの特定の疾患では、正常な代謝が乱されている[6]。がん細胞の代謝も正常細胞の代謝とは異なっており、この違いを利用して、がんに対する治療介入の標的を特定できる可能性がある[7]。
主な生化学物質

動物、植物、微生物の構成要素は、主にアミノ酸、炭水化物、核酸、脂質(しばしば脂肪と呼ばれる)という4種類の基本的な分子から作られている。これらの分子は生命維持に不可欠であるため、代謝反応は、細胞や組織を形成するためにそれらを合成するか、消化によって分解してエネルギーとして利用することに集中している。また、これらの生化学物質が結合して、デオキシリボ核酸(DNA)やタンパク質など、生命維持に不可欠な高分子を形成する[8]。
| 分子の種類 | モノマー型の名称 | ポリマー型の名称 | ポリマー型の例 |
|---|---|---|---|
| アミノ酸 | アミノ酸 | タンパク質(ポリペプチドでできている) | 繊維状タンパク質、球状タンパク質 |
| 炭水化物 | 単糖 | 多糖 | デンプン、グリコーゲン、セルロース |
| 核酸 | ヌクレオチド | ポリヌクレオチド | デオキシリボ核酸(DNA)、リボ核酸(RNA) |
アミノ酸とタンパク質
タンパク質は、アミノ酸が直鎖状に配列し、ペプチド結合で結合したものである。多くのタンパク質は、代謝における化学反応の触媒となる酵素である。また、細胞の形状を維持する足場となる細胞骨格を形成するなど、構造的あるいは機械的な機能を持つタンパク質もある[9]。タンパク質は、細胞シグナル伝達、免疫応答、細胞接着、膜を介した能動輸送、および細胞周期の調節など、さまざまな重要な役割を担っている[10]。また、アミノ酸は、細胞のエネルギー代謝にも寄与しており、特にグルコースなどの主要なエネルギー源が不足したときや、細胞が代謝ストレスを受けたときに[11]、クエン酸回路(トリカルボン酸回路)[12]に炭素源を供給する役割もある。
脂質
脂質は、生化学物質の中でもっとも多様な一群である。その主な用途は、細胞膜のような内外の生体膜の一部として構造を作りだすほか、その化学エネルギーを利用することもできる[10]。多くの場合、非極性の長い炭化水素鎖と、小さな酸素を含む極性領域を持つ脂肪酸の重合体である[要出典]。一般的に脂質は、疎水性または両親媒性の生体分子と定義され、エタノール、ベンゼン、クロロホルムなどの有機溶媒に可溶である[13]。脂質は、脂肪酸とグリセロールを含む大きな化合物群で、グリセロール分子が3つの脂肪酸にエステル結合したものはトリアシルグリセリドと呼ばれる[14]。この基本構造にはいくつかの変種があり、スフィンゴミエリンはスフィンゴシンなどの骨格鎖が、リン脂質にはリン酸などの親水性基が存在する。また、ステロールなどのステロイド類も脂質の主要な分類の一つである[15]。
炭水化物

炭水化物(糖類とも呼ぶ)は、複数のヒドロキシ基(水酸基)が結合したアルデヒドまたはケトンからなる生体分子で、直鎖状または環状の形態を取ることがある。炭水化物はもっとも豊富に存在する生体分子であり、エネルギーの貯蔵や輸送や(デンプンやグリコーゲン)、構造部品としてなど(植物のセルロースや動物のキチン)、さまざまな役割を担っている[10]。炭水化物の基本的な構成単位は単糖と呼ばれ、ガラクトース、フルクトース、そしてもっとも重要なグルコースなどがある。単糖は互いに結合して多糖と呼ばれるより大きな炭水化物分子を形成することができ、その結合様式はほぼ無限に存在する[16]。
ヌクレオチド
デオキシリボ核酸(DNA)とリボ核酸(RNA)は共に核酸の一種で、いずれもヌクレオチドの重合体である。各ヌクレオチドは、糖基(リボースまたはデオキシリボース)に窒素塩基とリン酸基が結合したものである。核酸は、遺伝情報の保存や利用、および転写やタンパク質の生合成などの過程を通した解釈に大きな役割を果たしている[10]。これらの情報は、DNA修復機構によって保護され、DNA複製によって受け継がれる。HIVなどの多くのウイルスがRNAゲノムを持ち、逆転写を通じてそのRNAゲノムからDNA鋳型を生成している[17]。スプライセオソームやリボソームなどのリボザイム中のRNAは酵素としても働き、化学反応を触媒することができる。個々のヌクレオシドは、リボース糖に核酸塩基が結合して形成され、これらの塩基はプリンまたはピリミジンに分類される含窒素複素環である。また、ヌクレオチドは代謝基転移反応において補酵素としても働く[18]。
補酵素

代謝は膨大な数の化学反応から構成されているが、そのほとんどは、分子内の官能基や原子間の結合の移動させるという、いくつかの基本的な種類の反応に分類される[19]。この共通の化学的反応により、細胞は少数の代謝中間体の集まりを使って、異なる反応間で化学基を移動させることができる[18]。これらの基転移中間体は補酵素と呼ばれる。基転移反応はそれぞれの種類ごとに特定の補酵素によって行われ、補酵素は、それを生成する一連の酵素の基質となるとともに、それを消費する一連の酵素の基質となる。このように、補酵素は絶えず生産、消費、そして再利用されている[20]。
アデノシン三リン酸(ATP)は中心的な補酵素で、細胞の普遍的なエネルギー通貨として機能する。このヌクレオチドは、異なる化学反応間で化学エネルギーを伝達するために使用される。細胞内に存在するATPは微量であるが、常に再生されているため、人体は1日に自分の体重と同程度のATPを使うことができる[20]。ATPは異化作用と同化作用の橋渡しをする。異化作用は分子を分解し、同化作用は分子を再構築する。異化反応でATPが生産され、同化反応ではATPが消費される。さらに、ATPはリン酸化反応におけるリン酸基の担体としても機能する[21]。
ビタミンは、微量で必須とされる有機化合物で、細胞内では作ることができない。ヒトの栄養では、ほとんどのビタミンは修飾された後、補酵素として作用する。たとえば、水溶性ビタミンはすべて、細胞内で使用される際にリン酸化されるかヌクレオチドに結合する[22]。ビタミンB3(ナイアシン)の誘導体であるニコチンアミドアデニンジヌクレオチド(NAD+)は、水素受容体として機能する重要な補酵素である。数百種類のデヒドロゲナーゼ(脱水素酵素)が基質から電子を奪い、NAD+をNADHに還元する。この還元型補酵素は、水素原子を基質へ移動する必要のある細胞内の還元酵素の基質となる[23]。ニコチンアミドアデニンジヌクレオチドは、細胞内でNADHとNADPHという2つの関連した形態で存在し、NAD+/NADHは異化反応でより重要であり、NADP+/NADPHは同化反応で使用される[24]。

ミネラルと補因子
代謝はさまざまな無機元素に大きく依存しており、ナトリウムやカリウムのように豊富に含まれるものもあれば、少量で機能するものもある。ヒトの体重の約99%は、炭素、窒素、カルシウム、ナトリウム、塩素、カリウム、水素、リン、酸素、硫黄などの元素で構成されている。これらの元素のうち、炭素と窒素の大部分は有機化合物(タンパク質、脂質、炭水化物)に含まれており、酸素と水素の大部分は水として存在する[25]。
豊富な無機元素は電解質としてイオンとなり、さまざまな身体機能を維持するために機能している。もっとも重要なイオンには、ナトリウム、カリウム、カルシウム、マグネシウム、塩化物、リン酸塩、および有機イオンである重炭酸塩が含まれる。細胞膜を隔てたイオン勾配を正確に維持することにより、浸透圧とpHが保たれる[26]。神経や筋肉の活動電位は、細胞外液と細胞内液の電解質交換によって生じるため、イオンはこれらの組織の機能にも重要である[27]。電解質は、細胞膜に存在するイオンチャネルというタンパク質を通じて細胞に出入りする。たとえば、筋肉の収縮は、細胞膜や横行小管(T細管)にあるイオンチャネルを介したカルシウム、ナトリウム、カリウムの移動に依存している[28]。
遷移金属は通常、生体内に微量元素として存在し、亜鉛と鉄がもっとも多く含まれている[29]。これらの金属は、タンパク質上の特定の部位に強固に結合し、金属補因子として機能する。酵素補因子は、酵素の触媒作用の役割を果たし、触媒作用中に一時的に変化することはあっても、その後は必ず元の状態に戻る。生物は、特定の輸送担体(トランスポーター)を通じて金属微量栄養素を生体内に取り込む。これらの栄養素は、使用しないときにはフェリチンやメタロチオネインなどの貯蔵タンパク質に結合している[30][31]。
異化
異化作用は、大きな分子を分解する一連の代謝過程である。これらの過程には、食物分子の分解と酸化が含まれる。異化反応の主な目的は、分子を構築する同化反応に必要なエネルギーと成分を供給することである[32]。具体的な異化反応は生物によって異なり、生物はそのエネルギー、水素、および炭素(主要栄養群)の供給源によって下表のように分類することができる。有機栄養生物は、水素原子や電子の供給源として有機分子を利用し、無機栄養生物は無機基質を利用する。光栄養生物は太陽光を化学エネルギーに変換し[33]、化学栄養生物は有機分子、水素、硫化水素、鉄イオン (en:英語版) などの還元型供与体分子から酸素、硝酸塩、硫酸塩に電子を移動させる酸化還元反応に依存する。動物では、この反応によって複雑な有機分子が分解され、二酸化炭素や水などの単純な分子になる。植物やシアノバクテリアなどの光合成生物も、同様の電子移動反応によって、太陽光から吸収したエネルギーを蓄積している[34]。
| エネルギー源 | 太陽光 | 光- | -栄養生物 | ||
| 分子 | 化学- | ||||
| 水素または電子供与体 | 有機化合物 | 有機- | |||
| 有機化合物 | 無機- | ||||
| 炭素源 | 有機化合物 | 従属- | |||
| 無機化合物 | 独立- | ||||
動物でもっとも多く見られる一連の異化反応は、大きく3つの段階に分けることができる。第一段階では、タンパク質、多糖、脂質などの大きな有機分子を細胞外で消化し、より小さな成分に分解する。次に、これらの小分子は細胞に取り込まれ、さらに小さな分子、典型的にはアセチル補酵素A(アセチルCoA)に変換され、若干のエネルギーを放出する。最終段階では、アセチルCoA上のアセチル基がクエン酸回路と電子伝達系で水と二酸化炭素に酸化され、補酵素のニコチンアミドアデニンジヌクレオチド(NAD+)をNADHに還元しながら、より多くのエネルギーを放出する[32]。
消化
細胞は高分子を直接処理することができないため、タンパク質や多糖などの高分子は、細胞の代謝に利用される前に、より小さな単位に分解されなければならない。高分子の消化には、さまざまな種類の酵素が使用される。これらの消化酵素には、タンパク質をアミノ酸に分解するプロテアーゼや、多糖を単糖に分解するグリコシドヒドラーゼ(糖質加水分解酵素)がある[36]。
微生物は単純に消化酵素を周囲に分泌するのに対し[37][38]、動物は胃や膵臓などの消化管や唾液腺にある特殊な細胞から消化酵素を分泌する[39]。これらの細胞外酵素は、タンパク質をアミノ酸に、多糖を単糖に分解し、能動輸送タンパク質によって細胞内に輸送される[40][41]。

有機化合物からのエネルギー
炭水化物は、炭水化物異化作用と呼ばれる過程を経て、より小さな単位に分解される。炭水化物は通常、単糖に消化された後、細胞内に取り込まれる[42]。細胞内では、主に解糖という分解経路で分解され、グルコースやフルクトースなどの糖類がピルビン酸に変換され、若干のATPが生産される[43]。ピルビン酸はその後、いくつかの代謝経路で中間体として利用されるが、もっとも一般的には好気性(酸素を伴う)解糖によってアセチルCoAに変換され、クエン酸回路に入る。クエン酸回路でも若干のATPが作られるが、主な生成物はアセチルCoAが酸化されるときにNAD+から作られるNADHで、老廃物として二酸化炭素が放出される。嫌気性条件下では、代わりに解糖によって乳酸が生成し、乳酸デヒドロゲナーゼ(乳酸脱水素酵素)がNADHをNAD+に再酸化し、解糖で再利用される[44]。グルコース分解のもう一つの代替経路はペントースリン酸経路で、補酵素NADPHを還元して、核酸の糖成分であるリボースなどのペントース糖を生成する[要出典]。
脂肪は、加水分解により遊離脂肪酸とグリセロールに異化される。グリセロールは解糖に入り、脂肪酸はβ酸化によって分解されてアセチルCoAを生成し、クエン酸回路に送られる。脂肪酸は炭水化物よりも酸化されたときに多くのエネルギーを放出する。一部の細菌では、β酸化と同様の過程でステロイドを分解し、この分解過程でアセチルCoA、プロピオニルCoA、およびピルビン酸が大量に放出され、これらはすべて細胞内でエネルギーとして利用できる。結核菌(Mycobacterium tuberculosis)は、脂質であるコレステロールを唯一の炭素源として増殖することができ、コレステロールの利用経路に関わる遺伝子は、結核菌の感染ライフサイクルのさまざまな段階において重要であることが分かっている[45]。
アミノ酸は、タンパク質やその他の生体分子の合成に使われたり、エネルギーを作り出すために酸化されて尿素と二酸化炭素になる[46]。酸化経路では、まずアミノ基転移酵素(トランスアミナーゼ)によりアミノ基が除去される。その後、アミノ基は尿素回路に送られ、脱アミノ化された炭素骨格がケト酸の形で残される。これらのケト酸の中には、グルタミン酸の脱アミノ化によって生成するα-ケトグルタル酸のように、クエン酸回路の中間体となるものもある[47]。さらに、糖原性アミノ酸は、糖新生によってグルコースに変換されることもある(後述)[48]。
エネルギー転換
酸化的リン酸化
酸化的リン酸化は、クエン酸回路に見られるように、有機分子から奪った電子を酸素に移動し、放出されたエネルギーでATPを作る。真核生物では、ミトコンドリアの膜にある電子伝達系と呼ばれる一連のタンパク質がこれを行っている。一方、原核生物では、これらのタンパク質は細胞の内膜に存在する[49]。これらのタンパク質は、NADHなどの還元分子からのエネルギーを使って、膜を超えてプロトン(陽子)を送り出す[50]。

プロトンを送り出すことによって、ミトコンドリア膜を隔てたプロトン濃度差が生じ、電気化学的な勾配が生じる[51]。この勾配が動力となって、プロトンはATP合成酵素と呼ばれる酵素の基部を経由してミトコンドリア内に戻される。プロトンの流入によってATP合成酵素の軸サブユニットが回転し、酵素ドメイン活性部位の形が変化し、これによってアデノシン二リン酸がリン酸化され、ATPへ変換される[20]。
無機化合物からのエネルギー
化学無機栄養とは、原核生物に見られる代謝の一種で、無機化合物の酸化によってエネルギーを得るものである。これらの生物は、水素[52]、還元硫黄化合物(硫化物、硫化水素、チオ硫酸など)[1]、二価鉄イオン(Fe(II))[53]、またはアンモニア[54]を還元力源として利用し、これらの化合物を酸化することでエネルギーを得ている[55]。これらの微生物過程は、酢酸生成、硝化、脱窒などの地球規模での生物地球化学的循環において重要な役割を担い、土壌の肥沃度を維持するのに不可欠である[56][57]。
光からのエネルギー
植物、シアノバクテリア、紅色細菌、緑色硫黄細菌、および一部の原生生物では、太陽光からエネルギーを取り込むことができる。この過程は、後述する光合成の一部として、二酸化炭素を有機化合物に変換することにしばしば関連する。しかし、原核生物では、エネルギー捕捉系と炭素固定系を別々に働かせることもある。紅色細菌や緑色硫黄細菌は、太陽光をエネルギー源として利用するのと同時に、炭素固定と有機化合物の発酵を交互に行うことができる[58][59]。
さまざまな生物において、太陽エネルギーの捕獲は、プロトン濃度勾配という形でエネルギーを蓄積するという点で、上述の酸化的リン酸化と類似している。このプロトン起電力がATP合成の動力源となる[60]。この電子伝達系を駆動するのに必要な電子は、光合成反応中心 (en:英語版) と呼ばれる光捕集タンパク質から供給される。この反応中心は、光合成色素 (en:英語版) の性質によって2種類に分類され、光合成細菌の多くは1種類しか持たないが、植物やシアノバクテリアは2種類とも持っている[61]。
植物、藻類、シアノバクテリアなどの光合成生物では、光化学系II (en:英語版) が光エネルギーを利用して水から電子を奪って、老廃物として酸素を放出する。この電子はシトクロムb6f複合体に渡され、そのエネルギーを使って葉緑体内のチラコイド膜を超えてプロトンを送り出す[34]。このプロトンが、再び膜を通過して戻ってくることで、先と同様にATP合成酵素を駆動する。電子は光化学系Iを通り、補酵素NADP+を還元するために使われる[62]。この補酵素は、後述するカルビン回路に入るか、さらなるATP生成のために再利用される[要出典]。
同化
同化作用とは、異化作用によって放出されたエネルギーを使って、複雑な分子を合成する一連の建設的な代謝過程のことである。一般に、細胞構造を構成する複雑な分子は、より小さくて単純な前駆体が組み合わさって、段階的に構築される。同化作用は3つの基本的な段階からなる。第一に、アミノ酸、単糖、イソプレノイド、ヌクレオチドなどの前駆体の生成、第二に、これらの前駆体をATPからのエネルギーを使って反応型に活性化、第三に、これらの前駆体をタンパク質、多糖、脂質、核酸などの複合分子へ組み立てることである[63]。
生物の同化作用は、細胞内で作られる分子の供給源によって分類される。植物のような独立栄養生物は、二酸化炭素や水という単純な分子から多糖やタンパク質など、複雑な有機分子を細胞内で作ることができる。一方、従属栄養生物は、これらの複雑な分子を作るために、単糖やアミノ酸など、より複雑な化合物の供給源を必要とする。さらに、生物は最終的なエネルギー源によって分類される。光独立栄養生物と光従属栄養生物は光からエネルギーを得ており、化学独立栄養生物と化学従属栄養生物は酸化反応からエネルギーを得ている[63]。
炭素固定

光合成は、太陽光と二酸化炭素(CO2)から炭水化物を合成することである。植物、シアノバクテリア、藻類などでは、酸素光合成によって水を分解し、老廃物として酸素を放出する。このとき、前述の光合成反応中心で作られたATPとNADPHのエネルギーを利用して、CO2を3-ホスホグリセリン酸に変換し、さらにグルコースに変換することができる。この炭素固定反応は、カルビン-ベンソン回路の一部として、RuBisCOという酵素によって行われる[64]。植物では3種類で光合成が行われており、C3型光合成、C4型光合成、CAM型光合成である。これらは、CO2がカルビン回路に送られる経路が異なり、C3型はCO2を直接固定するのに対し、C4型とCAM型光合成はまずCO2を他の化合物に取り込むことで、強い日射しや乾燥した環境に適応する[65]。
光合成原核生物では、より多様な炭素固定化の機構を持っている。これらの生物は、カルビン-ベンソン回路、逆クエン酸回路[66]、またはアセチルCoAのカルボキシル化により炭素を固定できる[67][68]。また、原核生物の化学合成独立栄養生物では、カルビン-ベンソン回路によってCO2を固定しつつ、無機化合物からのエネルギーで反応を駆動するものもある[69]。
炭水化物と糖鎖
炭水化物の同化作用では、単純な有機酸をグルコースなどの単糖分子に変換し、さらにデンプンなどの多糖を作る場合がある。ピルビン酸、乳酸、グリセロール、3-ホスホグリセリン酸、アミノ酸などの化合物からグルコースを生成することを糖新生という。糖新生は、ピルビン酸が一連の中間体を経てグルコース-6-リン酸に変換するが、その多くは解糖と共通である[43]。しかし、この経路は単に解糖を逆にしたものではなく、いくつかの段階は非解糖系の酵素によって触媒されるという点に注意を要する。このことは、グルコースの生成と分解を別々に調節することができ、両方の経路が同時に進行する無益回路を防ぐことができる[70][71]。
脂肪は一般的なエネルギー貯蔵形態であるが、ヒトなどの脊椎動物はアセチルCoAをピルビン酸に変換する酵素機構を持たないため、貯蔵された脂肪酸を糖新生によってグルコースに変換することができない(植物には必要な酵素機構があるが、動物にはない)[72]。そのため、脊椎動物は長期間の飢餓状態に陥ると、脂肪酸をエネルギー源として代謝できない脳などの組織で、グルコースの代わりに脂肪酸からケトン体を生成してエネルギーを供給しなければならない[73]。一方、植物や細菌など他の生物では、グリオキシル酸回路という代謝経路を持ち、クエン酸回路の脱炭酸段階を迂回してアセチルCoAをオキサロ酢酸に変換し、そこからグルコースを生成することで解決している[72][74]。グルコースは、脂肪と異なり、通常は血液中のグルコース濃度を維持していた糖新生を通じて組織内で利用可能なエネルギー源として、ほとんどの組織に貯蔵される[75]。
多糖や糖鎖(グリカンともいう)は、グリコシルトランスフェラーゼ(糖転移酵素)という酵素によって、ウリジン二リン酸グルコース(UDP-Glc)のような反応性の糖-リン酸供与体から単糖が逐次、成長する多糖上の糖受容体性のヒドロキシ基に付加されることによって形成される。基質の環上のヒドロキシ基はいずれも糖受容体となりうるため、生成する多糖は直鎖でも分岐した構造でもよい[76]。生成した多糖は、それ自体が構造的あるいは代謝的な機能を果たすこともあれば、オリゴサッカリルトランスフェラーゼ(オリゴ糖転移酵素)と呼ばれる酵素によって、脂質やタンパク質に転位されることもある[77][78]。
脂肪酸, イソプレノイド, ステロール

脂肪酸は、脂肪酸合成酵素によるアセチルCoA単位の重合と、その後に還元することで作られる。脂肪酸のアシル鎖は、アシル基の付加、アルコールへの還元、アルケン基への脱水、さらにアルカン基への再還元という一連の反応によって伸長される。脂肪酸生合成の酵素は大きく2種類に分けられ、動物や菌類では、これらの脂肪酸合成酵素の反応のすべてを単一の多機能なI型タンパク質が担っているのに対し[79]、植物のプラスチド(色素体)や細菌では、経路の各段階を別々のII型酵素が担っている[80][81]。
テルペンやイソプレノイドは、カロテノイドを含む脂質の大きな一群であり、植物由来の天然物の中で最大の分類を形成している[82]。これらの化合物は、反応性前駆体であるイソペンテニルピロリン酸やジメチルアリルピロリン酸から供与されたイソプレン単位の結合と修飾によって作られる[83]。これらの前駆体は、さまざまな方法で作られる。動物や古細菌では、アセチルCoAからメバロン酸経路で作られ[84]、植物や細菌では、ピルビン酸とグリセルアルデヒド3-リン酸を基質とする非メバロン酸経路で作られる[83][85]。これらの活性化イソプレン供与体を用いる重要な反応のひとつにステロール生合成がある。ここでは、イソプレン単位が結合してスクアレンとなり、さらに折り畳まれて一連の環を形成してラノステロールとなる(図を参照)[86]。ラノステロールはその後、コレステロールやエルゴステロールなど、他のステロールに変換される[86][87]。
タンパク質
生物によって、20種類のアミノ酸を合成する能力において違いがある。ほとんどの細菌や植物では20種類すべてを合成することができるが、哺乳類は11種類の非必須アミノ酸しか合成できないため、残る9種類の必須アミノ酸は食物から摂取しなければならない[10]。細菌の肺炎マイコプラズマ(Mycoplasma pneumoniae)のような単純な寄生生物は、アミノ酸合成ができないため、宿主から直接アミノ酸を摂取している[88]。すべてのアミノ酸は、解糖、クエン酸回路、またはペントースリン酸経路の中間体から合成される。窒素はグルタミン酸とグルタミンから供給される。非必須アミノ酸の合成は、適切なα-ケト酸の形成に依存しており、そのα-ケト酸がアミノ基転移によってアミノ酸を形成する[89]。
タンパク質は、アミノ酸がペプチド結合で直鎖状に結合してできている。さまざまなタンパク質は、固有のアミノ酸残基の並びがあり、その一次構造を決定している。アルファベットを組み合わせて無数の単語ができるのと同様に、アミノ酸をさまざまな配列で組み合わせると、膨大な数のタンパク質ができあがる。タンパク質の合成は、まずアミノ酸をエステル結合で転移RNA(トランスファーRNA)分子に結合させ、活性化することから始まる。これは、アミノアシルtRNA合成酵素によるATP依存的な反応によって行われる[90]。こうしてできたアミノアシルtRNAは、リボソーム酵素の基質となり、リボソームは、伝令RNA(メッセンジャーRNA)の配列情報を利用して、伸長するタンパク質鎖にアミノ酸を順次結合する[91]。
ヌクレオチドの合成とサルベージ
ヌクレオチドは、アミノ酸、二酸化炭素、そしてギ酸から合成されるが、その合成経路は大量の代謝エネルギーを必要とする[92]。そのため、ほとんどの生物は、合成前のヌクレオチドを回収する効率的なシステムを備えている[92][93]。プリン塩基は、リボースに塩基が結合したヌクレオシドとして合成される[94]。アデニンとグアニンはともに、アミノ酸のグリシン、グルタミン、アスパラギン酸の原子と、補酵素のテトラヒドロ葉酸から転移したギ酸を用いて合成される前駆体ヌクレオシドのイノシン一リン酸から作られる。一方、ピリミジン塩基は、グルタミンとアスパラギン酸から作られるオロト酸から合成される[95]。
生体異物と酸化還元代謝
すべての生物は、食物として利用できない化合物や、代謝機能を持たないために細胞内に蓄積されると有害となる化合物に常にさらされている。これらの有害となりうる化合物は、生体異物(ゼノバイオティクス)と呼ばれる[96]。合成薬、自然毒、抗生物質などの生体異物は、一連の生体異物代謝酵素によって解毒される。ヒトでは、シトクロムP450オキシダーゼ(酸化酵素)[97]、UDP-グルクロン酸転移酵素[98]、グルタチオン-S-トランスフェラーゼ(転移酵素)[99]がこれに該当する。この酵素のシステムは3段階で作用し、まず生体異物を酸化し(第1段階)、次に分子上に水溶性基を結合させる(第2段階)。最後に、水溶性に変化した生体異物は細胞外に排出され、多細胞生物ではさらに代謝されてから排出されることもある(第3段階)。生態系では、これらの反応は、汚染物質の微生物による生分解や、汚染土壌や流出油のバイオレメディエーション(生物学的環境修復)において特に重要である[100]。これらの微生物反応の多くは多細胞生物と共通であるが、微生物の種類は驚くほど多様であるため、多細胞生物よりもはるかに幅広い種類の生体異物に対処し、有機塩素化合物などの残留性有機汚染物質も分解することが可能である[101]。
好気性生物に密接に関連する問題として、酸化ストレスが知られている[102]。これは、酸化的リン酸化やタンパク質フォールディング時のジスルフィド結合形成などの過程で、過酸化水素などの活性酸素種が作られることで起こる[103]。これらの有害な酸化物質は、グルタチオンなどの抗酸化代謝物や、カタラーゼ、ペルオキシダーゼなどの酵素によって除去される[104][105]。
生命系の熱力学
熱力学の法則 (en:英語版) は生物にも適用され、熱と仕事の移動に関する原則に従わなければならない。熱力学の第二法則は、孤立した系 (en:英語版) ではエントロピー(無秩序)が減少することはない、というものである。生物は驚くほど複雑なので、この法則と矛盾しているように思えるが、すべての生物は周囲と物質やエネルギーを交換する開放系であり、それゆえ生存が可能である。生命系は平衡状態にあるのではなく、むしろ環境のエントロピーを増大させることによって高い複雑性を維持する散逸系である[106]。細胞の代謝では、自然発生的な異化作用と非自然発生的な同化作用の結合によって、これを実現している。熱力学 (en:英語版) の用語で言えば、代謝は無秩序を作り出すことによって秩序を維持しているのである[107]。
調節と制御
ほとんどの生物の環境は常に変化しているため、代謝反応を細かく制御して、細胞内を一定の状態に維持する必要がある。この状態を恒常性(ホメオスタシス)という[108][109]。また、代謝調節によって、生物がシグナルに応答し、環境と積極的に相互作用することを可能にする[110]。代謝経路がどのように制御されているかを理解するためには、密接に関連する2つの概念が重要である。第一に、経路内における酵素の調節(regulation)とは、シグナルに応じて酵素の活性をいかに増減させるかということである。第二に、酵素による制御(control)とは、こうした酵素活性の変化が経路全体の速度(経路を通る流束(フラックス))に及ぼす影響のことである[111]。たとえば、ある酵素が大きな活性変化を示しても(すなわち、高度に調節されている)、その活性の変化が代謝経路のフラックスにほとんど影響を及ぼさないのであれば、この酵素は経路の制御には関与していないことになる[112]。
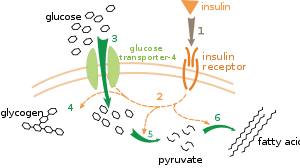
代謝調節は複数のレベルで行われる。内因性調節では、代謝経路は基質や生成物の量の変化に応じて自己調節する。たとえば、ある生成物の量が減少すると、それを補うために経路を通るフラックスを増加させることがある[111]。この種の調節には、経路内の複数の酵素の活性を調節するアロステリック調節がよく行われる[113]。一方、外因性調節は、多細胞生物において、ある細胞が別の細胞からのシグナルに応じて代謝を変化させるときに起こる。これらのシグナルは通常、ホルモンや成長因子などの水溶性メッセンジャーの形で、細胞表面にある特定の受容体によって検出される[114]。これらのシグナルは、しばしばタンパク質のリン酸化が関与するセカンドメッセンジャー系によって細胞内に伝達される[115]。
外因性制御の例として、インスリンというホルモンによるグルコース代謝の調節がよく知られている[116]。インスリンは、血糖値の上昇に反応して分泌される。インスリンが細胞上のインスリン受容体に結合すると、プロテインキナーゼのカスケードが活性化され、細胞にグルコースを吸収させ、脂肪酸やグリコーゲンといった貯蔵分子に変換させる[117]。グリコーゲンの代謝は、グリコーゲンを分解する酵素であるグリコーゲンホスホリラーゼと、グリコーゲンを合成する酵素であるグリコーゲンシンターゼの活性によって制御されている。これらの酵素は相互に調節され、リン酸化によってシンターゼは抑制されるが、ホスホリラーゼは活性化される。インスリンは、プロテインホスファターゼ(タンパク質脱リン酸化酵素)を活性化し、これらの酵素のリン酸化を低下させることにより、グリコーゲン合成を促進する[118]。
進化

解糖やクエン酸回路といった、上述の代謝の中心的経路は、生物の3つのドメイン (en:英語版) すべてに存在し、最後の普遍的共通祖先にも存在した[3][119]。この普遍的共通祖先は原核生物であり、おそらくアミノ酸、ヌクレオチド、炭水化物、および脂質の多様な代謝を行うメタン生成菌であったと考えられる[120][121]。このような古代の経路がその後の進化においても保持されたのは、解糖系やクエン酸回路などの経路が、最小限の段階で効率よく最終生成物を生成し、これらの反応が特定の代謝問題に対する最適解であった結果であると考えられる[4][5]。酵素に基づく代謝の最初の経路はプリンヌクレオチド代謝の一部であり、それ以前の代謝経路は古代のRNAワールドとつながっていた可能性がある[122]。
新しい代謝経路が進化する機構を説明するために、さまざまなモデルが提案されている。たとえば、小規模な祖先経路に新しい酵素が順次追加される方法、経路全体が複製しその後分岐する方法、そして既存の酵素が新しい反応経路に組み込まれる方法である[123]。これらの機構の相対的な重要性は不明であるが、ゲノム研究の結果、経路に含まれる酵素は共通の祖先を持つ可能性が高く、多くの経路が経路中の既存の段階から新たな機能を作り出し、段階的に進化してきたことが示唆されている[124]。第二のモデルとしては、代謝ネットワークにおけるタンパク質構造の進化を追跡する研究に基づくもので、酵素は広範囲に動員され、さまざまな代謝経路において同様の機能を果たすために酵素が借用されたことが示唆されている(MANETデータベースで明らか)[125]。このような動員過程は、進化的な酵素の集成を形成する[126]。第三の可能性は、代謝の一部が「基本単位(モジュール)」として存在し、異なる経路で再利用され、さまざまな分子に対して同様の機能を果たすというものである[127]。
新しい代謝経路の進化だけでなく、進化によって特定の代謝機能が失われることもある。たとえば、ある種の寄生生物では、生存に必須でない代謝過程が失われ、代わりに宿主からアミノ酸、ヌクレオチド、炭水化物などを搾取することがある[128]。同様の代謝機能の低下は、内部共生生物にも見られる[129]。
研究と操作

古典的に、代謝は、単一の代謝経路に焦点を当てた還元主義的なアプローチで研究される。とくに重要な方法は、生体全体、組織、細胞単体などさまざまなレベルでの放射性トレーサーの利用であり、放射性標識された中間体や生成物を同定することで、前駆体から最終産物までの経路を明確にする[130]。そして、これらの化学反応を触媒する酵素を精製し、その動態や阻害剤に対する反応を研究することができる。もう一つの方法は、細胞や組織に含まれる小分子を同定することで、これらの分子の完全な集合をメタボロームと呼ぶ。これらの方法では、単純な代謝経路の構造と機能についての洞察を与えてくれるが、細胞全体の代謝のような、より複雑な系を研究するには十分ではない[131]。
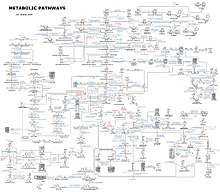
細胞内の代謝ネットワークは複雑で、数千種類の酵素が存在することもある。右上の図は、わずか43種類のタンパク質と40種類の代謝産物の相互関係を示したものである(ゲノム配列に基づき、最大26,500個の遺伝子を含む一覧が得られる)[132]。しかし、現在ではゲノムデータを用いて生化学反応の完全なネットワークを再構築し、その挙動を説明し予測できる、より包括的な数理モデルを開発することができるようになった[133]。これらのモデルは、経路や代謝産物データなどの古典的な手法によるデータと、プロテオミクスやDNAマイクロアレイ研究による遺伝子発現データを組み合わせた場合に、特に有効である[134]。これらの技術により、ヒトの代謝モデルが作成され、今後の創薬や生化学研究の指針になると期待される[135]。さらに、これらのモデルは、ヒトの病気を共通のタンパク質や代謝産物を持つグループに分類するためのネットワーク解析に利用されている[136][137]。
細菌の代謝ネットワークは、蝶ネクタイ型の組織構造の顕著な例を示し[138][139][140]、幅広い種類の栄養素を取り込み、少数の中間的な共通通貨分子を用いて、多様な生成物や複雑な高分子を作り出すことができる構造となっている。
代謝ネットワークに関する知識は、代謝工学の分野にも応用されている。この分野では、酵母、植物、細菌などの生物を、遺伝子工学的に改変して、バイオテクノロジーにおける有用性を高め、抗生物質などの医薬品や1,3-プロパンジオール、シキミ酸などの工業化学物質の生産を支援する[141][142][143]。これらの遺伝子組み換えは、通常、生産エネルギー消費の削減、製品収率の向上、廃棄物の発生を押さえることを目的として行われる[144]。
歴史
「metabolism(代謝)」という言葉は、フランス語の「métabolisme」または古代ギリシャ語の「μεταβολή」(metabolē)に由来し、「変化」を意味している。これは、「μεταβάλή」(metaballein)から派生したもので、「変化する」という意味である[145]。
ギリシャ哲学
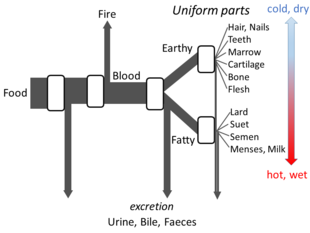
アリストテレスの『動物部分論(The Parts of Animals)』には、オープンフローモデルを構築するのに十分なほど、彼の代謝に関する考え方の詳細が書かれている。アリストテレスは、代謝の過程で食物からの物質が各段階に変換し、熱が古典的な火の要素として放出され、残留物が尿、胆汁、糞便として排泄されると考えた[146]。
イブン・アン=ナフィースは、西暦1260年の著作『Theologus Autodidactus』(預言者の伝記に関するカミルの論考)で、代謝について、『身体とその部分は共に、分解と栄養の絶えない状態にあり、それらは常に永久に変化している 』と述べている[147]。
科学的手法の応用と現代代謝理論
代謝の科学的研究には長い歴史があり、初期の動物全体を調べる研究から、現代の生化学における個々の代謝反応の研究へと、数世紀にもわたって発展してきた。ヒトの代謝に関する最初の対照実験は、1614年にサントーリオ・サントーリオが著書『Ars de statica medicina』の中で発表したものである[148]。彼は、食事、睡眠、仕事、セックス、絶食、飲酒、排泄の前後の体重を記録した。彼は、摂取した食物の大部分が、「不感蒸泄」と名付けた過程で失われることを発見した。

こうした初期の研究では、代謝過程の機構は解明されておらず、生体組織を活性化しているのは生命力という特別な力によると考えられていた[149]。しかし、19世紀、ルイ・パスツールは、酵母による糖のエタノール発酵の研究から、この過程は酵母細胞内の物質が触媒になっていることを突き止め、「発酵体(ferments)」と名付けた。彼は、『アルコール発酵は、細胞の死や腐敗ではなく、酵母細胞の生命や組織化の結果として起こる作用である。』と記した[150]。この発見は、1828年にフリードリヒ・ヴェーラーが発表した尿素を化学的に合成に関する論文とともに[151]、完全に無機的な前駆体から作られた最初の有機化合物として特筆に値する。これによって、細胞内の有機化合物や化学反応が、他の化学分野のものと原理的に変わりないことが証明された。
20世紀初頭、エドゥアルト・ブフナーによる酵素の発見により、代謝の化学反応の研究は、細胞の生物学的研究から切り離され、生化学の分野が確立された[152]。その後、ハンス・クレブスが尿素回路を発見し[153]、ハンス・コーンバーグと共同でクエン酸回路とグリオキシル酸回路を発見するなど[154][155][74]、近代的な生化学者の貢献によって、生化学の知識は急速に拡大した。現代の生化学研究は、クロマトグラフィー、X線回折、NMR分光法、放射性同位体標識、電子顕微鏡、分子動力学シミュレーションなどの新しい技術の利用により、細胞内の多数の分子や代謝経路の同定と詳細な解析が可能になった[要出典]。
参考項目
- 人為的な代謝 - 人間社会の物質とエネルギーの回転を表す産業における用語
- 代謝拮抗剤 - 代謝物の利用を阻害する化学物質
- 熱量測定法 - 化学および熱力学において物体の状態変数の変化を測定すること
- 等温マイクロカロリメトリー - 化学、物理、生物学的プロセスのリアルタイム監視と動的分析のための実験室的手法
- 先天性代謝異常 - 先天的に酵素活性に異常をきたす遺伝病の一種
- 鉄-硫黄ワールド仮説 - 生命の起源に関する「代謝優先」説
- 代謝異常 - タンパク質、脂肪、炭水化物などの主要栄養素の体内での下項および配分を有害に変化させる疾患
- マイクロ生理学 - 生命や生体物質の機能や活動、および非常に小規模な物理的および化学的現象のinvitro測定
- 一次栄養群 - 生命維持、成長、生殖に必要なエネルギーと炭素の供給源に応じた栄養様式に関連して分類された生物のグループ
- 呼吸測定 - 生物の代謝率を推定するための熱産生の間接的な測定手法(熱量測定法)
- 河川代謝 - 水生生態系内でエネルギーがどのように作成され、使用されるかを定量化する概念
- 硫黄代謝 - 生物による硫黄の還元、酸化の経路
- 食事誘発性熱産生 - 食品を使用および保管するための処理コストによる基礎代謝率を超えるエネルギー消費
- 都市代謝 - 都市内の物質とエネルギーの流れの記述と分析のためのモデル
- 水代謝 - 浸透圧調節と行動によって生体内の水分量を制御する必要がある生体の恒常性の側面
- オーバーフロー代謝 - 細胞が呼吸経路を使わずにグルコースなど成長基質を不完全に酸化すること
- 腫瘍代謝 -発癌および腫瘍状態への進行を伴う細胞で発生する代謝変化に着目した研究分野
- Reactome - 生物学的経路の無料のオンラインデータベース
- KEGG - ゲノム、生物経路、疾患、薬剤、化学物質などを扱うデータベースの集合体
出典
推薦文献
入門
- Rose S, Mileusnic R (1999). The Chemistry of Life.. Penguin Press Science. ISBN 0-14-027273-9
- Schneider EC, Sagan D (2005). Into the Cool: Energy Flow, Thermodynamics, and Life.. University of Chicago Press. ISBN 0-226-73936-8
- Lane N (2004). Oxygen: The Molecule that Made the World.. USA: Oxford University Press. ISBN 0-19-860783-0
高度
- 『ストライヤー生化学第8版』東京化学同人2018年8月28日
- Price N, Stevens L (1999). Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins.. Oxford University Press. ISBN 0-19-850229-X
- Berg J, Tymoczko J, Stryer L (2002). Biochemistry. W. H. Freeman and Company. ISBN 0-7167-4955-6
- Cox M, Nelson DL (2004). Lehninger Principles of Biochemistry.. Palgrave Macmillan. ISBN 0-7167-4339-6
- Brock TD, Madigan MR, Martinko J, Parker J (2002). Brock's Biology of Microorganisms.. Benjamin Cummings. ISBN 0-13-066271-2
- Da Silva JJ, Williams RJ (1991). The Biological Chemistry of the Elements: The Inorganic Chemistry of Life.. Clarendon Press. ISBN 0-19-855598-9
- Nicholls DG, Ferguson SJ (2002). Bioenergetics. Academic Press Inc.. ISBN 0-12-518121-3
- Wood HG (February 1991). “Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB Journal 5 (2): 156–63. doi:10.1096/fasebj.5.2.1900793. PMID 1900793.
外部リンク
一般事項
- The Biochemistry of Metabolism (archived 8 March 2005)
- Sparknotes SAT biochemistry Overview of biochemistry. School level.
- MIT Biology Hypertextbook Undergraduate-level guide to molecular biology.
ヒト代謝
- Topics in Medical Biochemistry Guide to human metabolic pathways. School level.
- THE Medical Biochemistry Page Comprehensive resource on human metabolism.
データベース
- Flow Chart of Metabolic Pathways at ExPASy
- IUBMB-Nicholson Metabolic Pathways Chart
- SuperCYP: Database for Drug-Cytochrome-Metabolism Archived 3 November 2011 at the Wayback Machine.
代謝経路
- Metabolism reference Pathway Archived 23 February 2009 at the Wayback Machine.
- The Nitrogen cycle and Nitrogen fixation at the Wayback Machine (archive index)



