デオキシリボ核酸
デオキシリボ核酸(デオキシリボかくさん、英: deoxyribonucleic acid、DNA[1])は、2本のポリヌクレオチド鎖が互いに巻きついて二重らせんを形成しているポリマーである。このポリマーは、すべての既知の生物と多くのウイルスの発生、機能、成長、および生殖のための遺伝的命令を伝達する。DNAはリボ核酸(英: ribonucleic acid、RNA)とともに核酸と総称される。核酸はタンパク質、脂質、複合多糖と並んで、すべての既知の生命体にとって不可欠な4大生体高分子のひとつである。

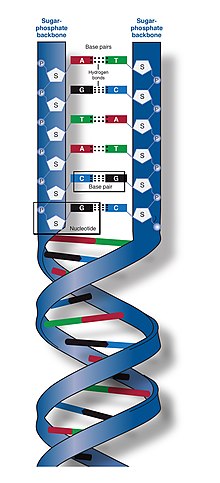
DNAの二本鎖は、ヌクレオチドと呼ばれるより単純な単量体単位から構成されていることから、ポリヌクレオチドと呼ばれる[2][3]。各ヌクレオチドは、4つの窒素含有核酸塩基(シトシン: C、グアニン: G、アデニン: A、チミン: T)のうちの1つ、デオキシリボースと呼ばれる糖、およびリン酸基で構成されている。あるヌクレオチドの糖と、次のヌクレオチドのリン酸が共有結合(ホスホジエステル結合と呼ばれる)によって鎖状に結合し、糖-リン酸が交互に繰り返される主鎖が形成される。二本のポリヌクレオチド鎖の窒素塩基は、塩基対合則(AとT、CとG)に従って水素結合で結合し、二本鎖DNAを形成する。窒素塩基は、単環のピリミジンと二重環のプリンという2つのグループに分類される。DNAでは、チミンとシトシンがピリミジン、アデニンとグアニンがプリンである。
二本鎖DNAの両鎖は同一の生物学的情報を保存している。この情報は2本の鎖が分離するときに複製される。DNAの大部分(ヒトでは98%以上)はノンコーディングであり、これらの部分はタンパク質配列のパターンとしては機能しない。DNAの2本の鎖は互いに反対方向に走っているため、逆平行になっている。それぞれの糖には4種類の核酸塩基(または塩基)のうちの1つが結合している。遺伝情報をコード(符号化)するのは、主鎖に沿ったこれら4種類の核酸塩基の配列である。RNA(リボ核酸)鎖はDNA鎖を鋳型として転写と呼ばれる過程で作られ、その際にDNA塩基は対応する塩基と交換されるが、チミン(T)の場合は例外で、RNAはウラシル(U)と交換する[4]。これらのRNA鎖は翻訳と呼ばれる過程で、遺伝暗号に基づいてタンパク質のアミノ酸配列を決定する。
真核細胞では、DNAは染色体と呼ばれる長い構造体に組織化されている。これらの染色体は、通常の細胞分裂の前にDNA複製過程で複製され、それぞれの娘細胞に完全な染色体の集合を提供する。真核生物(動物、植物、真菌類、原生生物)はDNAの大部分を核DNAとして細胞核内に保存し、一部をミトコンドリアDNAとしてミトコンドリア内、あるいは葉緑体DNAとして葉緑体内に保存している[5]。対照的に、原核生物(細菌と古細菌)はDNAを細胞質内の環状染色体にのみ保存している。真核生物の染色体内では、ヒストンなどのクロマチンタンパク質がDNAを小さくまとめて組織化している。これらの緻密な構造は、DNAと他のタンパク質との相互作用を導き、DNAのどの部分が転写されるかを制御するのに役立っている。
特性

DNAはヌクレオチドと呼ばれる反復単位からなる長いポリマーである[6][7]。DNAの構造はその長さに沿って動的であり、密なループを作ったり、他の形状に巻きつくことができる[8]。どの生物種においても、DNAは水素結合で結合した2本のらせん状の鎖で構成されている。両方の鎖とも、同じ軸にらせん状に巻かれ、ピッチも同じで34オングストローム (3.4 nm)である。一対の鎖の半径は10 Å (1.0 nm)である[9]。別の研究によると、別の溶液中で測定した場合、DNA鎖の幅は22–26 Å (2.2–2.6 nm)、1ヌクレオチド単位の長さは3.3 Å (0.33 nm)であった[10]。ほとんどのDNAの浮力密度は1.7 g/cm3である[11]。
通常、DNAは一本の鎖として存在するのではなく、一対の鎖がしっかりと結合して存在する[9][12]。この2本の長い鎖は互いに巻きついて二重らせんを形成している。ヌクレオチドには、DNA分子の主鎖の一部(鎖を構成する)と核酸塩基(らせん内部でもう一方のDNA鎖と相互作用する)の両方が含まれている。糖と結合した核酸塩基はヌクレオシド(英: nucleoside)と呼ばれ、これに対し糖と1つ以上のリン酸基と結合した塩基はヌクレオチド(英: nucleotide)と呼ばれる。(DNAのように)複数のヌクレオチドが結合した生体高分子をポリヌクレオチドと呼ぶ[13]。
DNA鎖の主鎖はリン酸基と糖基が交互に結合してできている[14]。DNAの糖は2-デオキシリボースで、ペントース(炭素数5、五炭糖)の一種である。糖と糖は、隣接する糖環の3位と5位の炭素原子間にホスホジエステル結合を形成するリン酸基によって結合している。これらの炭素はそれぞれ、3'末端(three prime end)、5'末端(five prime end)と呼ばれる。プライム記号(')は、デオキシリボースがグリコシド結合を形成する塩基の炭素原子と区別するために使われる[12]。
このようにDNA鎖には通常、リボースの5'炭素に結合したリン酸基(5'ホスホリル)を持つ末端と、リボースの3'炭素に結合した遊離ヒドロキシ基(3'ヒドロキシ)を持つ末端がある。糖-リン酸骨格に沿った3’と5'炭素の配向は、各DNA鎖に方向性(極性とも呼ばれる)を与える。核酸の二重らせんでは、一方の鎖のヌクレオチドの方向ともう一方の鎖のヌクレオチドの方向は反対で、逆平行になっている。DNA鎖の非対称末端については、5'末端方向と3'末端方向という方向性を有し、5'末端はリン酸基を有し、3'末端はヒドロキシ基を有すると呼ばれる。DNAとRNAの大きな違いの一つは糖で、DNAの2-デオキシリボースがRNAではペントース糖のリボースに置き換えられている[12]。
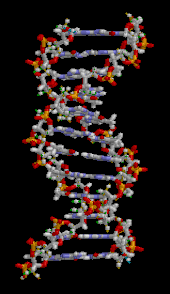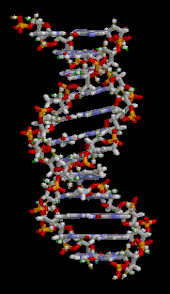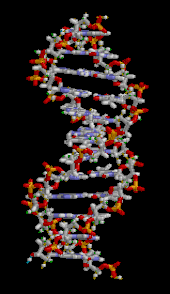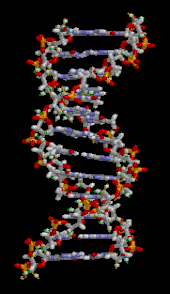
DNA二重らせんは、ヌクレオチド間の水素結合と、芳香族性核酸塩基間の塩基スタッキング相互作用という、主に2つの力によって安定化されている[16]。DNAに含まれる4つの塩基は、アデニン(A)、シトシン(C)、グアニン(G)、チミン(T)である。これらの4つの塩基は、アデノシン一リン酸で示したように、糖-リン酸に結合して完全なヌクレオチドを形成する。アデニンはチミンと対になり、グアニンはシトシンと対になり、それぞれ A-T と G-C の塩基対を形成する[17][18]。
核酸塩基の分類
核酸塩基は、5員および6員の縮合複素環式化合物であるプリン A と G と、6員環のピリミジン C と T の2種類に分類される[12]。第5のピリミジン核酸塩基であるウラシル(U)は通常、RNA内でチミンの代わりを担い、その環上にメチル基を持たない点でチミンと異なる。RNAとDNAに加えて、多くの人工核酸類似体が核酸の特性を研究するため、あるいはバイオテクノロジーで使用するために作成されてきた[19]。
非標準塩基
DNAには修飾塩基が存在する。このうち最初に認識されたのは5-メチルシトシンで、1925年に、結核菌(Mycobacterium tuberculosis)のゲノムから発見された[20]。細菌ウイルス(バクテリオファージ)にこうした非標準塩基(英: noncanonical base)が存在する理由は、細菌に存在する制限酵素を避けるためである。この酵素系は、少なくとも部分的には、細菌をウイルス感染から保護する分子免疫系として働く[21]。より一般的な修飾DNA塩基であるシトシンとアデニンの修飾は、動植物における遺伝子発現のエピジェネティック制御(後成的調整)において、重要な役割を果たしている[22]。
DNAには多くの非標準塩基が存在することが知られている[23]。これらのほとんどは、ウラシルを含む標準塩基(英: canonical base)が修飾されたものである。
- 修飾アデニン
- N6-カルバモイル-メチルアデニン
- N6-メチルアデニン
- 修飾グアニン
- 7-デアザグアニン
- 7-メチルグアニン
- 修飾シトシン
- N4-メチルシトシン
- 5-カルボキシルシトシン
- 5-ホルミルシトシン
- 5-グリコシルヒドロキシメチルシトシン
- 5-ヒドロキシシトシン
- 5-メチルシトシン
- 修飾チミジン
- α-グルタミルチミジン
- α-プトレシニルチミン
- ウラシルおよび修飾物
- 塩基J
- ウラシル
- 5-ジヒドロキシペンタウラシル
- 5-ヒドロキシメチルデオキシウラシル
- その他
- デオキシアルケオシン
- 2,6-ジアミノプリン(2-アミノアデニン)
主溝と副溝

二本のらせん鎖がDNAの主鎖を形成している。もう一つの二重らせんが、その鎖と鎖の間にある空隙、あるいは溝をたどって見いだされる。これらの空隙は塩基対に隣接しており、結合部位となる可能性がある。鎖は互いに対称に配置されていないため、溝の大きさは不均等である。主溝(しゅこう)の幅は22オングストローム (2.2 nm)で、副溝(ふくこう)の幅は12 Å (1.2 nm)である[24]。主溝の方が幅が広いため、塩基の端は副溝よりも主溝の方が近づきやすい。その結果、二本鎖DNAの特異的配列に結合できる転写因子などのタンパク質は、通常、主溝に露出した塩基の側面に接触する傾向がある[25]。このような状況は細胞内のDNAの異常なコンホメーション(立体配座)によって異なるが、主溝と副溝はDNAを通常のB型に巻き戻した場合に見られる幅の違いを反映するよう常に命名されている。
塩基対合
DNAの二重らせんでは、一方の鎖上にあるそれぞれの核酸塩基が、もう一方の鎖上のただ一種類の核酸塩基と結合する。これは相補的塩基対形成(英: complementary base pairing)と呼ばれる。プリンとピリミジンは対合して水素結合を形成し、アデニンとチミンは2本、シトシンとグアニンは3本の水素結合を形成する。このように、二重らせんを挟んで(6炭素環から6炭素環へ)2つのヌクレオチドが結合対を形成する配置は、ワトソン・クリック塩基対と呼ばれる。GC含量の高いDNAはGC含量の低いDNAよりも安定である。フーグスティーン塩基対(英: Hoogsteen base pair、6炭素環と5炭素環の水素結合)は、塩基対形成のまれな変種である[26]。共有結合と異なり、水素結合は比較的簡単に切断したり再結合したりすることができる。そのため二重らせんを構成するDNAの二本鎖は、機械的な力や高温によってファスナーのように引き離すことができる[27]。この塩基対の相補性の結果、DNAらせんの二本鎖配列のすべての情報がそれぞれの鎖に複製され、これはDNA複製に不可欠である。相補的な塩基対間のこの可逆的で特異的な相互作用は、生物におけるDNAのすべての機能にとって重要である[7]。
ssDNAとdsDNA
上述したように、ほとんどのDNA分子は実際には2本のポリマー鎖であり、非共有結合によってらせん状に結合している。この二本鎖DNA構造(英: double-stranded DNA、dsDNA)は、主に鎖内塩基スタッキング相互作用(G,Cスタックが最も強い)によって維持されている。この2本の鎖は、融解(melting)と呼ばれる過程を経て分離し、2本の一本鎖DNA分子(英: single-stranded DNA、ssDNA)を形成することがある。融解は、高温、低塩、高pHの条件下で起こる(低pHもDNAを融解させるが、DNAは酸-脱プリン化により不安定であるため、低pHはほとんど行われない)。
dsDNA型の安定性は、GC含有(G,C塩基対の割合)だけでなく、配列(スタッキングは配列特異的であるため)および長さ(分子が長いほど安定)にも依存する。安定性はさまざまな方法で測定できる。一般的な方法は融解温度(Tm値とも呼ばれる)であり、二本鎖分子の50%が一本鎖分子に変換される温度である。融解温度はDNAのイオン強度と濃度に依存する。したがって、GC塩基対の割合とDNA二重らせんの全長の両方が、DNAの二本鎖間の結合の強さを決定する。GC含量が高く長いDNAらせんは相互作用が強い鎖が多く、AT含量が高く短いDNAらせんは相互作用が弱い鎖が多い[28]。生物学では、DNA二重らせんのうち分離しやすい部分、たとえば一部のプロモーターに含まれる TATAAT プリブノー・ボックスなどは、鎖を引き離しやすくするためにAT含量が高くなる傾向がある[29]。
実験室では、水素結合の半分を切断するのに必要な融解温度Tmを求めることにより、この相互作用の強さを測定することができる。DNA二重らせん内の塩基対がすべて融解すると鎖は分離し、溶液中に完全に独立した2つの分子として存在する。これらの一本鎖DNA分子には単一の共通形状は存在しないが、いくつかのコンホメーションは他のものよりも安定している[30]。
含有量

ヒトの場合、細胞1個あたり、女性の二倍体核ゲノムの総長は6.37ギガ塩基対(Gbp)に及び、長さは208.23 cm、質量は6.51 pgである[31]。男性の値はそれぞれ、6.27 Gbp、205.00 cm、6.41 pgである[31]。各DNAポリマーは、1番染色体のように数億ものヌクレオチドを含むことがある。1番染色体は約2億2千万塩基対からなるヒト最大の染色体で、まっすぐに伸ばすと85 mmの長さになる[32]。
真核生物には、核DNAのほかにミトコンドリアDNA(mtDNA)もあり、ミトコンドリアで使われる特定のタンパク質をコードしている。mtDNAは通常、核DNAに比べて比較的小さい。たとえば、ヒトのミトコンドリアDNAは閉じた環状分子を形成し、それぞれの分子は16,569個[33][34]のDNA塩基対を含み[35]、そうした各分子には通常、ミトコンドリア遺伝子の完全な集合が含まれる。ヒトの各ミトコンドリアには、このようなmtDNA分子が平均して約5個含まれている[35]。各ヒト細胞は約100個のミトコンドリアを含むので、ヒト細胞あたりのmtDNA分子の総数は約500個となる[35]。ただし、細胞あたりのミトコンドリアの量も細胞の種類によって異なり、卵細胞には10万個のミトコンドリアが含まれることがあり、ミトコンドリアゲノム(細胞のDNAの最大90%を構成する)の最大150万コピーに相当する[36]。
センスとアンチセンス
あるDNA配列が、タンパク質に翻訳されるメッセンジャーRNAのコピーと同じである場合、「センス配列」(英: sense sequence)と呼ばれる[37]。反対側の鎖の配列は「アンチセンス配列」(英: antisense sequence)と呼ばれる。センス配列とアンチセンス配列は、同じDNA鎖の異なる部分に存在することがある(すなわち、両方の鎖がセンス配列とアンチセンス配列の両方を含む)。原核生物でも真核生物でもアンチセンスRNA配列が作られるが、これらのRNAの機能は完全には解明されていない[38]。一つの提案は、アンチセンスRNAがRNA-RNA塩基対形成を通じて遺伝子発現の調節に関与しているというものである[39]。
原核生物や真核生物のDNA配列、そしてプラスミドやウイルスではより多くのDNA配列が、オーバーラップ遺伝子(英: overlapping gene)を持つことによってセンス鎖とアンチセンス鎖の区別をあいまいにしている[40]。このような場合、DNA配列の中には、一方の鎖に沿って読まれると一方のタンパク質をコードし、もう一方の鎖に沿って逆方向に読まれるともう一方のタンパク質をコードするという、二重の役割を果たすものがある。細菌では、この重畳が遺伝子転写の調節に関与している可能性がある[41]。一方、ウイルスでは、オーバーラップ遺伝子によって、小さなウイルスゲノム内にコードできる情報量を増加させる[42]。
スーパーコイル
DNAは、DNAスーパーコイル(英: DNA supercoiling、DNA超らせん)と呼ばれる過程で、ロープのようにねじれることがある。DNAが「弛緩した」状態では、鎖は通常10.4塩基対ごとに二重らせんの軸の周りを一周するが、DNAがねじれると鎖はよりきつく、あるいはより緩く巻かれる[43]。DNAがらせんの方向にねじれている場合、これは正のスーパーコイルと呼ばれ、塩基同士はより近くに配置される。もし反対方向にねじれているなら、これは負のスーパーコイルと呼ばれ、塩基同士はより離れやすくなる。自然界では、ほとんどのDNAは、トポイソメラーゼと呼ばれる酵素によって導入される、わずかに負のスーパーコイルを持っている[44]。これらの酵素は、転写やDNA複製などの過程でDNA鎖に生じるねじれ応力を緩和するためにも必要である[45]。
代替DNA構造

DNAは、A-DNA(A型DNA)、B-DNA(B型DNA)、Z-DNA(Z型DNA)などの多くの起こりうるコンホメーションで存在するが、機能的な生物で直接観察されているのはB-DNAとZ-DNAに限られる[14]。DNAが取るコンホメーションは、水和レベル、DNA配列、スーパーコイルの量と方向、塩基の化学修飾、金属イオンの種類と濃度、溶液中のポリアミンの有無に依存する[46]。
A-DNA、およびB-DNAのX線回折パターンについて最初に発表された報告では、パターソン関数に基づく解析が使用され、DNAの配向繊維に限られた構造情報しか得られなかった[47][48]。1953年、ウィルキンスらによって、高水和DNA繊維の in vivo(生体内)B-DNA X線回折散乱パターンについて、ベッセル関数の2乗という観点から別の解析法が提案された[49]。同じジャーナルで、ジェームズ・ワトソンとフランシス・クリックが、DNAのX線回折パターンの分子モデリング解析を発表し、その構造が二重らせんであることを提案した[9]。
B-DNAは細胞内で見られる条件下で最もありふれているが[50]、これは明確に定義されたコンホメーションではなく、細胞内で見られる高水和レベルで生じる関連するDNAコンホメーションの一群である[51]。それらに対応するX線回折とX線散乱のパターンは、かなりの程度の無秩序を伴う分子準結晶に特徴的である[52][53]。
B-DNAと比較すると、A-DNAは浅く広い副溝と狭く深い主溝を持つ、より幅の広い右巻きらせんである。A型は、非生理学的条件下では、部分的に脱水したDNA試料中に生じるが、細胞内ではDNA鎖とRNA鎖の混成ペアリングや、酵素-DNA複合体に生じることがある[54][55]。塩基がメチル化で化学修飾されたDNAセグメントは、より大きなコンホメーション変化を起こし、Z-DNAを取ることがある。この場合、鎖はらせん軸を中心に左巻きのらせんを描き、より一般的なB型とは正反対となる[56]。このような特異な構造は、特異的なZ-DNA結合タンパク質によって認識され、転写制御に関与している可能性がある[57]。
代替DNA化学
宇宙生物学者たちは長年にわたり、現在知られている生命とは根本的に異なる生化学的および分子学的プロセスを用いる、地球上の微生物生物圏(影の生物圏)の存在を提案してきた。その提案の一つは、DNA中のリンの代わりにヒ素を使用する生命体の存在であった。2010年、GFAJ-1という細菌におけるその可能性が報告されたが[58][59]、この研究は論争を呼び[59][60]、細菌がDNA骨格や他の生体分子へのヒ素の取り込みを積極的に妨げていることを示唆する証拠が示された[61]。
四重鎖構造

線状染色体の末端には、テロメアと呼ばれる特殊なDNA領域がある。テロメアの主な役割は、通常DNAを複製する酵素は染色体の3'末端の端部をコピーできないため、細胞がテロメラーゼという酵素を使用して染色体末端を複製できるようにすることである[63]。これらの特殊な染色体キャップはDNA末端を保護し、細胞のDNA修復系がそれらを修正すべき損傷として扱うことを防ぐのにも役立つ[64]。ヒト細胞ではテロメアは通常、単純な TTAGGG 配列が数千回繰り返された一本鎖DNAである[65]。
これらのグアニンに富んだ配列は他のDNA分子に見られる通常の塩基対ではなく、4塩基単位が積み重なった構造を形成することによって染色体末端を安定化させる可能性がある。ここでは4つのグアニン塩基が、グアニンテトラッド(英: guanine tetrad)と呼ばれる平面を形成している。そして、これらの4塩基単位の平面が積み重なり、安定したグアニン四重鎖構造を形成する[66]。これらの構造は、塩基の端同士の水素結合と、各4塩基単位の中心にある金属イオンのキレート化によって安定化している[67]。他の構造を形成することも可能で、中央にある4塩基の集まりは、塩基の周囲に折りたたまれた単鎖か、それぞれが中央の構造に1塩基ずつ寄与するいくつかの異なる平行鎖のいずれかから形成される。
このような積層構造に加えて、テロメアはテロメアループ(Tループ)と呼ばれる大きなループ構造も形成する。ここでは、一本鎖DNAがテロメア結合タンパク質によって安定化された大きな円を描くように巻きついている[68]。Tループの最先端では一本鎖テロメアDNAがテロメア鎖によって二本鎖DNAの領域に保持され、二重らせんDNAを分離し、二本鎖の一方と塩基対を形成する。この三重鎖構造は、置換ループあるいはDループと呼ばれる[66]。
分岐DNA
DNAでは、相補的であるべき二本鎖DNAの末端部に相補的でない領域が存在すると「ほつれ」を生じる。しかし第三のDNA鎖が導入され、既存の二本鎖のほつれ領域と混成できる隣接領域を含む場合、分岐DNA(英: branched DNA)が生じる可能性がある。分岐DNAの最も単純な例は3本のDNA鎖のみであるが、さらなる鎖と複数の分岐を含む複合体も可能である[69]。分岐DNAは、幾何学的形状を構築するためにナノテクノロジーで使用することができる。以下の技術における用途の節も参照のこと。
人工塩基
いくつかの人工塩基が合成され、ハチモジDNA(英: Hachimoji DNA)と呼ばれる8塩基の核酸アナログに組み込むことに成功した。S、B、P、Zと命名されたこれらの人工塩基は、予測可能な方法で互いに結合し(S-BとP-Z)、DNAの二重らせん構造を維持し、RNAに転写することができる。これらの人工塩基の存在は、地球上で進化してきた4つの天然の核酸塩基には特別なものは何もないことを示すものと考えられる[70][71]。一方、DNAはRNAと密接な関係にあり、RNAはDNAの転写産物としてだけではなく、細胞内で多くの仕事をこなす分子機械でもある。そのためには、RNAは適切な構造に折り畳まれなければならない。すべての可能な立体構造を作るためには、対応するRNAに少なくとも4つの塩基が必要であることが示されている[72]。一方、それ以上の数も可能であるが、これは最小努力の自然原理に反することになる。
酸性度
DNAのリン酸基はリン酸と同様の酸性特性を与えることから、強酸とみなすことができる。DNAは、通常の細胞内pHでは完全にイオン化し、陽子を放出してリン酸基は負電荷を帯びる。これらの負電荷は、DNAを加水分解しうる求核物質をはねつけて、加水分解による分解からDNAを保護する[73]。

巨視的外観
細胞から抽出された純粋なDNAは、白い糸状の凝集塊を形成する[74]。
化学修飾とDNAパッケージングの変化
塩基修飾とDNAパッケージング
遺伝子の発現は、DNAが染色体の中でクロマチンと呼ばれる階層的な構造にどのようにパッケージングされているかに影響される。塩基修飾はパッケージングに関与する可能性があり、遺伝子発現が低いかまったくない領域は通常、シトシン塩基のメチル化が高レベルで見られる。DNAパッケージングとその遺伝子発現への影響は、クロマチン構造においてDNAが巻きついているヒストンタンパク質コアの共有結合修飾や、クロマチン・リモデリング複合体によるリモデリングでも起こりうる。さらに、DNAメチル化とヒストン修飾の間にはクロストークがあるため、クロマチンと遺伝子発現に協調的に影響を与える可能性がある[75]。
たとえば、シトシンのメチル化は5-メチルシトシンを生成し、これはX染色体の不活性化に重要である[76]。メチル化の平均レベルは生物によって異なり、カエノラブディティス・エレガンス(Caenorhabditis elegans)という線虫はシトシンのメチル化を欠くが、脊椎動物はメチル化のレベルが高く、DNAの最大1%が5-メチルシトシンを含む[77]。5-メチルシトシンは重要であるにもかかわらず、脱アミノ化してチミン塩基に変換されることがあるため、メチル化シトシンは特に変異を起こしやすい[78]。その他の塩基修飾としては、細菌におけるアデニンのメチル化、脳における5-ヒドロキシメチルシトシンの存在[79]、およびキネトプラスト類における塩基Jを生成するためのウラシルのグリコシル化などがある[80][81]。
損傷

DNAは、DNA配列を変化させるさまざまな種類の変異原によって損傷を受ける可能性がある。変異原には、酸化剤やアルキル化剤などの化学物質のほか、紫外線やX線などの高エネルギー電磁放射線も含まれる。どのようなDNA損傷が生じるかは変異原の種類によって異なる。たとえば、紫外線はピリミジン塩基間の架橋であるチミン二量体を生成することによって、DNAに損傷を与える可能性がある[83]。一方、フリーラジカルや過酸化水素のような酸化剤は、塩基修飾、特にグアノシンの修飾や、二本鎖切断など、さまざまな形の損傷を引き起こす[84]。典型的なヒト細胞には、酸化的損傷を受けた塩基が約15万個所ある[85]。これらの酸化的損傷のうち最も危険なのは修復が困難な二本鎖切断であり、点変異、DNA配列からの挿入や欠失、あるいは染色体転座を引き起こす可能性がある[86]。これらの変異は癌(がん)を引き起こす可能性がある。DNA修復機構には本質的な限界があるため、人間が長生きすれば、いずれは誰も癌を発症することになる[87][88]。活性酸素種や細胞水の加水分解活性などを産生する正常な細胞プロセスに起因する、自然発生的なDNA損傷も頻繁に起こる。これらの損傷の大部分は修復されるが、どの細胞においても、修復過程の作用にもかかわらず、DNA損傷の一部が残ることがある。これらの残存DNA損傷は、哺乳類の有糸分裂後組織において加齢とともに蓄積する。この蓄積は老化の重要な根本原因であると考えられている[89][90][91]。
変異原の多くは隣接する2つの塩基対の間に侵入し、これはインターカレーション(英: intercalation)と呼ばれる過程である。ほとんどのインターカレーター(侵入物質)は芳香族の平面分子であり、たとえば臭化エチジウム、アクリジン、ダウノルビシン、ドキソルビシンなどである。インターカレーターが塩基対の間に侵入するためには、塩基が離れなければならず、二重らせんがほどけることでDNA鎖に歪みが生じる。これは転写とDNA複製の両方を阻害し、毒性と変異を引き起こす[92]。その結果、DNAインターカレーターは発癌性を生じ、またサリドマイドの場合は催奇形性を生じる可能性がある[93]。また、ベンゾ[a]ピレンジオールエポキシドやアフラトキシンのように、DNA付加体を形成し、複製誤りを引き起こすものもある[94]。それにもかかわらず、DNAの転写や複製を阻害する能力があるため、他の類似毒素も、急速に増殖する癌細胞を阻害する化学療法に使用されている[95]。
生物学的機能

DNAは通常、真核生物では線状染色体として存在し、原核生物では環状染色体として存在する。細胞内の染色体の集合がゲノムを構成し、ヒトゲノムでは46本の染色体に約30億塩基対のDNAが配置されている[96]。DNAが伝達する情報は、遺伝子と呼ばれるDNA断片の配列に含まれている。遺伝子による遺伝情報の伝達すなわち遺伝は、相補的な塩基対形成によって達成される。たとえば、転写において細胞が遺伝子の情報を使用する際、DNAと正しいRNAヌクレオチドとの間に引力が作用することで、DNA配列が相補的なRNA配列に複製される。通常、翻訳と呼ばれる過程で、このRNAコピーは一致するタンパク質配列を作るために使用されるが、これもRNAヌクレオチド間の同様な相互作用に依存している。あるいは、細胞はDNA複製と呼ばれる過程で、その遺伝情報を複製することができる。これらの機能の詳細については他の記事で取り上げており、ここではゲノムの機能を仲介するDNAと他の分子との相互作用に焦点を当てる。
遺伝子とゲノム
ゲノムDNAは、DNA凝縮と呼ばれる過程を通じて、細胞の小さな体積に収まるようにきつく整然と詰め込まれている。真核生物の場合、DNAは細胞核に存在し、ミトコンドリアや葉緑体にも少量が存在する。原核生物では、DNAは核様体(ヌクレオイド)と呼ばれる細胞質内の不規則な形をした構造体に保持されている[97]。ゲノムの遺伝情報は遺伝子内に保持されており、生物におけるこの情報の完全な集合をその遺伝型(英: genotype)と呼ぶ。遺伝子は遺伝の単位であり、生物の特定の形質に影響を与えるDNAの領域である。遺伝子には、転写可能なオープンリーディングフレームと、オープンリーディングフレームの転写を制御するプロモーターやエンハンサーなどの制御配列が含まれている。
多くの生物種では、ゲノム配列全体のごく一部のみタンパク質をコードしている。たとえば、ヒトゲノムのうちタンパク質をコードするエクソンはわずか約1.5%しかなく、ヒトDNAの50%以上は非コード反復配列で構成されている[98]。真核生物のゲノムに非常に多くの非コードDNAが存在する理由と、ゲノムの大きさ(C値)が生物種によって著しく異なる理由は、「C値の謎」として知られる長年の難問である[99]。しかし、タンパク質をコードしないDNA配列の中には、遺伝子発現の調節に関与する機能的な非コードRNA分子をコードしているものもある[100]。

非コードDNA配列の中には染色体の構造的役割を果たすものがある。テロメアとセントロメアには通常、ほとんど遺伝子が存在しないが、染色体の機能と安定性にとって重要である[64][102]。ヒトに多く存在する非コードDNAは偽遺伝子であり、変異によって機能しなくなった遺伝子の複製である[103]。これらの配列は、遺伝子の重複や分岐の過程を通じて、新しい遺伝子を生み出すための遺伝物質の原料として役に立つこともあるが、通常は単なる分子の遺物である[104]。
転写と翻訳
遺伝子は遺伝情報を含むDNA配列で、生物の表現型に影響を与えることがある。遺伝子内では、DNA鎖に沿った塩基配列がメッセンジャーRNA配列を規定し、それが1つか複数のタンパク質配列を規定する。遺伝子のヌクレオチド配列とタンパク質のアミノ酸配列との関係は、遺伝暗号と総称される翻訳規則によって決定される。遺伝暗号は、コドン(codon)と呼ばれる3文字の「単語」からなり(例:ACT、CAG、TTT)、ヌクレオチドが3個連続した配列に基づいている。
転写の際、遺伝子のコドンがRNAポリメラーゼによってメッセンジャーRNAにコピーされる。次に、このRNAコピーはリボソームによって解読され、リボソームはメッセンジャーRNAをアミノ酸を運ぶトランスファーRNAに塩基対合させることによってRNA配列を読み取る。4種類の塩基を表す3文字が組み合わさって、64通りのコドンの可能性が存在する(43 通りの組み合わせ)。これらのコドンは20種類の標準アミノ酸をコードしており、ほとんどのアミノ酸は複数のコドンに対応付けられる。また、コード領域の終わりを示す3つの「終止コドン」(ナンセンスコドンとも呼ばれる)もある。これらは、TAG、TAA、TGAコドンである(mRNAではUAG、UAA、UGA)。

複製
細胞分裂は生物が成長するために不可欠であるが、細胞が分裂する際には、2つの娘細胞が親と同じ遺伝情報を持つように、ゲノム中のDNAを複製しなければならない。DNAの二本鎖構造はDNA複製の単純な機構を提供する。ここでは二本鎖が分離され、次にDNAポリメラーゼと呼ばれる酵素によってそれぞれの鎖の相補的DNA配列が再作成される。この酵素は、相補的塩基対の形成を通じて正しい塩基を見つけ、それを元の鎖に結合させることで相補鎖を作成する。DNAポリメラーゼはDNA鎖を5'から3'の方向にしか伸長できないため、二重らせんの逆平行鎖を複製するために異なる機構が使われる[105]。このようにして、古い鎖の塩基が新しい鎖の塩基を決定し、細胞はそのDNAの完全な複製を得ることができる。
細胞外核酸
裸の細胞外DNA(英: extracellular DNA、eDNA)は、そのほとんどが細胞死の際に放出されたもので、環境中にほぼ遍在している。土壌中の濃度は2 μg/Lと高く、自然の水性環境中では88 μg/Lに達することもある[106]。eDNAの働きとして、遺伝子の水平伝播への関与[107]、栄養素の供給[108]、あるいはイオンや抗生物質を取り込んだり用量を調整するための緩衝剤としての機能など、さまざまな可能性が提案されている[109]。eDNAは、いくつかの細菌種のバイオフィルムにおいて、機能的な細胞外マトリックス成分として機能する。eDNAの働きには、バイオフィルム内の特定の細胞型の付着と分散を制御する認識因子として働く可能性や[110]、バイオフィルム形成に寄与する可能性[111]、あるいはバイオフィルムの物理的強度と生物学的ストレスに対する抵抗性に寄与する可能性がある[112]。
無細胞胎児DNAは母体の血液中に存在し、その塩基配列を決定することで発達中の胎児に関する多くの情報を得ることができる[113]。
環境DNAとして知られるeDNAは、水中、大気中、陸上における生物種の動きと存在を監視し、その地域の生物多様性を評価する生態学の調査ツールとして、自然科学の分野で利用が拡大している[114][115]。
好中球細胞外トラップ
好中球細胞外トラップ(英: neutrophil extracellular trap、NET)は、主にDNAから構成される細胞外繊維のネットワークであり、白血球の一種である好中球が宿主細胞への損傷を最小限に抑えながら細胞外の病原体を殺滅することを可能にする。
タンパク質との相互作用
DNAの機能はすべてタンパク質との相互作用に依存している。これらのタンパク質相互作用は非特異的であることもあれば、タンパク質が単一のDNA配列に特異的に結合することもある。酵素もDNAに結合することができ、その中でも特に重要なものは、転写とDNA複製の際にDNA塩基配列をコピーするポリメラーゼである。
DNA結合タンパク質

DNAと結合する構造タンパク質は、非特異的DNA-タンパク質相互作用の例としてよく理解されている。染色体内でDNAは構造タンパク質と複合体を形成して保持されている。これらのタンパク質はDNAをクロマチン(染色質)と呼ばれる緻密な構造に組織化する。真核生物では、この構造はヒストンという小さな塩基性タンパク質の複合体にDNAが結合したものであるが、原核生物では複数種類のタンパク質が関与している[116][117]。ヒストンはヌクレオソームと呼ばれる円盤状の複合体を形成し、その表面には二本鎖DNAが2周完全に巻きついている。これらの非特異的相互作用は、ヒストンの塩基性残基がDNAの酸性糖-リン酸骨格とイオン結合を形成することによって生じるもので、したがって、塩基配列とはほとんど無関係である[118]。これらの塩基性アミノ酸残基の化学修飾には、メチル化、リン酸化、アセチル化などがある[119]。これらの化学的変化はDNAとヒストン間の相互作用の強度を変化させ、DNAを転写因子に近づきやすくしたり、あるいは近づきにくくし、転写速度を変化させる[120]。クロマチン内の他の非特異的DNA結合タンパク質には、曲がったDNAや歪んだDNAに結合する高移動度郡タンパク質がある[121]。これらのタンパク質は、ヌクレオソームの配列を曲げたり、染色体を構成する大きな構造体を組み立てる際に重要である[122]。
DNA結合タンパク質のもう一つのグループとして、一本鎖DNAと特異的に結合するDNA結合タンパク質がある。ヒトの場合、複製タンパク質Aがこの一群の中で最もよく理解されており、DNA複製、組換え、DNA修復など、二重らせんが分離するプロセスに関与している[123]。これらの結合タンパク質は一本鎖DNAを安定化させ、ステムループを形成したり、ヌクレアーゼによる分解からDNAを保護していると考えられている。

対照的に、他のタンパク質は特定のDNA配列に結合するような進化をしてきた。最も研究が進んでいるのは、転写を制御するタンパク質であるさまざまな転写因子である。各転写因子はプロモーター近くの特定のDNA配列に結合し、遺伝子の転写を活性化または阻害する。転写因子は2つの方法でこれを行う。一つは、転写を担うRNAポリメラーゼに直接、あるいは他の媒介タンパク質を介して結合することである。これによって、ポリメラーゼはプロモーターに位置し、転写を開始することができる[125]。あるいは、転写因子はプロモーターのヒストンを修飾する酵素と結合することができる。これによってDNA鋳型に対するポリメラーゼの近づきやすさを変化させる[126]。
これらのDNA標的は生物のゲノム全体に存在する可能性があるため、一種類の転写因子の活性が変化すると、何千もの遺伝子に影響を及ぼす可能性がある[127]。その結果、これらのタンパク質はしばしば、環境変化への応答や細胞の分化・発達を制御するシグナル伝達プロセスの標的となる。これらの転写因子のDNAとの相互作用の特異性は、タンパク質がDNA塩基の端と何度も接触して、DNA配列を「読み取る」ことを可能にすることで生じる。これらの塩基相互作用のほとんどは塩基が最も接近しやすい主溝で起こる[25]。

DNA修飾酵素
ヌクレアーゼとリガーゼ
ヌクレアーゼは、ホスホジエステル結合の加水分解を触媒することによってDNA鎖を切断する酵素である。DNA鎖の末端からヌクレオチドを加水分解するヌクレアーゼはエキソヌクレアーゼと呼ばれ、一方エンドヌクレアーゼは鎖内で切断する。分子生物学で最もよく使用されるヌクレアーゼは、特異的配列でDNAを切断する制限エンドヌクレアーゼである。たとえば、上図に示したEcoRV酵素は、DNA鎖の6塩基配列 5′-GATATC-3′ を認識し、水平線で切断する。自然界でこれらの酵素は、制限修飾系の一部として細菌の細胞内に侵入したファージDNAを消化することにより、細菌をファージ感染から保護している[129]。技術分野では、これらの配列特異的ヌクレアーゼは分子クローニングやDNAプロファイリングに使用されている。
DNAリガーゼと呼ばれる酵素は、切断または破損したDNA鎖を再結合させることができる[130]。リガーゼは、ラギング鎖DNA複製において特に重要で、複製フォークで作られた短いDNAセグメントをDNA鋳型の完全なコピーに結合する働きをする。これらはまたDNA修復や遺伝的組換えにも使用される[130]。
トポイソメラーゼとヘリカーゼ
トポイソメラーゼはヌクレアーゼとリガーゼの両方の活性を持つ酵素である。これらのタンパク質はDNAスーパーコイルの量を変化させる。これらの酵素の中には、DNAらせんを切断し、その一部分を回転させることでスーパーコイルのひずみを低減させ、その後DNAの切断部を封着するものもある[44]。別の種類の酵素は、DNAらせんを切断し、その切断部分に2本目のDNAを通過させてから、らせんを再結合することができる[131]。このようにトポイソメラーゼは、DNA複製や転写など、DNAが関与する多くの過程に必要な酵素である[45]。
ヘリカーゼは分子モーターとして働くタンパク質である。これらは、ヌクレオシド三リン酸、主にアデノシン三リン酸(ATP)の化学エネルギーを利用して、塩基間の水素結合を切断し、DNA二重らせんをほどいて一本鎖にする[132]。これらの酵素は、酵素がDNA塩基に近接する必要があるほとんどの過程にとって不可欠である。
ポリメラーゼ
ポリメラーゼはヌクレオシド三リン酸からポリヌクレオチド鎖を合成する酵素である。その生成物の配列は、鋳型(英: template)と呼ばれる既存のポリヌクレオチド鎖に基づいて作られる。これらの酵素は、伸長するポリヌクレオチド鎖末端の3'ヒドロキシ基に繰り返しヌクレオチドを付加する機能を持つ。結果としてすべてのポリメラーゼは5'から3'の方向に働く[133]。これらの酵素の活性部位では、入ってきたヌクレオシド三リン酸が鋳型と塩基対を形成する。これにより、ポリメラーゼは鋳型の相補鎖を正確に合成することができる。ポリメラーゼは、使用する鋳型の種類によって分類される。
DNA複製は、DNA依存性DNAポリメラーゼがDNAポリヌクレオチド鎖のコピーを作る。生物学的情報を保存するためには、各コピーの塩基配列が鋳型鎖の塩基配列と正確に相補的であることが不可欠である。多くのDNAポリメラーゼは校正活性を持っている。これによりポリメラーゼは、ミスマッチしたヌクレオチド間での塩基対形成の欠如によって、合成反応の際にときおり起こる誤りを検出することができる。ミスマッチが検出されると、3'→5'エキソヌクレアーゼ活性が活性化され、誤った塩基が除去される[134]。ほとんどの生物でDNAポリメラーゼは、DNAクランプやヘリカーゼなどの複数のアクセサリー・サブユニットを含む、レプリソームと呼ばれる大きな複合体の中で機能する[135]。
RNA依存性DNAポリメラーゼは、RNA鎖の塩基配列をDNAにコピーする特殊なポリメラーゼである。これらには、レトロウイルスによる細胞感染に関与するウイルス性酵素である逆転写酵素や、テロメアの複製に必要なテロメラーゼが含まれる[63][136]。たとえば、HIV逆転写酵素は、エイズウイルスの複製に関与する酵素である[136]。テロメラーゼは、その構造の一部として自身のRNA鋳型を含むという珍しいポリメラーゼである。これは染色体の末端にテロメアを合成する。テロメアは隣接する染色体末端が融合するのを防ぎ、染色体末端を損傷から保護する[64]。
転写は、DNA鎖の配列をRNAにコピーするDNA依存性RNAポリメラーゼによって行われる。遺伝子の転写を開始するために、RNAポリメラーゼはプロモーターと呼ばれるDNA配列に結合し、DNA鎖を分離する。その後、ターミネーターと呼ばれるDNAの領域に到達するまで、遺伝子配列をメッセンジャーRNA転写物にコピーし、そこで停止してDNAから分離する。ヒトのDNA依存性DNAポリメラーゼと同様に、ヒトゲノムのほとんどの遺伝子を転写する酵素であるRNAポリメラーゼIIは、いくつか調節サブユニットとアクセサリーサブユニットを持つ大きなタンパク質複合体の一部として働いている[137]。
遺伝子組換え
 |  |
| 遺伝的組換えにおけるホリデイジャンクション中間体の構造。4本のDNA鎖は、赤、青、緑、黄に色分けされている[138] | |
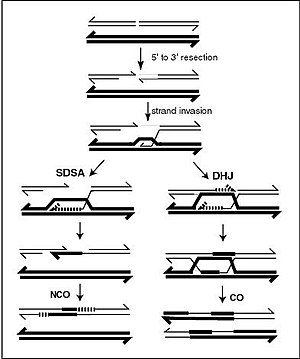
DNAらせんは通常、他のDNAセグメントと相互作用することはなく、ヒトの細胞では、異なる染色体は染色体テリトリー(英: chromosome territories)と呼ばれる核内の別々の領域を占めることさえある[139]。このように異なる染色体が物理的に分離していることは、DNAが安定した情報保管場所として機能するために重要である。なぜなら、染色体が相互作用する数少ない機会のひとつが、有性生殖の際に起こる染色体交差(英: chromosomal crossover)であり、その際に遺伝的組換えが起こるからである。染色体交差とは、DNAの2本のらせんが切断され、一部が入れ替わり、再び結合することである。
組換えは、染色体が遺伝情報を交換して遺伝子の新しい組み合わせを作り出すことを可能にし、これにより自然選択の効率を高め、新しいタンパク質の急速な進化において重要である[140]。遺伝的組換えはDNA修復、特に二本鎖切断に対する細胞の反応にも関与している可能性がある[141]。
染色体交差の最も一般的な形態は相同組換えで、関与する2つの染色体の配列は非常によく似ている。非相同組換えは、染色体転座や遺伝的異常を生じさせるため、細胞に損傷を与える可能性がある。組換え反応は、RAD51のようなリコンビナーゼとして知られる酵素によって触媒される[142]。組換えの最初の段階は、エンドヌクレアーゼかDNAの損傷によって引き起こされる二本鎖切断である[143]。その後、リコンビナーゼによって部分的に触媒される一連の段階によって、2つのらせんは少なくとも1つのホリデイジャンクションによって結合され、次に、各らせん中の一本鎖セグメントが他方のらせんの相補鎖と二本鎖を形成する。ホリデイジャンクションは四面体の接合構造で、染色体対に沿って移動することができ、一方の鎖をもう一方の鎖と交換することができる。組換え反応は、結合部の切断と遊離したDNAの再結合によって停止する[144]。組換えの際に同じ方向性(極性)の鎖だけがDNAを交換する。切断には東西切断(east-west cleavage)と南北切断(north–south cleavage)の2種類がある。南北切断はDNAの両鎖を切断するが、東西切断はDNAの片鎖をそのまま残す。組換えの際にホリデイジャンクションが形成されることで、遺伝的多様性、染色体上での遺伝子の交換、および野生型ウイルスゲノムの発現が可能になる。
進化
DNAにはあらゆる生命体が機能し、成長し、生殖するための遺伝情報が含まれている。しかし40億年の生命の歴史の中で、DNAがいつからこの機能を果たしてきたかは不明である。最も初期の生命体はRNAを遺伝物質として使っていたのではないかという提案もある[145][146]。RNAは遺伝情報の伝達とリボザイムの一部としての触媒作用の両方を行うことができるため、初期の細胞代謝において中心的な役割を果たしていた可能性がある[147]。核酸が触媒作用と遺伝学の両方に使われていたとする、この古代のRNAワールドは、4塩基に基づく現在の遺伝暗号の進化に影響を与えたかもしれない。このような生物における異なる塩基の数は、少ない塩基数による複製精度の向上と、多数の塩基によるリボザイムの触媒効率の向上との釣り合い関係によってきまった可能性もある[148]。しかしDNAは環境中で100万年未満しか存在できず、溶液中でゆっくりと短い断片に分解されるため、ほとんどの化石からDNAを回収することは不可能で、古代の遺伝子系の直接的な証拠はない[149]。より古いDNAが存在するという主張もなされており、特に2億5千万年前の塩の結晶から生存可能な細菌が分離されたという報告があるが[150]、これらの主張には賛否がある[151][152]。
DNAの構成要素(アデニン、グアニン、および関連する有機分子)は、地球外の宇宙空間で形成された可能性もある[153][154][155]。ウラシル、シトシン、チミンを含む、生命の複雑なDNAやRNAの有機化合物もまた、隕石から発見されたピリミジンのような化学物質を出発点として、宇宙空間の模倣した条件下の実験室で合成されている。ピリミジンは、宇宙で発見された最も炭素を多く含む化学物質である多環芳香族炭化水素(PAH)と同様、赤色巨星や星間宇宙塵やガス雲で形成された可能性がある[156]。
2021年2月、科学者たちは初めて、100万年以上前のマンモス象の遺体からDNA配列を決定したことを報告した。これまでに塩基配列が決定された最古のDNAである[157][158]。
技術における用途
遺伝子工学
フェノール・クロロホルム抽出法のように、生物からDNAを精製する方法や、制限消化やポリメラーゼ連鎖反応のように実験室でDNAを操作する方法が開発された。現代の生物学や生化学では、組換えDNAの分野でこれらの技術を活用している。組換えDNAとは、他のDNA配列から組み立てられた人工のDNA配列である。これらはウイルスベクターを利用して、プラスミドあるいは他の適切な型式で、生物に形質転換することができる[159]。生産された遺伝子組換え生物は、組換えタンパク質のような製品を製造したり、医学研究で使用したり[160]、農業で繁殖したりする[161][162]。
DNAプロファイリング
法科学者は、犯罪現場で発見された血液、精液、皮膚、唾液、または毛髪に含まれるDNAを利用して、加害者などの個人と一致するDNAを特定することができる[163]。この手法は正式にはDNAプロファイリング(英: DNA profiling)と呼ばれ、DNA指紋法(英: DNA fingerprinting)とも呼ばれる。DNAプロファイリングでは、ショートタンデムリピート(縦列型反復配列)やミニサテライトなど、反復DNAの可変部分の長さを個人間で比較する。この方法は通常、一致するDNAを同定するための非常に信頼性の高い技術である[164]。ただし、現場が複数名のDNAで汚染されている場合、同定が複雑になることがある[165]。DNAプロファイリングは1984年にイギリスの遺伝学者アレック・ジェフリーズによって開発され[166]、1988年のエンダービー殺人事件でコリン・ピッチフォークを有罪にするために法科学で初めて使用された[167]。
法科学が発達し、血液、皮膚、唾液、毛髪などの微量サンプルで遺伝子照合ができるようになったことで、多くの事件が再調査されるようになった。当初の調査時には科学的に不可能であった証拠も、現在では発見されることがある。一部の地域において二重の危険の原則(英: double jeopardy law)が撤廃されたこともあいまって、これまでの裁判で陪審を納得させるに十分な証拠が得られなかった事件でも再審が可能になることがある。重大犯罪で起訴された人々は、照合目的でDNAサンプルの提出を求められることがある。法科学的に得られたDNA照合に対する最も明白な抗弁は、証拠の相互汚染が起こったと主張することである。このため、重大犯罪の新事例に対し、細心の注意を払った厳格な取り扱い手順が導入されるようになった。
DNAプロファイリングはまた、集団死傷事件の犠牲者[168]、重大事故の遺体やその一部、集団戦没者墓地における犠牲者個人の身元を、家族との照合によって確認するためにも使用され、成功を収めている。
DNAプロファイリングは、誰かが子供の生みの親または祖父母であるかどうかを判定するためのDNA親子鑑定にも使用され、親とされる人物が子供と生物学的に血縁関係がある場合、親である確率は通常99.99%である。通常のDNA配列決定法は出生後に行われるが、母親がまだ妊娠している間に親子関係を検査する新しい方法がある[169]。
DNA酵素または触媒DNA
デオキシリボザイム(英: deoxyribozyme)は、DNA酵素(DNAzymes)または触媒DNA(catalytic DNA)とも呼ばれ、1994年に初めて発見された[170]。これらの大部分は、in vitro選択法または試験管内進化法(英: Systematic Evolution of Ligands by Exponential Enrichment、SELEX)と呼ばれる組み合わせアプローチを使用して、ランダムなDNA配列の大規模プールから単離された一本鎖DNA配列である。DNA酵素は、RNA-DNA切断、RNA-DNAライゲーション、アミノ酸のリン酸化-脱リン酸化、炭素-炭素結合形成など、さまざまな化学反応を触媒する。DNA酵素は、触媒反応の化学反応速度を、無触媒反応の最大1千億倍に向上させることができる[171]。DNA酵素の中でもっとも広く研究されているのはRNA切断型で、さまざまな金属イオンの検出や治療薬の設計に使用されている。GR-5 DNA酵素(鉛特異的)[170]、CA1-3 DNA酵素(銅特異的)[172]、39E DNA酵素(ウラニル特異的)、NaA43 DNA酵素(ナトリウム特異的)[173]など、いくつかの金属特異的DNA酵素が報告されている。NaA43 DNA酵素は、ナトリウムに対して他の金属イオンよりも10,000倍以上選択的であると報告されており、細胞内でリアルタイムのナトリウムセンサーを作成するために使用された。
バイオインフォマティクス
バイオインフォマティクスは、DNA核酸配列データを含む生物学的データの保存、データマイニング、検索、操作のための技術開発を含む学問分野である。これらの技術は、コンピュータサイエンス、特に文字列検索アルゴリズム、機械学習、データベース理論に広く応用されるようになった[174]。文字列検索またはマッチングアルゴリズムは、より大きな文字列の中にある文字列の出現を検出する手法で、ヌクレオチドの特異的配列を検索するために開発された[175]。DNA配列を他のDNA配列と整列させることで、相同配列を同定し、それらを区別する特異的変異を突き止めることができる。これらの技術、特に多重配列アラインメントは、系統的関係やタンパク質機能を研究する際に使用される[176]。ヒトゲノムプロジェクトで作成されたような全ゲノムDNA配列の大規模なデータセットは、各染色体上の遺伝子や調節エレメントの位置を特定するアノテーションがなくては利用が困難である。タンパク質やRNAをコードする遺伝子に関連する特徴的なパターンを持つDNA配列領域は、遺伝子探索アルゴリズムによって同定することができ、これにより研究者は、特定の遺伝子産物が実験的に単離される前であっても、生物内での存在と可能性のある機能を予測することができる[177]。また、ゲノム全体を比較することで、生物の進化の歴史に焦点を当てたり、複雑な進化の過程を研究することもできる。
DNAナノテクノロジー

DNAナノテクノロジーは、DNAや他の核酸に特有の分子認識特性を利用して、有用な特性を備えた自己集合化能・分岐DNA複合体を作り出す技術領域である[179]。DNAは生物学的情報の伝達手段としてではなく、構造材料として使用することもできる。その結果、2次元周期格子(タイルベースとDNAオリガミ法の両方)や、多面体形状を持つ3次元構造の創造につながった[180]。ナノメカニカルデバイスやアルゴリズム的自己集合化も実証されており[181]、これらのDNA構造は、金ナノ粒子やストレプトアビジンタンパク質など、他の分子集合体の鋳型とするために使用されている[182]。DNAや他の核酸は、アプタマー(さまざまなバイオテクノロジーや生物医学の用途に使われる、特定の標的分子に対する合成オリゴヌクレオチドリガンド)の基礎となっている[183]。
系統学と人類学
DNAは時間の経過とともに変異を蓄積し、遺伝によって歴史的な情報を含んでおり、DNAの塩基配列を比較することで、遺伝学者は生物の進化の歴史、系統発生を推定することができる[184]。系統発生学は進化生物学における強力な道具である。生物種内のDNA配列を比較することで、集団遺伝学者は特定の集団の歴史を知ることができる。これは、生態遺伝学から人類学に至るまで、さまざまな研究に利用できる。
情報ストレージ
情報記録媒体としてのDNAは、電子機器に比べて記録密度がはるかに高いため、非常に大きな可能性を秘めている。しかしコストが高く、読み書きに時間がかかり(メモリレイテンシ)、信頼性が十分でないことなどから、実用化には至っていない[185][186]。
歴史

DNAが最初に単離されたのは、1869年、スイスの医師フリードリッヒ・ミーシェルによって、廃棄された手術用包帯の膿(うみ)の中から微小な物質を発見した時にさかのぼる。細胞核に存在することから、彼はこれを「ヌクレイン(英: nuclein)」と命名した[187][188]。1878年、アルブレヒト・コッセルが「ヌクレイン」の非タンパク質成分である核酸を単離し、その後、5つの標準核酸塩基を単離した[189][190]。
1909年、フィーバス・レヴィーンはRNA(当時は「酵母核酸(英: yeast nucleic acid)」と呼んだ)の塩基、糖、リン酸のヌクレオチド単位を同定した[191][192][193]。1929年、レヴィーンはDNA(当時は「胸腺核酸(英: thymus nucleic acid)」)内のデオキシリボース糖を同定した[194]。レヴィーンは、DNAはリン酸基によって結合された4つのヌクレオチド単位からなる紐で構成されていることを提案した(テトラヌクレオチド仮説)。レヴィーンは、この鎖は短く、塩基が一定の順序で繰り返されていると考えた。1927年、ニコライ・コルツォフは、遺伝形質は「それぞれの鎖を鋳型として半保存的に複製される2本の鏡像鎖」からなる「巨大な遺伝分子」を介して遺伝すると提案した[195][196]。1928年、フレデリック・グリフィスは実験によって、肺炎球菌(Pneumococcus)のS型菌の形質が、死滅したS型菌と生きたR型菌とを混合することによって、R型菌に転換できることを発見した(グリフィスの実験)[197][198]。この実験系は、DNAが遺伝情報を伝達していることを初めて明確に示唆した。
1933年、ウニの未受精卵を研究していたジャン・ブラッシェ(Jean Brachet)は、DNAは細胞核に存在し、RNAは細胞質にのみ存在することを提案した。当時は、酵母核酸(RNA)は植物だけに、胸腺核酸(DNA)は動物だけに存在すると考えられていた。後者は細胞内pHを緩衝する機能を持つ四量体であると考えられていた[199][200]。
1937年、ウィリアム・アストベリーは、DNAが規則正しい構造を持っていることを示すX線回折パターンを初めて作成した[201]。
1943年、オズワルド・アベリーは、共同研究者であるコリン・マクロード、マクリン・マッカーティとともに、DNAが形質転換原理であることを突き止め、グリフィスの提案を支持した(アベリー-マクロード-マッカーティの実験)[202]。エルヴィン・シャルガフは、現在「シャルガフの法則」として知られる見解を発表し、どの生物種のDNAにおいても、グアニンの量はシトシンと等しく、アデニンの量はチミンと等しくなければならないと述べた[203][204]。

1951年末、フランシス・クリックは、英国ケンブリッジ大学のキャヴェンディッシュ研究所でジェームズ・ワトソンとともに研究を始めた。遺伝におけるDNAの役割は、1952年にアルフレッド・ハーシーとマーサ・チェイスが行った一連の実験(ハーシー-チェイス実験)で、DNAが腸内細菌ファージT2の遺伝物質であることを示して確認された[205]。
1952年5月、ロザリンド・フランクリンの指導下で研究をしていた大学院生、レイモンド・ゴスリングは、高水和レベルでのDNA X線回折像を撮影し、「Photo 51」とラベルを付けた[206]。この写真は、モーリス・ウィルキンスからワトソンとクリックに渡されたもので、彼らがDNAの正しい構造を得る上で極めて重要なものであった。フランクリンはクリックとワトソンに、主鎖は外側になければならないと語った。それまでは、ライナス・ポーリングや、ワトソンとクリックらは、鎖が内側にあって塩基が外側を向いた誤ったモデルを持っていた。フランクリンがDNA結晶の空間群を特定したことで、クリックは、DNAの二本鎖が逆平行であることを突き止めた[207]。1953年2月、ライナス・ポーリングとロバート・コリーは、リン酸が軸の近くにあり、塩基が外側にある、3本の鎖が絡み合った核酸のモデルを提案した。ワトソンとクリックはそのモデルを完成させ、現在ではDNA二重らせんの最初の正しいモデルとして受け入れられている[208]。1953年2月28日、クリックは、英国ケンブリッジのザ・イーグルパブで常連客のランチタイムを中断し、彼とワトソンが「生命の秘密を発見した」と発表した[209]。
1953年4月25日、雑誌「Nature」は、ワトソンとクリックの二重らせん構造DNAとそれを支持する証拠を示す一連の5本の論文を掲載した[210]。その構造は、『MOLECULAR STRUCTURE OF NUCLEIC ACIDS A Structure for Deoxyribose Nucleic Acid(核酸の分子構造: デオキシリボース核酸の構造)』と題されたレターで報告され、その中で彼らは次のように述べている。『私たちが仮定した特異的な対形成が、遺伝物質の複製メカニズムである可能性を即座に示唆していることを、私たちは見逃さなかった[9]』。この後、フランクリンとゴスリングのレターが続き、彼ら自身のX線回折データと独自の解析方法が初めて公表された[48][211]。さらに、ウィルキンスと彼の同僚2名によるレターが続き、生体内におけるB-DNA X線パターンの解析が報告されており、生体内にワトソンとクリックの構造が存在することを裏付けていた[49]。
1962年、フランクリンの死後、ワトソン、クリック、ウィルキンスの3名はノーベル生理学・医学賞を共同受賞した[212]。ノーベル賞は存命中の受賞者にのみ授与される。2023年4月、科学者たちは新たな証拠に基づき、ロザリンド・フランクリンはDNA発見の過程に貢献しただけでなく「対等な役割」を果たした人物であり、発見後に発表されたような貢献者ではないと結論づけた[213][214][215]。誰がこの発見の功績を称えられるべきかについては議論が続いている[216]。
1957年に行われた影響力のある講演で、クリックは、分子生物学におけるセントラル・ドグマを打ち出し、DNA、RNA、タンパク質の関係を予言し、「アダプター仮説」を公にした[217]。二重らせん構造が示唆する複製機構の最終確認は、1958年のメセルソン-スタールの実験によってなされた[218]。クリックと共同研究者らによる更なる研究によって、遺伝暗号がコドンと呼ばれる塩基の非重複トリプレット(三連符)に基づいていることが明らかにされ、ハー・ゴビンド・コラナ、ロバート・W・ホリー、マーシャル・ニーレンバーグによって遺伝暗号の解読が可能となった[219]。分子生物学の誕生は、これらの発見が基礎となった[220]。
1986年、英国の警察がレスター大学のアレック・ジェフリーズに強姦殺人に関する容疑者の自白の検証または反証を依頼したとき、DNA鑑定は初めて犯罪捜査に利用された。この特別な事件では、容疑者は2件の強姦殺人を自白していたが、後に自白を撤回した。大学の研究所でのDNA鑑定によって、容疑者の当初の「自白」の真実性はすぐに否定され、容疑者は強姦殺人の容疑を晴らすことができた[221]。
符号位置
| 記号 | Unicode | JIS X 0213 | 文字参照 | 名称 |
|---|---|---|---|---|
| 🧬 | U+1F9EC | - | 🧬🧬 | dna |
参照項目
- 常染色体 - 性染色体以外の染色体
- 結晶学 - 結晶性固体中の原子の配列を決定する科学的研究
- 全米DNAの日 - 4月25日に祝われるアメリカ合衆国の祝日
- DNAマイクロアレイ - 固体表面に付着した微細なDNAスポットの集合体
- DNAシークエンシング - 核酸配列を決定する工程
- 遺伝子疾患 - ゲノムの1つまたは複数の異常によって引き起こされる健康問題
- 遺伝子系図 - DNA検査によって推定した個人間の遺伝的関係
- ハプロタイプ - 親から受け継いだ遺伝子の集合
- 減数分裂 - 単数体の配偶子を作る細胞分裂の様式
- 核酸表記法 - DNAの4つのヌクレオチドをA、C、G、Tと呼ぶ国際共通表記法
- 塩基配列 - 核酸中のヌクレオチドの連続物
- リボソームDNA - リボソームRNAをコーディングするDNAの特定の領域
- サザンブロット - DNA配列の検出と定量に用いられる分析技術
- X線回折法 - X線ビームの散乱強度に基づく非破壊分析技術の一群
- ゼノ核酸 - 合成核酸アナログ
- 三本鎖DNA - 3本のオリゴヌクレオチドが三重らせんを形成するDNA構造
脚注
推薦文献
- 田村隆明『基礎細胞生物学』(第1版第1刷版)、東京化学同人、2010年。ISBN 978-4-8079-0724-3。
- 武村政春『DNAを操る分子たち』(初版第1刷版)、技術評論社、2012年。ISBN 978-4-7741-4998-1。
- Berry A, Watson J (2003年). DNA: the secret of life. New York: Alfred A. Knopf. ISBN 0-375-41546-7。
- Calladine CR, Drew HR, Luisi BF, Travers AA (2003年). Understanding DNA: the molecule & how it works. Amsterdam: Elsevier Academic Press. ISBN 0-12-155089-3。
- Carina D, Clayton J (2003年). 50 years of DNA. Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6。
- Judson HF [in 英語] (1979年). The Eighth Day of Creation: Makers of the Revolution in Biology (2nd ed.). Cold Spring Harbor Laboratory Press. ISBN 0-671-22540-5。
- Olby RC [in 英語] (1994年). The path to the double helix: the discovery of DNA. New York: Dover Publications. ISBN 0-486-68117-3。 First published in October 1974 by MacMillan, with foreword by Francis Crick; the definitive DNA textbook, revised in 1994 with a nine-page postscript.
- Olby R (2003年1月). "Quiet debut for the double helix". Nature. 421 (6921): 402–05. Bibcode:2003Natur.421..402O. doi:10.1038/nature01397. PMID 12540907。
- Olby RC (2009年). Francis Crick: A Biography. Plainview, N.Y: Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-798-3。
- Micklas D (2003年). DNA Science: A First Course. Cold Spring Harbor Press. ISBN 978-0-87969-636-8。
- Ridley M [in 英語] (2006年). Francis Crick: discoverer of the genetic code. Ashland, OH: Eminent Lives, Atlas Books. ISBN 0-06-082333-X。
- Rosenfeld I (2010年). DNA: A Graphic Guide to the Molecule that Shook the World. Columbia University Press. ISBN 978-0-231-14271-7。
- Schultz M, Cannon Z (2009年). The Stuff of Life: A Graphic Guide to Genetics and DNA. Hill and Wang. ISBN 978-0-8090-8947-5。
- Stent GS, Watson J [in 英語] (1980年). The Double Helix: A Personal Account of the Discovery of the Structure of DNA. New York: Norton. ISBN 0-393-95075-1。
- Watson J (2004年). DNA: The Secret of Life. Random House. ISBN 978-0-09-945184-6。
- Wilkins M [in 英語] (2003年). The third man of the double helix the autobiography of Maurice Wilkins. Cambridge, England: University Press. ISBN 0-19-860665-6。
外部リンク
- DNA - Curlie(英語)
- DNA binding site prediction on protein
- DNA the Double Helix Game From the official Nobel Prize web site
- DNA under electron microscope
- Dolan DNA Learning Center
- Double Helix: 50 years of DNA, Nature
- Proteopedia DNA
- Proteopedia Forms_of_DNA
- ENCODE threads explorer ENCODE home page at Nature
- Double Helix 1953–2003 National Centre for Biotechnology Education
- Genetic Education Modules for Teachers – DNA from the Beginning Study Guide
- 蛋白質構造データバンク 今月の分子23:DNA(DNA)
- "Clue to chemistry of heredity found". The New York Times, June 1953. First American newspaper coverage of the discovery of the DNA structure
- DNA from the Beginning Another DNA Learning Center site on DNA, genes, and heredity from Mendel to the human genome project.
- The Register of Francis Crick Personal Papers 1938 – 2007 at Mandeville Special Collections Library, University of California, San Diego
- Seven-page, handwritten letter that Crick sent to his 12-year-old son Michael in 1953 describing the structure of DNA. See Crick's medal goes under the hammer, Nature, 5 April 2013.
- 『デオキシリボ核酸』 - コトバンク






