Ácido oxálico
composto químico
| Ácido oxálico Alerta sobre risco à saúde | |
|---|---|
 | |
| Nome IUPAC | Ácido etanodioico |
| Outros nomes | Ácido oxálico |
| Identificadores | |
| Número CAS | |
| SMILES |
|
| Propriedades | |
| Fórmula molecular | C2H2O4 (anidro) C2H2O4·2H2O (diidratado) |
| Massa molar | 90.03 g/mol (anidro) 126.07 g/mol (diidratado) |
| Aparência | cristais brancos |
| Densidade | 1.90 g/cm³ (anidro) 1.653 g/cm³ (diidratado) |
| Ponto de fusão | 101-102 °C (diidratado) |
| Solubilidade em água | 9.5 g/100 mL (15 °C) 14.3 g /100 mL (25 °C?) 120 g/100 mL (100 °C) |
| Riscos associados | |
| MSDS | External MSDS |
| NFPA 704 | |
| Ponto de fulgor | 166 °C |
| Compostos relacionados | |
| Outros aniões/ânions | Cloreto de oxalila Oxamida (amida do ácido oxálico) |
| Ácidos dicarboxílicos relacionados | Ácido malônico (C3) |
| Compostos relacionados | Ácido glicólico (hidroxiacético) Oxalato dissódico Oxalato de cálcio Éster de fenil oxalato Oxalato de dimetila Oxalato de dietila |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
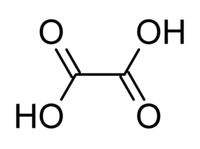
O ácido oxálico ou ácido etanodióico é um ácido (mais precisamente um ácido dicarboxílico) de fórmula molecular H2C2O4 ou, mais precisamente, HO2CCO2H. É um ácido orgânico saturado, de cadeia normal e relativamente forte, sendo 10.000 vezes mais forte que o ácido acético. Comercialmente, a forma mais usual é a diidratada, de fórmula molecular C2H2O4·2H2O.
Propriedades
Físicas
- * Sabor ácido
- * Sólido cristalino e incolor. Sublima a 150 °C. Densidade = 1,653 g/cm3
- * Parcialmente solúvel em água, etanol e outros solventes.
Químicas
- * Em solução aquosa libera 2 cátions ( 2 H+ ), por molécula.
- * Grau de ionização: 60%
- * Fortemente ácido e muito venenoso.
- * Reage violentamente com agentes oxidantes fortes.
- * Desidrata-se, intramolecularmente, em meio ácido:
- Ácido oxálico → CO + CO2 + H2O
- * Reage com bases formando oxalatos:
- HCOO - COOH + 2 NaOH → 2 H2O + [Na][COO - COO][Na] (oxalato de sódio)
- * Em solução aquosa é sensível à luz e ao ar, formando gás carbônico
Ocorrência
É encontrado nas plantas do gênero Oxalis.O ácido oxálico pode ser encontrado também no espinafre, no tomate, no inhame, na carambola e outros vegetais. Em relação à carambola, o ácido oxálico ocorre em grande quantidade e é o grande responsável pelo efeito tóxico desta fruta em pacientes com disfunções renais.[1]
Obtenção
- Industrialmente, é obtido a partir do metanoato de sódio, em duas etapas:
- 2 metanoato de sódio a 400 °C → Oxalato de sódio + H2
- Oxalato de sódio + H2SO4 → Ácido oxálico + Na2SO4
Equações:
- 2 H - COONa → NaOOC - COONa + H2
- NaOOC - COONa + H2SO4 → HOOC - COOH + Na2SO4
Aplicações
- * Produto anti-tártaro.
- * Eliminação de ferrugem em metais, mármores e outras pedras.
- * Fixação de corantes em tecidos ( mordente )
- * Obtenção de corantes
- * Fabricação de tintas de escrever
- * Branqueamento e curtição industrial de couros.
- * Branqueamento de texteis, papeis, cortiça e palha.
- * Produção de oxalatos.
Curiosidades
- * O nome usual ácido oxálico vem do gênero de plantas de onde foi isolado pela primeira vez (Oxalis).
- * É conhecido no meio náutico como Sal Azedo e é usado para limpeza do Gel Coat dos barcos.
- * Concentrações elevadas de íons de metais pesados ( Al, Hg, Pb e Cd ) intoxicam as plantas, evitando o seu crescimento. As raizes de uma planta chinesa, denominada fagópiro, quando exposta a concentrações de alumínio segrega o ácido oxálico, que combina-se com os íons de alumínio formando um complexo que não inibe o crescimento.
- * Diminui a absorção de cálcio
Ligações externas
Referências
🔥 Top keywords: Wikipédia:Página principalEspecial:PesquisarWikipédia:Wikiconcurso Wiki Loves Mato GrossoChatGPTLiga dos Campeões da UEFAWikipédia:Edit-a-thon/cada livro seu público 2024Real Madrid Club de FútbolCleópatraFacebookAlegrete (Rio Grande do Sul)Arsenal Football ClubSony ChannelFelipe AndersonCanal BrasilVilipêndio a cadáverBig Brother Brasil 24YouTubeFicheiro:Logotipo da GloboNews.pngAndriy LuninVincent MartellaDuda SalabertAMBEVBig Brother BrasilManchester City Football ClubCarlo AncelottiWagner MouraRevolução de 25 de Abril de 1974RomárioCopa do Brasil de Futebol de 2024Israel AdesanyaAlex PereiraJogo do bichoMonteiro LobatoBorussia DortmundFC Bayern MünchenJude BellinghamElon MuskInstagramJosep Guardiola

