钌
基本性質
物理性质
冷的时候,钌的延性较小,即使纯粹单晶也很容易弯曲。金属钌可用电弧或电子束熔化。钌通常加热至1500℃时才能加工成细丝或薄板。[7]
化学性质
钌有四种晶态,在标准情况下不会失去光泽,它加热到 800 °C(1,070 K)时氧化。钌溶于熔融碱,产生钌酸盐(RuO2−
4)。钌不与王水反应,但在高温下会被卤素攻击。[8]事实上,钌易被强氧化剂(比如高碘酸,热浓硒酸和碱性次氯酸盐等)侵蚀。[9]少量的钌可以增加铂和钯的硬度。钛的腐蚀抗性通过添加少量钌,会显着增加。[8]金属可以通过电镀和热分解镀上钌。已知钌钼合金在低于10.6 K的温度下具有超导性。[8]钌是唯一可以呈现+8氧化态的4d过渡金属。尽管如此,这个价态的稳定性也低于较重的同类物锇。与铁类似但与锇不同,钌可以在+2和+3的较低氧化态下形成水合阳离子。[10]
在钼的最大值之后,钌是第一个在4d过渡金属中的熔点、沸点以及原子化焓呈下降趋势的,因为4d壳层已超过一半,电子对金属键的形成贡献较小。(前一个元素锝有不寻常低的值,因为它的电子排布 [Kr]4d55s2 呈半充满结构,尽管它违背趋势的距离并没有像3d过渡金属中的锰这么远。)[11]与较轻的同类物铁不同,钌在室温下是顺磁性的,因为铁的居里点高于室温。[12]
一些常见的钌离子在酸性水溶液中的还原电位如下:[13]
| 0.455 V | Ru2+ + 2e− | ↔ Ru |
| 0.249 V | Ru3+ + e− | ↔ Ru2+ |
| 1.120 V | RuO2 + 4H+ + 2e− | ↔ Ru2+ + 2H2O |
| 1.563 V | RuO2− 4 + 8H+ + 4e− | ↔ Ru2+ + 4H2O |
| 1.368 V | RuO− 4 + 8H+ + 5e− | ↔ Ru2+ + 4H2O |
| 1.387 V | RuO4 + 4H+ + 4e− | ↔ RuO2 + 2H2O |
同位素
自然界中存在着7种钌的同位素。此外,目前共发现了34种钌的放射性同位素。在这些放射性同位素当中,较稳定的有106Ru(半衰期373.59天)、103Ru(半衰期39.26天)和97Ru(半衰期2.9天)。[14][15]剩下的钌同位素除了95Ru(半衰期1.643小时)和105Ru(半衰期4.44小时)以外,半衰期都少于五分钟。[14][15]
比最常见的钌同位素102Ru轻的钌同位素的主要衰变方式是电子捕获成锝,而更重的钌同位素则通过β衰变衰变成铑。[14][15]
106Ru是铀和钚的裂变产物。大气中检测到的高浓度106Ru与2017年据称在俄罗斯未申报的核事故有关。[16]
分布與含量
生產製造
人们每年大约开采30吨钌[19],而钌的世界储量估计为 5,000 吨。[17]开采的铂族金属 (PGM) 混合物的组成变化很大,这取决于地球化学地层。例如,南非开采的铂族金属平均含有 11% 的钌,而前苏联开采的铂族金属仅含有 2%(1992年)。[20][21]钌、锇和铱被认为是少数铂族金属。[12]
与其他铂族金属一样,钌是作为副产品从镍、铜以及铂金属矿石加工中获得的。在铜的电解精炼和镍过程中,银、金和铂族金属等贵金属沉淀为“阳极泥”,提取原材料。[22][23]根据原材料的组成,通过几种方法中的任何一种将金属转化为离子化溶质。一种代表性方法是与过氧化钠融合,然后溶解在王水,一种会放出氯与盐酸的混合物中。[24][25] 锇、钌、铑和铱不溶于王水并沉淀,将其他金属留在溶液中。通过用熔融的硫酸氢钠处理,可从残余物中分离出铑。含有钌、锇和铱的不溶残留物用氧化钠处理,其中铱不溶,产生溶解的钌和锇盐。在氧化成挥发性氧化物之后,RuO
4 通过和氯化铵反应,产生 (NH4)3RuCl6 的沉淀与 OsO
4 分离,或是用有机溶剂萃取挥发性的四氧化锇。[26] 氢气可用来还原六氯合钌(III)酸铵,产生粉末。[8][27]产物用氢气还原,产生粉末或海绵金属,可以用粉末冶金技术或氩弧焊进行处理。[8][28]
化合物
钌在氧化态 0 到 +8和 −2都有化合物。钌和锇的化合物有时类似。其中,钌的 +2、+3和 +4 氧化态是最常见的。钌化合物最普遍的前体是三氯化钌,一种红色固体,化学性质不明确,但在合成其它钌化合物的方面用途广泛。[27]
氧化物與硫属化物
钌可以被氧化成二氧化钌(RuO2,氧化态 +4),之后还可以被高碘酸钠氧化成黄色、挥发性的四氧化钌 RuO4,一种腐蚀性强的氧化剂,其结构和性质类似于四氧化锇。RuO4 主要用作从矿石和放射性废物中提纯钌的中间体。[29]
钌酸钾(K2RuO4,氧化态+6)和高钌酸钾(KRuO4,氧化态+7)都是已知的。[30]不像四氧化锇,四氧化钌较不稳定,氧化性强到足以在室温下氧化稀盐酸和像是乙醇的有机溶剂也容易在碱性水溶液中被还原成钌酸根(RuO2−
4),它在超过 100 °C下分解成二氧化钌。不像铁但像锇,钌没有低价的 +2、+3 氧化态氧化物。[31]钌会形成二硫属化物,它们是以黄铁矿结构结晶的抗磁性半导体。[31] 二硫化钌(RuS2)以矿物laurite的形式在天然中存在。
类似铁,钌不容易形成氧阴离子,而是更喜欢与氢氧根离子配合,达到高配位数。四氧化钌可被又稀又冷的氢氧化钾还原成黑色的高钌酸钾 KRuO4,其中钌为 +7氧化态。高钌酸钾也可以由氯气氧化钌酸钾 K2RuO4而成。高钌酸根离子不稳定,会被水还原形成橙色的钌酸根。钌酸钾可以通过金属钌与熔融氢氧化钾和硝酸钾反应而成。[32]
一些混合氧化物也是已知的,例如 MIIRuIVO3、Na3RuVO4、Na
2RuV
2O
7和 MII
2LnIII
RuV
O
6。[32]
鹵化物和卤氧化物
已知最高价的卤化钌是六氟化钌,一种熔点 54 °C的深棕色固体。它会剧烈水解,且容易分解成低价氟化钌的混合物,并放出氟气。五氟化钌是一种以四聚体存在的深绿色固体,也很容易水解,熔点 86.5 °C。黄色的四氟化钌可能也是聚合物结构,可以由碘还原五氟化钌而成。在所有二元钌混合物中,只有氧化物和氟化物能形成高氧化态。[33]
三氯化钌是一种著名的化合物,有黑色的α相和深棕色的β相,而三水合物是红色的。[34]在已知的三卤化物中,三氟化钌是深棕色的,超过 650 °C时会分解;三溴化钌是在 400 °C分解的深棕色固体,而三碘化钌是黑色的。[33]在二卤化物中,二氟化钌未知,二氯化钌是棕色的,二溴化钌是黑色的,而二碘化钌是蓝色的。[33]钌唯一已知的卤氧化物是浅绿色的四氟氧化钌 RuOF4。[34]
配位錯合物與有機金屬

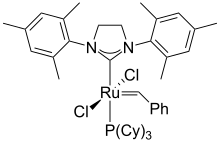
钌有很多配合物,例子有五氨配合物 [Ru(NH3)5L]n+ ,通常存在于 Ru(II) 和 Ru(III)。联吡啶和三联吡啶的衍生物很多,其中最著名的是冷发光的氯化三(双吡啶)合钌(II)。
钌可以形成很多有碳-钌键的化合物,例如用于烯烃复分解反应的格拉布催化剂。[35] 二茂钌的结构类似二茂铁,但表现出独特的氧化还原特性。五羰基钌是无色液体,在没有 CO 的情况下转化为深红色固体十二羰基三钌。三氯化钌和一氧化碳反应,产生很多衍生物如 RuHCl(CO)(PPh3)3 和Ru(CO)2(PPh3)3(Roper配合物)。把三氯化钌的醇溶液和三苯基膦一起加热,可以得到二氯化三(三苯基膦)钌 (RuCl2(PPh3)3),之后还可以转化成氢配合物氢氯化三(三苯基膦)钌(II) (RuHCl(PPh3)3)。[27]
發展史
雖然,含有所有六種鉑族金屬的天然鉑合金,被前哥倫布時期美洲人長期使用,從16世紀中葉起,被歐洲化學家稱為材料,但直到18世紀中葉,鉑才被確認為一個純元素。天然鉑金屬在19世紀的第一個十年被發現,裡面含有鈀、銠、鋨、銥[36]。俄羅斯河流沖積沙中的鉑,從1828年開始使用於盤子和獎牌以及鑄造盧布硬幣的原物料[37]。在鍊製用於鑄幣的鉑金屬過程中,所得到的殘留物,在俄羅斯帝國是可以取得的,因此鉑的大部分研究是在東歐進行的。
在1807年,從南美的鉑金屬礦中,波蘭化學家約德澤伊•什尼亞代基有可能分離出元素44. (他稱之為vestium,是依據在不久前發現的小行星Vesta命名 )。他於1808年出版了一份他的發現公告[38]。然而,他的工作從未獲得證實,他後來撤回了他的發現聲明[17]。
約恩斯•貝澤柳斯和戈特弗裡德•奧桑在1827年幾乎發現了釕[39] 。他們試驗了以王水溶解烏拉山脈含鉑的原礦石後留下的殘留物。貝澤柳斯沒有發現任何不尋常的金屬元素,但奧桑認為他發現了三種新金屬元素,稱之為pluranium、 ruthenium和polinium。[8]這種差異導致貝爾澤柳斯和奧桑之間關於殘留物成分的長期爭論。[40]由於Osann無法重複他離析釕的實驗,最終放棄了他的主張[40][41]。Osann之所以選擇ruthenium这个名字,是因為分析的樣本來自俄羅斯的烏拉山脈[42] 。 這個名字本身來源於魯塞尼亞,拉丁語Ruthenia,一個歷史區域,包括今天的烏克蘭,白俄羅斯,俄羅斯西部,以及斯洛伐克和波蘭的部分地區。[40]
1844年,波羅的-德意志裔俄羅斯科學家卡爾•恩斯特•克勞斯 (Karl Ernst Claus) 發現,戈特弗裡德•奧桑備製的化合物中也含有少量的釕,克勞斯於同年曾發現的釕。克勞斯在喀山大學工作時,從盧布硬幣製程的鉑金屬殘留物中,分離出釕。就像40年前,在喀山發現釕的更重的同族元素鋨一樣。克勞斯表明,氧化釕含有一種新的金屬元素,並從不溶于王水的粗鉑中獲得6克的釕。替新元素選擇名稱,克勞斯說:"我為新元素命名,以紀念我的祖國,Ruthenium。我有權使用這個名字,因為Osann先生放棄了他的釕,所以這個字還不存於化學[40][43]。在这样做的过程中,克劳斯开创了一种延续至今的趋势——以一个国家命名一个元素。[44]
应用
纯金属钌用途很少。钌是铂和钯的有效硬化剂,使用它不会降低铂和钯的抗腐蚀性。含有较大百分数(30%-70%)的钌的合金,包含有其它贵重金属或碱金属,可用在电气触点上和需要抗磨和抗腐蚀的地方,如钢笔尖和工具枢轴上。二氧化钌导电,在有机介质中以粉末状与玻璃料相混合,可用作非金属衬底制成电阻元件。[7]
催化劑

许多含钌化合物都有催化性。催化剂可方便地两种:可溶于反应介质的叫均相催化剂,而不溶的则叫多相催化剂。
钌的纳米颗粒可以在禾乐石内部形成。这种广泛存在的矿物天然具有卷状纳米片(纳米管)的结构,可以支持钌纳米团簇的合成,用于后续工业催化。[45]
勻相催化劑
含有三氯化钌的溶液对烯烃复分解反应具有高活性。此类催化剂在商业上用于生产聚降冰片烯。[46]某些钌的卡宾配合物显示出相当的反应性,可提供于工业过程。[47] 例如,格拉布催化剂已用于制备药物和先进材料。

RuCl3催化开环移位聚合反应,产生聚降冰片烯。
钌配合物用于转移氢化(有时称为借氢反应)的高活性催化剂。该方法用于酮、醛和亚胺的不对称氢化。该反应利用手性钌配合物,它们是野依良治引入的。[48] 举个例子,(cymene)Ru(S,S-TsDPEN)催化氢化二苯基乙二酮,产生 (R,R)-氢化苯偶姻。在该反应中,甲酸盐和水/醇作为H2的来源:[49][50]

[RuCl(S,S-TsDPEN)(cymene)]催化的(R,R)-氢化苯偶姻(产率 100%,ee >99%)
野依良治于2001年授予诺贝尔化学奖,以表彰他在不对称氢化领域的贡献。
2012年,Masaaki Kitano及其同事使用有机钌催化剂展示了使用稳定的电子盐来作为电子供体和可逆氢储存进行氨合成。[51]
非勻相催化劑
新興應用
Intel 在自家半導體10nm製程上,在後端製程BEOL中首次使用金屬釕材料[53]。
对健康的影响
人们对钌对健康的影响知之甚少[54],因为人们遇到钌化合物的情况相对较少。[55]金属钌是化学惰性的。[54]一些像是四氧化钌(RuO4)的钌化合物有挥发性且剧毒。[55]
参考文献
外部連結
- 元素钌在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 钌(英文)
- 元素钌在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钌在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 钌(英文)




