Ռութենիում
Ռութենիում (լատին․՝ Ruthenium), քիմիական տարր է որի նշանն է Ru, տարրերի պարբերական համակարգի 5-րդ պարբերության 8-րդ խմբի տարր։ Կարգահամարը՝ 44, ատոմական զանվածը՝ 101,07։ Անցումային տարր է, պատկանում է պլատինային մետաղների շարքին։ d-տարր է, ատոմի էլեկտրոնային թաղանթի կառուցվածքն է 4s24p64d75s1։ К, L, М թաղանթները լրացված են։ Ռութենիումը սպիտակ արծաթափայլ մետաղ է։
| |||||
|---|---|---|---|---|---|
| Պարզ նյութի արտաքին տեսք | |||||
| Ատոմի հատկություններ | |||||
| Անվանում, սիմվոլ, կարգաթիվ | Ռութենիում / Ruthenium (Ru), Ru, 44 | ||||
| Խումբ, պարբերություն, բլոկ | 7, 5, | ||||
| Ատոմային զանգված (մոլային զանգված) | 101,07(2)[1] զ. ա. մ. (գ/մոլ) | ||||
| Էլեկտրոնային կոնֆիգուրացիա | [Kr] 4d7 5s1 | ||||
| Ատոմի շառավիղ | 134 պմ | ||||
| Քիմիական հատկություններ | |||||
| Կովալենտ շառավիղ | 125 պմ | ||||
| Իոնի շառավիղ | (+4e) 67 պմ | ||||
| Էլեկտրաբացասականություն | 2,2 (Պոլինգի սանդղակ) | ||||
| Էլեկտրոդային պոտենցիալ | 0 | ||||
| Օքսիդացման աստիճաններ | +3, +4, +6, +8, 0 | ||||
| Իոնացման էներգիա (առաջին էլեկտրոն) | 710,3 (7,36) կՋ/մոլ (էՎ) | ||||
| Պարզ նյութի թերմոդինամիկական հատկություններ | |||||
| Հալման ջերմաստիճան | 2334 °C (2607 K, 4233 °F) | ||||
| Եռման ջերմաստիճան | 4077 °C (4350 K, 7371 °F) | ||||
| Մոլյար ջերմունակություն | 24,0[2] Ջ/(Կ·մոլ) | ||||
| Մոլային ծավալ | 8,3 սմ³/մոլ | ||||
| Պարզ նյութի բյուրեղային ցանց | |||||
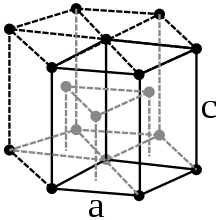
| Բյուրեղացանցի կառուցվածք | Վեցանկյուն | ||||
| Բյուրեղացանցի տվյալներ | a=2,706 c=4,282 | ||||
| Դեբայի ջերմաստիճան | 600 Կ | ||||
| Այլ հատկություններ | |||||
| Ջերմահաղորդականություն | (300 Կ) 117,0 Վտ/(մ·Կ) | ||||
| CAS համար | CAS գրանցման համար? | ||||
| 44 | Ռութենիում |
101,07 | |
| 4d75s1 | |
Պատմություն
Ռութենիումը հայտնաբերել է Կազանի համալսարանի պրոֆեսոր Կ․ Կ․ Կլաուսը (1844), բնածին պլատինի մաքրման մնացորդներում։ Հայտնաբերամ և ստացման հատկությունների մասին Կլաուսը հայտնել է Գ. Ի. Գեսսի գերմաներեն նամակում, որը կարդացել են 1844[3] թվականի սեպտեմբերի 13-ին Սանկտ Պետերբուրգի գիտությունների ակադեմիայի նիստում։
Անվան ծագում
Անվանել են ի պատիվ Ռուսաստանի[4][5] (լատին․՝ Ruthenia - Ռուսաստան)։ Ռութենիում տարրի անվանումը առաջարկել է Գ. Վ. Օզաննի կողմից 1828 թվականին։
Ստացում
Ռութենիումը ստանում են պլատինային մետաղների վերամշակման կիսապրոդուկտներից․ միահալում են ալկալու և բորակի կամ նատրիումի (բարիումի) գերօքսիդի հետ՝ հեռացող RuO4-ը կլանում են աղաթթվով, ապա նստեցնում ամոնիումի հեքսաքլոր ռութենատը՝ (NH4)2[RuCl6], որը վերականգնում են ջրածնի հոսանքում շիկացնելով։ Ստացվում է 99,9 % մաքրության փոշի։ Ռութենիումը և նրա համաձուլվածքները հալում են ինդուկցիոն կամ աղեղային վառարաններում (վակուում, արգոն)։
Արտադրության և պաշարներ
Ռութենիումի արտադրությունը 2009 թվականին կազմել է 17,9 տոննա[6],, համաշխարհային պաշարները գնահատվում է 5000 տոննա[7]։
| Ռութենիումի որոշ միացությունների բյուրեղացանցերի կաքռուցվածքը |
|---|
|
Բնության մեջ
Ռութենիումը հազվագյուտ և ցրված տարր է, պարունակությունը երկրակեղևում՝ 5•10−7 % (ըստ զանգվածի)։ Իզոմորֆ խառնուրդի ձևով պարունակվում է պլատինի միներալների հետ հանդիպող օսմիումական իրիդիումի խմբի միներալներում (0,2-20%) և պղինձնիկելային սուլֆիդային հանքանյութերում։ Առաջացնում է չափազանց հազվագյուտ լաուրիտ միներալը։ Ռութենիումը առաջանում և կուտակվում է միջուկային ռեակտորներում։

Ֆիզիկական հատկություններ

Ռութենիումը սպիտակ արծաթափայլ մետաղ է, հալման ջերմաստիճանը՝ 225±l0 °C, եռմանը՝ մոտ 4200 °C, խտությունը՝ 12370 կգ/մ3։ Ռութենիումի միաբյուրեղները պլաստիկ են։ Բազմաբյուրեղ ռութենիումը փխրուն է և չափազանց կարծր, պլաստիկ դեֆորմացման է ենթարկվում դժվարությամբ, անգամ 1800 °C-ից բարձր ջերմաստիճաններում։
Ռութենիումը քիմիապես պասսիվ է, չի լուծվում թթուներում և արքայաջրում, դասվում է ազնիվ մետաղների շարքը։ Միացություններում ցուցաբերում է 1-8 դրա կան օքսիդացման աստիճաններ (ամենից բնորոշ են +3, +4, +6 և +8)։
Քիմիական հատկություններ

Սովորական ջերմաստիճաններում օդում և թթվածնում չի օքսիդանում, տաքացնելիս օքսիդանում է մինչև երկօքսիդ՝ RuO2, երկարատև և ուժեղ շիկացնելիս՝ «գոլորշիանում է» ցնդող RuO4 առաջացնելու պատճառով։
Ru + O2 → RuO2Ռութենիումի (IV) օքսիդը՝ RuO2-ը սև կապտավուն փոշի է, չի լուծվում թթուներում, RuO4 (VIII) հեշտ ցնդող, ոսկեդեղին, բնորոշ սուր հոտով, թունավոր բյուրեղական նյութ է։ Հալվում է 25 °C-ում, փոխարկվելով նարնջագույն հեղուկի։ Ուժեղ օքսիդիչ է՝ օրգանական նյութերի հետ շփվելիս վերականգնվում է պայթյունով։
Ռութենիումը կալիումի հիդրօքսիդի և քլորատի հետ միահալելիս առաջանում է կալիումի ռութենատ K2RuՕ4։
Ստացվել են ռութենիումի (III) և (IV) օքսիդների հիդրատները, որոնք օդում օքսիդանում են։
Ռութենիումի փոշին ֆտորի, քլորի, ծծմբի և ֆոսֆորի հետ տաքացնելիս առաջանում են ֆտորիդ RuF5, քլորիդ՝ RuCl3, սուլֆիդ՝ RuS2 և ֆոսֆիդ՝ RuP2։
Ռութենիումը առաջացնում է բազմաթիվ կոմպլեքսային միացություններ։

Ռութենիումը միաձուլվում է բազմաթիվ մետաղների հետ՝ առաջացնելով պինդ լուծույթներ և ներմետաղական միացություններ։
Իզոտոպներ
| Միացություն | Գույն | Միացություն | Գույն |
|---|---|---|---|
RuCl2 | RuBr3 | ||
RuI2 | RuF3 | ||
RuF4 | RuF5 |
Բնական ռութենիումը բաղկացած է 96Ru (5,57 %), 98Ru (1,86%), 99Ru (18,7%), 100Ru (12,6%), 101Ru (17,1%), 102Ru (31,6%) և 104Ru (18,5%) կայուն իզոտոպներից[8][9]։
Ստացվել են 93-108 զանգվածի թվերով ռադիոակտիվ իզոտոպները, որոնք ուրանի և պլատինի միջուկային քայքայման արդյունքներն են։
103Ru (T1/2= 39,8 օր) և 106Ru (1,01 տարի) β-ռադիոակտիվ իզոտոպներն օգտագործվում են որպես նշանադրված ատոմներ։
Կիրառություն
Ռութենիումը մեծացնում է համաձուլվածքի կոռոզիակայունությունը և կարծրությունը։ Նրա համաձուլվածքնե րը Pt-ի և Pd-ի հետ օգտագործվում են չափիչ սարքերի մաշակայուն մասեր, հզոր և զգայուն էլեկտրական կոնտակտներ, ոսկերչական իրեր, Ir-ի հեա՝ ջերմազույգեր (մինչև 2000 °C) պատրաստելու համար։
Ռութենիումը և նրա համաձուլվածքները և օրգանական միացությունները, օրգանական և անօրգանական նյութերի սինթեզի բարձր ընտրողական կատալիզատորներ են։ Ռութենիումի միացություններն օգտագործվում են ճենապակին, ապակին և ջնարակները ներկելու համար։
Տես նաև
Ծանոթագրություններ
Գրականություն
- Cotton, Simon A. (1997). Chemistry of Precious Metals. New York: Springer. ISBN 978-0-7514-0413-5.
- Crabtree, Robert H. (2005). The Organometallic Chemistry of the Transition Metals (4η ed.). Yale University, New Haven, Connecticut: Wiley-Interscience. ISBN 0-4716-6256-9.
- Dabrowiak, James C. (2009). Metals in Medicine. John Wiley & Sons. ISBN 978-0-470-68197-8.
- Ebbing, Darrell D.; Gammon, Steven D. (2008). General Chemistry (9η ed.). Cengage Learning. ISBN 0-618-85748-6.
- Emsley, J. (2003). Nature's building blocks: an A-Z guide to the elements. Oxford University Press. ISBN 0-198-50340-7.
- Greenwood, Norman Neill; Earnshaw, Alan (1997). Chemistry of the Elements (2η ed.). Oxford: Butterworth–Heinemann. ISBN 0-7506-3365-4.
- Housecroft, Catherine E.; Sharpe, Alan G. (2005). Inorganic chemistry (2η ed.). Prentice Hall. ISBN 978-0-1303-9913-7.
- Krebs, R. E. (2006). The history and use of our earth's chemical elements: a reference guide. Greenwood Press. ISBN 978-0-4708-6403-6.
- Mackay, Ken M.; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to modern inorganic chemistry (6η ed.). CRC Press. ISBN 978-0-7487-6420-4. Վերցված է 20 Ιανουαρίου 2014-ին.
- Morrison, Robert Thornton; Boyd, Robert Neilson (1988). Οργανική Χημεία (3 Τόμοι) (4η ed.). Πανεπιστήμιο Ιωαννίνων. ISBN 0-1364-3669-2. Վերցված է 20 Ιανουαρίου 2014-ին.(չաշխատող հղում) (μετάφραση: Σακαρέλλος, Κωνσταντίνος; Πηλίδης, Γεώργιος Α.; Γεροθανάσης, Ιωάννης Π.; κ.ά.).
- Murahashi Shunʼichi (2004). Ruthenium in Organic Synthesis (2η ed.). Wiley - VCH. ISBN 3-527-30692-7.
- Pauling, Linus (1988). General Chemistry (3η ed.). Dover Publications. ISBN 978-04866-5622-9.
- Reed, Roger C. (2006). The Superalloys: Fundamentals and Applications. Cambridge University Press. ISBN 0-5218-5904-2.
- Weeks, Mary Elvira (1933). Discovery of the elements. Journal of Chemical Education. ISBN 0-766-13872-0.
- Wiberg, Egon; Holleman, Arnold Frederick; Wiberg, Nils; Aylett, Bernhard J.; Brewer, William & Eagleson, Mary (2001). Inorganic chemistry. San Diego, California: Academic Press. ISBN 0-123-52651-5. OCLC 833903147.
{{cite book}}: CS1 սպաս․ բազմաթիվ անուններ: authors list (link)
Արտաքին հղումներ
- Ռութենումը Webelements-ում
- Ռութենիումը քիմիական տարրերի հայտնի գրադարանում Արխիվացված 2007-09-30 Wayback Machine
- Ռութենումը onx.distant.ru կայքում Արխիվացված 2010-01-31 Wayback Machine
- Ռութենիումի իզոտոպները Արխիվացված 2010-12-15 Wayback Machine
- Ruthenium at The Periodic Table of Videos (University of Nottingham)
- Nano-layer of ruthenium stabilizes magnetic sensors Արխիվացված 2016-04-05 Wayback Machine
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ռութենիում» հոդվածին։ |