Hydrazine
| Hydrazine | |
 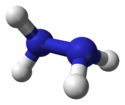 Dimensions et modèle 3D de l'hydrazine | |
| Identification | |
|---|---|
| Nom UICPA | hydrazine |
| Synonymes | diazane, diamine |
| No CAS | |
| No ECHA | 100.005.560 |
| No CE | 206-114-9 |
| PubChem | 8058 |
| SMILES | |
| InChI | |
| Apparence | liquide hygroscopique, incolore, fumant, d'odeur âcre[1]. |
| Propriétés chimiques | |
| Formule | N2H4 |
| Masse molaire[3] | 32,045 2 ± 0,000 7 g/mol H 12,58 %, N 87,42 %, |
| Moment dipolaire | 1,75 D [2] |
| Diamètre moléculaire | 0,390 nm [2] |
| Propriétés physiques | |
| T° fusion | 2 °C[1] |
| T° ébullition | 114 °C[1] |
| Solubilité | miscible à l'eau et aux solvants organiques polaires |
| Paramètre de solubilité δ | 37,3 MPa1/2 (25 °C)[4] 36,2 J1/2·cm-3/2 (25 °C)[2] |
| Masse volumique | 1 010 kg·m-3[1] |
| Point d’éclair | 38 °C (c.f.) [1] |
| Limites d’explosivité dans l’air | 1,8–100 %vol[1] |
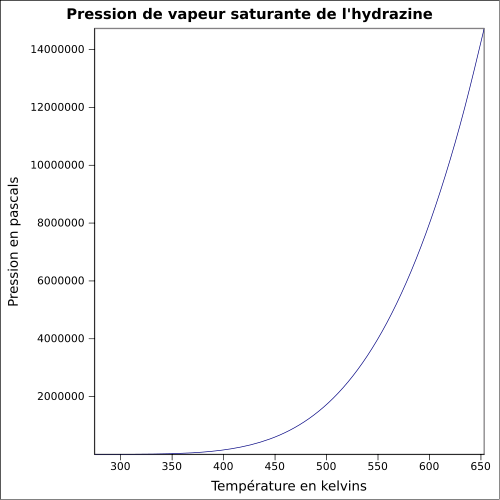
| Pression de vapeur saturante | anhydre : 21 mbar (20 °C), solution à 64 %m : |
| Viscosité dynamique | 0,9 mPa·s à 25 °C |
| Point critique | 147,0 bar, 379,85 °C [7] |
| Thermochimie | |
| S0gaz, 1 bar | 238,68 J·K-1·mol-1 [8] |
| S0liquide, 1 bar | 121,52 J·K-1·mol-1 [8] |
| ΔfH0gaz | 95,35 kJ·mol-1[8] |
| ΔfH0liquide | 50,63 kJ·mol-1[8] |
| ΔvapH° | 41,8 kJ·mol-1 (1 atm, 113,55 °C); 44,7 kJ·mol-1 (1 atm, 25 °C)[9] |
| Cp | |
| PCS | 667,1 kJ·mol-1 (25 °C, gaz)[10] |
| PCI | −622,08 kJ·mol-1 (gaz)[8] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,1 ± 0,15 eV (gaz)[11] |
| Propriétés optiques | |
| Indice de réfraction | 1,469 [2] |
| Précautions | |
| SGH[13],[14] | |
| H226, H301, H311, H314, H317, H331, H350, H410, P201, P261, P273, P280, P301+P310 et P305+P351+P338 | |
| SIMDUT[15] | |
   B3, D1A, D2A, E, | |
| NFPA 704 | |
| Autre | Peut attaquer le système nerveux. Mortel à hautes doses. |
| Transport[6] | |
| Classification du CIRC | |
| Groupe 2B : Peut-être cancérogène pour l'homme[12] | |
| Écotoxicologie | |
| LogP | -3,1[1] |
| Seuil de l’odorat | bas : 3 ppm haut : 4 ppm[16] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
L’hydrazine, de nom officiel diazane, de formule chimique N2H4 et de formule semi-développée H2N-NH2, est un composé chimique liquide incolore, avec une odeur rappelant celle de l’ammoniac. Elle est miscible à l'eau en toutes proportions.
Les hydrazines constituent également une famille de composés chimiques dérivés de l'hydrazine (H2N-NH2 par substitution d'un ou plus atomes H par des radicaux hydrocarbonés (par exemple la 2,4-dinitrophénylhydrazine).
La production annuelle de l'hydrazine est de 260 000 tonnes.[réf. nécessaire] La plus grande part de cette production est utilisée comme agent moussant pour la production de polymères expansés. Le reste de cette production se répartit dans différents secteurs comme la chimie organique pour la synthèse de médicaments ou la chimie inorganique pour la production d'azoture de sodium, l'agent explosif de gonflage des « airbags » (coussins gonflables de sécurité). L'hydrazine est également utilisable comme carburant des moteurs de fusée.
Structure moléculaire et propriétés
La structure de l'hydrazine se présente sous l’aspect de deux molécules d’ammoniac accouplées l’une à l’autre par enlèvement d'un hydrogène pour chacune des deux molécules. Chaque sous-unité -NH2 se présente sous une forme pyramidale. La distance entre les deux atomes d'azote est de 145 pm et la molécule adopte une conformation anticlinale[18]. Le moment de rotation est le double de celui de l’éthane. Ses propriétés structurelles ressemblent à celles du peroxyde d'hydrogène gazeux, qui adopte une conformation « asymétrique » analogue à une structure d'alcane linéaire, avec un moment de rotation élevé.
Elle possède les propriétés d’une base comparable à l’ammoniaque, mais 15 fois plus faible.
Le substituant sur chaque amine rend le doublet électronique moins disponible pour capter un proton et donc moins basique[19]. L'hydrazine est un meilleur nucléophile que l'ammoniac à cause de la répulsion entre les doublets non liants des atomes d'azote adjacents[20].
- N2H4 + H+ → [N2H5]+ ; K = 8,5 × 10-7 (pour l’ammoniaque, K = 1,78 × 10−5).
La deuxième protonation est plus difficile[21]:
- [N2H5]+ + H+ → [N2H6]2+ ; K = 8,4 × 10-16
L'hydrazine est un réducteur beaucoup plus fort en milieu basique qu'en milieu acide. (E=-0,23 V à pH=0 et E=-1,16 V à pH=14)[19]. Lorsque l'hydrazine réagit avec des oxydants, divers produits azotés peuvent se former mais en général, il s'agit de diazote. La réaction de l'hydrazine avec le dioxygène forme du diazote et de l'eau, tout en dégageant une grande quantité de chaleur.
L'hydrazine N2H4 se dégrade sous l'action de la chaleur et des rayons ultraviolets en azote N2, hydrogène H2 et ammoniac NH3.
Certains sels d'hydrazine sont explosifs : nitrate d'hydrazine, chlorate d'hydrazine, perchlorate d'hydrazine et azoture d'hydrazonium[22].
Propriétés physico-chimiques
L'hydrazine anhydre est un liquide incolore fumant à l'air avec une odeur aminée. Le seuil olfactif est de 3 ppm.
Synthèse
Theodor Curtius synthétisa l’hydrazine simple pour la première fois en 1889 par un biais détourné[23].
L’hydrazine est produite par le procédé d’Olin Raschig à partir de l’hypochlorite de sodium et de l'ammoniac, une méthode inventée en 1907. Ce procédé repose sur la réaction des chloramines avec l'ammoniac[24].
- La monochloramine nécessaire étant préalablement produite par la réaction :
Une variante du procédé d’Olin Raschig est l'oxydation de l’urée par l’hypochlorite de sodium [25]:
Dans le cycle Atofina-PCUK, l'hydrazine est fabriquée en plusieurs étapes à partir d’acétone, d'ammoniaque et de peroxyde d'hydrogène. L’acétone et l'ammoniaque réagissent d’abord pour donner une imine, réaction suivie d’une oxydation par le peroxyde d'hydrogène en oxaziridine, un hétérocycle à trois atomes comportant un atome de carbone, un atome d'azote et un atome d'oxygène, suivie d’une ammoniolyse qui conduit à l’hydrazone, un processus qui assemble deux atomes d'azote. L’hydrazone réagit avec l'acétone en excédent, et l'acétone azine produite est hydrolysée pour former l'hydrazine, en régénérant l’acétone. Contrairement au procédé de Raschig, cette méthode ne génère pas de sel. PCUK est associé à Ugine Kuhlmann, un fabricant français de produits chimiques[26].
L’hydrazine peut aussi être produite par une méthode connue sous le nom de procédé kétazine et peroxyde.
En 2001, Marc Strous, microbiologiste à l'université de Nimègue aux Pays-Bas, a découvert que l'hydrazine est produite par des levures et une bactérie océanique, Brocadia anammoxidans, par une réaction d’anammox réalisée dans des organites spécialisés appelés anammoxosomes. Ce sont les seuls organismes vivants actuellement connus capables de produire naturellement de l’hydrazine[27],[28].
Dérivés
On connaît de nombreux dérivés par substitution de l’hydrazine, et plusieurs d’entre eux sont produits naturellement. Quelques exemples :
- la gyromitrine (en) et l’agaritine (en) sont des phénylhydrazines retrouvées chez une espèce de champignons cultivés et commercialisés l’agaricus bisporus. La gyromitrine est métabolisée en monométhylhydrazine ;
- l’iproniazide, l’hydralazine et la phénelzine (en) sont des médicaments fabriqués à partir de l’hydrazine ;
- la 1,1-diméthylhydrazine (UDMH) et la 1,2-diméthylhydrazine (en) sont des hydrazines où deux atomes d'hydrogène sont remplacés par des groupes méthyles ;
- la 2,4-dinitrophénylhydrazine (2,4-DNPH) est couramment utilisée pour des tests sur les cétones et les aldéhydes en chimie organique ;
- la phénylhydrazine, C6H5NHNH2, est la première hydrazine à avoir été découverte.
Utilisation en chimie
Les hydrazines sont utilisées dans la synthèse de nombreuses molécules organiques et beaucoup d’entre elles ont une importance pratique dans l’industrie pharmaceutique, comme antituberculeux, ainsi que dans les textiles comme colorant et dans la photographie.
On la trouve aussi dans l'industrie en général et plus particulièrement mélangée à l'eau alimentaire pour chaudière vapeur. Elle a pour but de détruire les dernières molécules d'oxygène et ainsi éviter la corrosion des lignes de vapeur en acier.
Réaction avec les carbonyles
Pour illustrer la condensation de l'hydrazine avec un radical carbonyle, citons la réaction avec l’acétone qui conduit à la formation de diisopropylidène hydrazine. Celle-ci réagit encore avec l'hydrazine pour former une hydrazone [29]:
- 2 (CH3)2CO + N2H4 → 2 H2O + [(CH3)2C=N]2.
- [(CH3)2C=N]2 + N2H4 → 2 (CH3)2C=N–NH2.
L'acétone et la diisopropylidène hydrazine sont des intermédiaires dans la synthèse PCUK-Atofina. L’alkylation directe des hydrazines avec les halogénoalcanes en présence d’une base forme des dérivés alkylés des hydrazines, mais la réaction est généralement inefficace en raison d’un mauvais contrôle sur le niveau de substitution (comme pour les Amines ordinaires). La réduction de l’hydrazone en hydrazine constitue une façon élégante de produire des hydrazines 1,1 dialkylées.
Dans une autre réaction, la 2-cyanopyridine réagit avec l'hydrazine pour former des hydrazides amidées qui peuvent être converties en triazines en utilisant les 1,2-dicétones.
Réaction de Wolff-Kishner
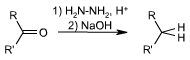
L’hydrazine est utilisée en chimie organique dans la réduction de Wolff-Kishner, une réaction qui transforme le groupe carbonyle d'une cétone ou d’un aldéhyde en pont méthylène (ou groupe méthyle) par l'intermédiaire d'une molécule d’hydrazone. La production de diazote très stable à partir de l'hydrazine favorise la réaction.
Synthèse des molécules polycycliques
Ayant deux fonctions amines, l’hydrazine est une pièce maîtresse pour la préparation de nombreux composés hétérocycliques via la condensation avec une partie possédant deux fonctions électrophiles. Avec l’acétylacétone, il se condense pour donner le 3,5-diméthylpyrazole[30]. Dans la réaction d’Einhorn-Brunner, les hydrazines réagissent avec les imides pour donner des triazoles.
Sulfonation
Étant un bon nucléophile, N2H4 est vulnérable à l'attaque des halogénures de sulfonyle et des halogénures d'acyle[31]. Le tosyl hydrazine forme aussi des hydrazones après traitement avec des carbonyles.
Découpage des phthalimides
L’hydrazine est utilisée pour découper la N-phthalimide en dérivés alkylés. Cette réaction de scission permet à l’anion phthalimide d'être utilisé comme précurseur d'amine dans la synthèse de Gabriel[32].
Agent réducteur
L’hydrazine est un réducteur apprécié parce que ses sous-produits de décomposition sont généralement l'azote gazeux et l'eau. Ainsi, elle est utilisée comme antioxydant, désactiveur d’oxygène et inhibiteur de corrosion dans l'eau des chaudières et des circuits de chauffage (dans ce rôle, on lui préfère désormais la N,N-diéthylhydroxylamine, de moindre toxicité, mais elle est encore abondamment utilisées contre la corrosion dans les grandes centrales thermiques et nucléaires notamment[33]). Elle est aussi utilisée pour réduire les sels de métaux et d'oxydes de métaux à l’état métallique dans l’électrolyse du nickel ainsi que dans l’extraction du plutonium à partir de combustibles nucléaires usés.
Sels d’hydrazine
L’hydrazine est convertie en sels solides au moyen d’un traitement par les acides minéraux. Le sel le plus répandu est l'hydrogénosulfate d'hydrazine, N2H5HSO4, qui devrait probablement être appelé bisulfate d’hydrazine. Le bisulfate d’hydrazine est utilisé comme traitement alternatif de la cachexie induite par le cancer. Le sel de l'hydrazine et de l’acide azothydrique N5H5 avait un intérêt scientifique, en raison de sa forte teneur en azote et de ses propriétés explosives.
La réaction de l'hydrazine avec l'acide nitrique est extrêmement violente, elle est d'ailleurs utilisée comme base dans les moteurs-fusée à ergols liquides et produit le nitrate d'hydrazine.
Utilisations industrielles
L’hydrazine est utilisée dans de nombreux procédés, par exemple la production de fibres d’élasthanne, comme catalyseur de polymérisation, agent gonflant, pour les piles à combustibles, comme flux de brasage pour le soudage, comme stabilisant dans certains procédés couleur argentiques, comme prolongateur de chaîne pour la polymérisation du polyuréthane, comme composé réducteur pour le conditionnement de l'eau des centrales thermiques et des circuits secondaires des centrales nucléaires et comme stabilisateur de chaleur. En outre, une technique utilisant des dépôts d'hydrazine sur les semi-conducteurs a été récemment expérimentée, avec une possible application à la fabrication des thin-film transistors utilisés pour les écrans à cristaux liquides. L’hydrazine en solution à 70 % avec 30 % d'eau est utilisée pour alimenter l'EPU (unité d'alimentation d'urgence), sur les avions de chasse F-16 (General Dynamics F-16 Fighting Falcon).
En usage militaire, un dérivé de l'hydrazine, la diméthylhydrazine asymétrique (UDMH), combiné avec du nitrate d'ammonium est l'ingrédient de base de l’astrolite (en), un explosif extrêmement puissant inventé dans les années 1960.
Carburant pour fusées
L’hydrazine fut d'abord utilisée comme carburant pour fusées lors de la Seconde Guerre mondiale pour les avions Messerschmitt Me 163 (le premier avion-fusée), sous le nom de B-Stoff (en fait, de l'hydrate d'hydrazine). Ce B-Stoff était mélangé à du méthanol (M-Stoff) pour donner du C-Stoff, lequel était utilisé comme carburant avec du T-Stoff, un concentré de peroxyde d'hydrogène, utilisé comme comburant au contact duquel il s'enflammait spontanément en une réaction très énergétique.
Aujourd'hui, l'hydrazine est utilisée généralement seule comme monergol dans les moteurs à faible poussée (mais grande précision) permettant le positionnement sur orbite des satellites et des sondes spatiales ; dans ce cas, la poussée est assurée par décomposition catalytique de l'hydrazine et non par combustion. Cette décomposition est en effet une réaction très exothermique. Elle est obtenue en faisant passer l'hydrazine sur un catalyseur dont le composant actif est l'iridium métallique déposé sur une grande surface d’alumine (oxyde d'aluminium), ou de nanofibres de carbone[34], ou plus récemment le nitrure de molybdène sur l'alumine[35], voire du nitrate de molybdène. Sa décomposition en ammoniac, diazote et dihydrogène résulte des réactions suivantes :
Cette décomposition se déclenche en quelques millisecondes et permet de doser la poussée de façon très précise. Ces réactions sont très exothermiques (le catalyseur de la chambre peut atteindre 800 °C en quelques millisecondes[34]), et produisent un gros volume de gaz chauds à partir d’un faible volume d’hydrazine liquide[35], ce qui en fait un bon propergol pour la propulsion spatiale.
Certains dérivés de l'hydrazine sont également employés comme ergols liquides : la monométhylhydrazine H2N–NHCH3 (ou MMH), et la diméthylhydrazine asymétrique, H2N–N(CH3)2 (ou UDMH). Ils sont généralement utilisés avec le peroxyde d'azote N2O4 comme oxydant, avec lequel ils forment un propergol liquide stockable hypergolique.
Piles à combustible
Le fabricant italien de catalyseur Acta a proposé d'utiliser l’hydrazine comme solution alternative à l'hydrogène dans les piles à combustibles. Le principal avantage de ce produit est sa capacité à produire plus de 200 mW/cm2, davantage qu’une pile à hydrogène similaire sans nécessité de recourir à de coûteux catalyseurs contenant du platine. Comme le combustible est liquide à température ambiante, il peut être manipulé et stocké plus facilement que l'hydrogène. En stockant l'hydrazine dans un réservoir contenant un carbonyle avec une double liaison carbone oxygène, le combustible réagit et forme une matière solide et sûre appelé hydrazone. Ensuite il suffit de remplir le réservoir avec de l'eau chaude pour libérer l’hydrate d'hydrazine sous forme liquide. La manipulation d’un combustible liquide est en pratique beaucoup plus sûre que de celle de l'hydrogène gazeux, et le liquide a un plus grand potentiel d'oxydo-réduction (1,56 V) comparativement à 1,23 V pour l'hydrogène. La molécule d’hydrazine est cassée dans la pile pour former du diazote et des atomes d'hydrogène qui se lient à un atome d’oxygène pour former de l’eau[36].
Sécurité
Toxicité, écotoxicité
L'hydrazine est hautement toxique et dangereusement instable, surtout sous sa forme anhydre. On l'utilise généralement sous forme de monohydrate stable.
Les symptômes d'une exposition aiguë à des niveaux élevés d'hydrazine peuvent se manifester chez l'homme par l'irritation des yeux, du nez et de la gorge, des étourdissements, des céphalées, des nausées, un œdème pulmonaire, des convulsions, un coma. Une exposition aiguë peut également endommager le foie, les reins et le système nerveux central chez l'homme. Le liquide est corrosif et peut produire un eczéma de contact chez les humains et les animaux. Des effets nocifs pour les poumons, le foie, la rate et la thyroïde ont été rapportés chez des animaux exposés de façon chronique à l'hydrazine par inhalation. Une augmentation du nombre de cas de tumeur du poumon, de la cavité nasale, et du foie a été observée chez les rongeurs exposés à l'hydrazine.
Sa toxicité fait l'objet de réévaluations[37] périodiques, avec l'évolution des connaissances[38].
Un dérivé de l’hydrazine a également été mis en cause dans une étude scientifique, reliant la consommation d’un champignon, Gyromitra esculenta, contenant cette toxine à un cluster de cas de SLA (anciennement appelée maladie de Charcot)[39].
Précautions pour le stockage
Références
Articles connexes
Liens externes
- The Late Show with Rob! Tonight’s Special Guest: Hydrazine (PDF) — Robert Matunas
- xMSDS-Hydrazine-9924279 (PDF) — MSDS for hydrazine
- (fr) Fiche toxicologique de l'INRS
- (fr) Fiche internationale de sécurité