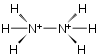
Idrazina
L'idrazina (nome IUPAC sostitutivo: diazano)[3] è un composto binario dell'azoto con l'idrogeno, quindi anche un idruro di azoto e tra questi è il più semplice che contenga un legame singolo N-N. La sua formula bruta è N2H4 e quella di struttura è H2N−NH2. A temperatura ambiente è un liquido incolore volatile, dall'odore pungente che ricorda l'ammoniaca e che fuma all'aria; è inoltre infiammabile, corrosivo, tossico.[4]
| Idrazina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diazano | |
| Nomi alternativi | |
| diammina diammide idruro di azoto | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2H4 |
| Massa molecolare (u) | 32,1 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 206-114-9 |
| PubChem | 9321 |
| SMILES | NN |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,01 |
| Solubilità in acqua | completa |
| Temperatura di fusione | 2 °C (275 K) |
| Temperatura di ebollizione | 113 °C (386 K) |
| Tensione di vapore (Pa) a 293 K | 1400 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 50,63 (liq) |
| ΔfG0 (kJ·mol−1) | 159,4 |
| S0m(J·K−1mol−1) | 121,52 (liq) |
| C0p,m(J·K−1mol−1) | 48,4 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 38 °C (311 K) |
| Limiti di esplosione | 1,8 - 100% vol. |
| Temperatura di autoignizione | variabile a seconda del supporto: da 24 °C (297 K) a contatto con superfici di ferro arrugginito a 270 °C (435 K) su lastre di vetro. |
| Simboli di rischio chimico | |
     | |
| Frasi H | 226 - 350 - 301 - 310 - 330 - 314 - 317 - 410 |
| Consigli P | 301+310 - 303+361+353 - 305+351+338 - 320 - 361 - 405 - 501 [1][2] |

È solubile in acqua in ogni rapporto, come pure negli alcoli metanolo, etanolo, n-propanolo e isobutanolo.[4] L'idrazina, come l'ammoniaca, è una base (sebbene più debole), ma è biprotica e può quindi formare due serie di sali: con l'acido cloridrico, ad esempio, forma N2H5Cl e N2H6Cl2.[5]
Con il termine idrazine ci si riferisce a una classe di composti organici derivati dall'idrazina per sostituzione di uno o più atomi d'idrogeno con uno o più gruppi organici R , alchilici o arilici, aventi formula di struttura R2N−NR2).[6]
Tossicità
È una sostanza corrosiva, tossica e cancerogena: la soglia di contaminazione dell'aria è di 1 ppm, mentre la soglia olfattiva (oltre la quale l'odore è avvertibile) è di 3-5 ppm: già a 20 °C i vapori possono raggiungere tali concentrazioni. A temperature superiori ai 38 °C, se i vapori non vengono dispersi, la miscela aria-vapori di idrazina può raggiungere concentrazioni tali da essere esplosiva.
Sintomi
I sintomi immediati del contatto con l'idrazina sono dovuti alla corrosività della sostanza: quindi bruciore, e nel caso di inalazione dei vapori, tosse, capogiro e difficoltà respiratoria: tali sintomi possono presentarsi anche a distanza di 10-12 ore dal contatto.
La tossicità è a carico del fegato, dei reni e del sistema nervoso centrale: i sintomi di un avvelenamento da idrazina sono nausea, vomito, debolezza, confusione, stato di incoscienza. Se l'avvelenamento è avvenuto per inalazione di vapori si può avere edema polmonare acuto. L'ingestione può essere letale.
Proprietà chimiche
Chimicamente è una base medio forte e un forte nucleofilo; reagisce violentemente con altri ossidanti, con molti metalli e ossidi.
Ioni dell'idrazina
L'idrazina possiede una certa tendenza a protonarsi; a seconda dei casi può subire una protonazione singola o doppia con la formazione rispettivamente del catione idrazinio e dell'idrazinio dicatione[7].
Idrazinio
L'idrazinio (conosciuto anche come diazanio[8]) è un catione di formula N2H5+ derivato dalla protonazione dell'idrazina
- H2N-NH2 + H+ → H3N+-NH2
L'idrazinio rappresenta la forma ionica principale impiegata nella preparazione dei sali di idrazina, come ad esempio il solfato di idrazina o il HNF.
Idrazinio dicatione
L'idrazinio dicatione è un catione di formula N2H62+. Presenta due cariche positive nette dislocate sugli atomi di azoto, cariche che derivano dalla doppia protonazione dell'idrazina
- H2N-NH2 + 2H+ → H3N+-N+H3
Utilizzi
Viene impiegata (dato che è ipergolica, ovvero reagisce violentemente con agenti ossidanti) come combustibile per missili e per razzi di controllo orbitale e d'assetto, nei satelliti artificiali ed è stata utilizzata negli Space Shuttle. Trova uso anche nella fabbricazione di alcuni esplosivi a base liquida chiamati astroliti.
L'idrazina si decompone a temperature elevate in presenza di ossigeno liberando azoto e acqua: viene perciò usata come additivo nell'acqua delle caldaie ad alta pressione per deossigenarla ed evitarne la corrosione delle pareti.
Alcuni aerei militari (ad esempio gli F-16 che sono stati in dotazione all'Aeronautica Militare Italiana) utilizzano piccole turbine a gas, dette EPU (Emergency Power Unit), alimentate a idrazina (H-70: miscela di idrazina/acqua 30%/70%), da utilizzarsi come generatore elettrico e idraulico di emergenza in caso di avaria dei generatori principali.
Viene utilizzata anche come rivelatore in fotografia tradizionale al nitrato d'argento.[9]
Reazioni tipiche
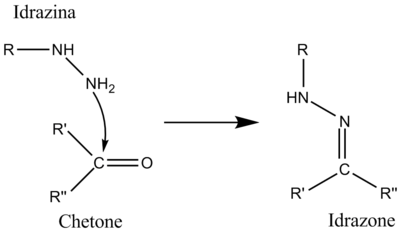
Addizione nucleofila di idrazine a chetoni
L'idrazina è un composto molto nucleofilo perché i due atomi di azoto si influenzano a vicenda (effetto alfa).La reazione avviene solo con composti chetonici o aldeidici ed è perciò selettiva, può essere infatti usata per separare chetoni e/o aldeidi da altri composti.Si usa spesso la 2,4-dinitrofenilidrazina.
Anammox
L'idrazina è un intermedio metabolico del processo Anammox, l'ossidazione anossica dell'ammoniaca portata avanti da alcuni batteri (ex: Brocadia anammoxidans).[10] L'idrazina viene sintetizzata dall'enzima idrazina idrolasi a partire da ossido di azoto e ione ammonio. L'idrazina viene a sua volta ossidata ad azoto diatomico dall'enzima idrazina deidrogenasi.[11]
Derivati dell'idrazina
- fenilidrazina
- monometilidrazina (MMH)
- dimetilidrazina asimmetrica (UDMH o 1,1-dimetilidrazina) e dimetilidrazina simmetrica (1,2-dimetilidrazina)
- 4-nitrofenilidrazina
Note
Voci correlate
Altri progetti
 Wikizionario contiene il lemma di dizionario «idrazina»
Wikizionario contiene il lemma di dizionario «idrazina» Wikimedia Commons contiene immagini o altri file su idrazina
Wikimedia Commons contiene immagini o altri file su idrazina
Collegamenti esterni
- Idrazina, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
- (EN) hydrazine / nitrogen hydride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 19285 · LCCN (EN) sh85063355 · GND (DE) 4160873-2 · BNF (FR) cb12216776m (data) · J9U (EN, HE) 987007533633005171 · NDL (EN, JA) 00563141 |
|---|