Dystrofia mięśniowa Duchenne’a
Choroba Duchenne’a, dystrofia mięśniowa Duchenne’a/Beckera (łac. dystrophia progressiva pseudohypertrophica, DMD/BMD) – choroba genetyczna powodująca postępującą i nieodwracalną dystrofię (zanik) mięśni. Jest to najczęściej spotykana forma dystrofii mięśniowej. Po raz pierwszy została opisana przez francuskiego neurologa Guillaume’a Benjamina Amanda Duchenne’a w roku 1861.
| Dystrophia progressiva pseudohypertrophica | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|

Występowanie
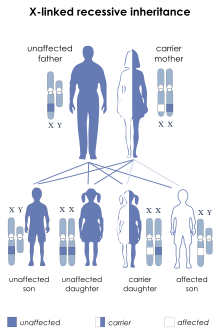
Dystrofia mięśniowa Duchenne’a/Beckera to najczęstsza dziedziczona recesywnie choroba sprzężona z płcią[1][2], na którą chorują niemal wyłącznie chłopcy. Częstość występowania wynosi ok. 1:5000 urodzeń chłopców[3]. Łagodniejsza postać – dystrofia mięśniowa Beckera (BMD) występuje z częstością ok. 1:22 000[4]. Istnieją zaledwie pojedyncze przypadki DMD u dziewczynek, ponieważ mutacja warunkująca chorobę musi wystąpić na obu chromosomach X jednocześnie. Częściej może pojawić się u dziewczynek z zespołem Turnera (jeden chromosom X)[5].
W ⅔ przypadków DMD/BMD jest skutkiem mutacji przekazywanej synowi przez matkę, która jest nosicielką defektywnego genu recesywnego, a w pozostałych choroba wywołana jest nowo powstałą mutacją. Spotyka się także przypadki mozaicyzmu germinalnego.
Przyczyna
Obie postacie choroby uwarunkowane są uszkodzeniem w allelu recesywnym położonym na chromosomie X (prążek Xp21). Są to różne mutacje genu DMD kodującego białko dystrofinę – zazwyczaj stwierdza się delecje jednego lub więcej egzonu (60%), duplikacje (5–10%) i mutacje punktowe (30–35%). Dystrofina wraz z kompleksem innych białek łączy włókna aktynowe z błoną komórkową, a także bierze udział w przekazywaniu sygnałów w komórkach. Jej brak powoduje osłabienie błony komórkowej, która pozwala na przenikanie jonów wapnia i śmierć komórek mięśniowych. W DMD mutacje powodują przesunięcie ramki odczytu i całkowity brak dystrofiny w mięśniach, natomiast w BMD występuje skrócona wersja dystrofiny, dzięki czemu choroba ma lżejszy przebieg.
Objawy i rokowania
Choroba ma charakter postępujący. Początkowo obejmuje mięśnie szkieletowe, a potem także mięsień sercowy – prowadząc do jego osłabienia (kardiomiopatiia). Pierwsze objawy występują w wieku 2–8 lat[6]. Należy do nich m.in. opóźniony rozwój ruchowy, trudności z bieganiem i chodzeniem po schodach oraz trudności we wstawaniu z pozycji leżącej lub siedzącej. Chorzy, aby łatwiej wstać pomagają sobie rękoma opierając się dłońmi na kolanach i udach (objaw Gowersa). Z czasem dzieci zaczynają chodzić na palcach wskutek przykurczów ścięgien Achillesa i osłabienia mięśni nóg. Do innych objawów należy skrzywienie kręgosłupa - skolioza i lordoza lędźwiowa oraz tzw. przerost rzekomy (pseudohipertrofia) mięśni łydek, gdzie tkanka mięśniowa zastępowana jest przez tkankę łączną i tłuszczową[7]. W wieku 12 lat większość chorych nie jest już w stanie samodzielnie chodzić. Oprócz tego, u blisko 40% osób z DMD i 12% z BMD występują trudności w nauce lub lekkie opóźnienie w rozwoju umysłowym[8][9].
Wraz z postępami w medycynie, średnia długość życia chorych na dystrofię Duchenne’a znacznie wzrosła i obecnie coraz częściej przekracza 30 lat[10]. Jednak odpowiednia i staranna opieka zdrowotna może ten czas znacznie wydłużyć. Niezbędna jest fachowa rehabilitacja, do której należą ćwiczenia mięśni oddechowych oraz dbanie o prawidłową postawę (w tym dobrze dobrany wózek). Znane są przypadki osób, które żyły ponad 50 lat[11]. Oczekiwana długość życia dzisiejszych dzieci z DMD jest znacznie wyższa niż dawniej i z roku na rok ciągle się wydłuża. Duże znaczenie ma tutaj stan mięśnia sercowego, więc ważne są regularne badania, w szczególności echo serca powtarzane przynajmniej raz w roku[12]. Pomimo, że nie u każdego z chorych występuje kardiomiopatia, to bardzo istotne jest, rozpoczęcie leczenia od razu po wykryciu pierwszych objawów. Do śmierci dochodzi najczęściej w wyniku niewydolności oddechowej lub niewydolności krążenia. W przypadku dystrofii mięśniowej Beckera objawy występują między 5. a 25. rokiem życia. Przebieg choroby jest łagodniejszy, a czas życia pacjentów jest dłuższy. Z odmianą tą można żyć do późnego wieku.
Kardiomiopatia w niewielkim stopniu może występować również u matek osób chorych na dystrofię Duchenne'a, ale nie jest ona niebezpieczna dla zdrowia[13]. Zaleca się jednak przeprowadzanie badań.
Diagnostyka
- badania genetyczne na obecność mutacji w genie kodującym dystrofinę (także badania prenatalne)
- badania biochemiczne (badanie aktywności kinazy kreatynowej w surowicy)
- biopsja mięśnia (cechy miopatii, brak lub nieprawidłowa dystrofina w badaniu immunocytochemicznym)
- EMG
- EKG
- echo serca
- Spirometria
- Gazometria
Diagnostyka preimplantacyjna
Diagnostyka preimplantacyjna pozwala wykryć mutację jeszcze przed implantacją zarodka w jamie macicy. W przypadku obecności mutacji, można zrezygnować z implantacji zarodka obciążonego tą jednostką chorobową[14].
Leczenie
Jak dotąd nie ma skutecznej terapii leczącej dystrofię mięśniową. Terapia sterydami we wczesnych etapach może opóźniać postęp choroby[15]. Nowoczesne metody rehabilitacji, połączone z zabiegami ortopedycznymi, mogą wydłużyć zdolność do utrzymywania pozycji stojącej. Nie oznacza to jednak utrzymania zdolności samodzielnego chodzenia. Poradnictwo genetyczne powinno obejmować wszystkie rodziny, w których stwierdzono występowanie DMD lub BMD.
Od lat 90. prowadzone są badania nad rozwojem terapii genowej dla DMD i BMD. Badania prowadzone na myszach modelowych mdx pozwoliły na przetestowanie wielu strategii terapeutycznych. Od około 2005 roku możliwe jest wyleczenie myszy mdx z dystrofii mięśniowej. Niestety jakiekolwiek próby przeniesienia terapii genowej na leczenie pacjentów, w tym z zastosowaniem nowoczesnej technologii Crispr/Cas, nie powiodły się jak dotychczas.
Aktualnie prowadzone są testy kliniczne lub przedkliniczne terapii na dystrofię DMD z zastosowaniem metody tzw. exon skipping (modyfikowane oligo lub morfolino oligo), terapie komórkami macierzystymi oraz klasyczna terapia genowa (w tym exon skipping, rekombinacja homologiczna czy wymiana genu).
