Salétromossav
| Salétromossav | |
 Salétromossav | |
 | |
| Más nevek | Salétromossav |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 7782-77-6 |
| Kémiai és fizikai tulajdonságok | |
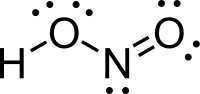
| Kémiai képlet | HNO2 |
| Moláris tömeg | 47,0134 g/mol |
| Sűrűség | ? g/cm³ |
| Savasság (pKa) | 3,29[1] |
| Veszélyek | |
| EU osztályozás | nincs besorolva |
| Rokon vegyületek | |
| Azonos kation | Salétromsav |
| Azonos anion | Nátrium-nitrit Kálium-nitrit Ammónium-nitrit |
| Rokon vegyületek | Dinitrogén-trioxid |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A salétromossav (HONO vagy HNO2) a nitrogén egyik oxosava, savanhidridje a dinitrogén-trioxid (N2O3). Színtelen, szúrós szagú folyadék, egyértékű, középerős sav. Tiszta állapotban még nem állították elő, de híg vizes oldatban és alacsony hőmérsékleten jól ismert és fontos reagens.
Kémiai tulajdonságai
A salétromossav bomlékony vegyület. A bomlás melegítés hatására is végbemegy, de akár homok vagy üvegszilánk is kiválthatja. A bomlás termékei a salétromsav, a víz és a nitrogén-monoxid.
A képződő nitrogén-monoxid reakcióba lép a levegő oxigénjével, és vörösbarna színű nitrogén-dioxiddá oxidálódik. A képződő nitrogén-dioxid miatt viselkedhet különösen a töményebb salétromossav oxidálószerként.
Köztes oxidációs állapotú vegyület, ezért oxidáló és redukáló hatású is lehet. Enyhe oxidálószer, a jodidiont jóddá oxidálja. A reakciója hidrogén-jodiddal a következő:
A kén-hidrogént kénné oxidálja, ammóniával reagálva nitrogénné alakul.
Viselkedhet redukálószerként is, ekkor salétromsavvá oxidálódik. A kálium-permanganátot például redukálja. Az aromás aminokat diazóniumsókká alakítja, ezért szerves festékek előállítására használják.
Sóképzés
Egyértékű savként viselkedik.
A salétromossav sói a nitritek, ezek NO−2 (nitrit) aniont tartalmaznak, általában vízben oldhatóak. A természetben gyakoriak, legnagyobb jelentősége a tartósítószerként használatos nátrium-nitritnek (NaNO2) van. Vizes oldatuk többnyire lúgos kémhatású, mert a nitrition protont képes felvenni a vízmolekuláktól.
A nitritek mérgező hatásúak, mert a vér hemoglobinját methemoglobinná alakítják.
Előállítása
A dinitrogén-trioxid vízben oldva salétromossavat ad, de mivel a savanhidrid is igen ritka (már -10 °C felett bomlik), ezért a salétromossav legkönnyebben a sójából (például nátrium-nitritből) szabadítható fel, kénsavval.
Előfordulása
A salétromossav a természetben kis mennyiségben fordul elő, sói viszont nagymértékben megtalálhatóak.
Felhasználása
A salétromossavat a szerves vegyiparban alkalmazzák az azofestékek gyártásakor. A reakcióját kálium-permanganáttal az analitikai kémiában használják térfogatos elemzésekre.
Források
- Erdey-Grúz Tibor: Vegyszerismeret
- Nyilasi János: Szervetlen kémia






