Azotasta kiselina
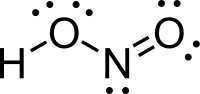
Azotasta kiselina (nitritna kiselina) je jedinjenje sa molekulskom formulom HNO2). Ona je slaba i monobazina kiselina koja je poznata samo u rastvoru i u obliku nitritnih soli.[6][7]
| Azotasta kiselina | |||
|---|---|---|---|
 | |||
Nitrous acid | |||
| Naziv po klasifikaciji | Hidroksidooksidoazot | ||
| Identifikacija | |||
| CAS registarski broj | 7782-77-6 | ||
| PubChem[1][2] | 24529 | ||
| ChemSpider[3] | 22936 | ||
| EINECS broj | |||
| KEGG[4] | |||
| MeSH | |||
| ChEBI | 25567 | ||
| ChEMBL[5] | CHEMBL1161681 | ||
| Gmelin Referenca | 983 | ||
| 3DMet | B00022 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | HNO2 | ||
| Molarna masa | 47.013 g/mol | ||
| Agregatno stanje | bledo plavi rastvor | ||
| Gustina | Aproksimativno 1 g/ml | ||
| Tačka topljenja | Poznata je samo u rastvoru | ||
| pKa | 3.398 | ||
| Opasnost | |||
| EU-indeks | nije na listi | ||
| Tačka paljenja | nije zapaljiva | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Azotna kiselina | ||
| Drugi katjoni | Natrijum nitrit Kalijum nitrit Amonijum nitrit | ||
| Srodna jedinjenja | Diazot trioksid | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Azotasta kiselina se koristi za pravljenje diazida iz amina. Do toga dolazi nukleofilnim napadom amina na nitrit, reprotonacijom uz pomoć rastvarača, i dvostrukom eliminacijom u vodi. Diazid se zatim oslobađa i daje karben ili karbenoid.
Struktura
U gasovitoj fazi, planarni molekul azotaste kiseline može da poprimi cis i trans formu. Trans forma je predominatna na sobnoj temperaturi, i IR merenja ukazuju da je stabilnija za oko 2.3 kJ mol−1.[8]
 | 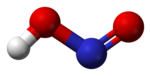 | 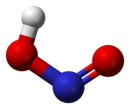 |
(sa mikrotalanog spektra) |
Priprema
Azotasta kiselina se pravi opreznom zakišeljavanjem hladnih razblaženih rastvora nitritnog jona, NO2−. Slobodna azotasta kiselina je nestabilna i brzo se razlaže.
Razlaganje
Osim u veoma razblaženim, hladnim rastvorima, azotasta kiselina se brzo razlaže u azot dioksid, azot monoksid, i vodu:
- 2 HNO2 → NO2 + NO + H2O
Azot dioksid se disproporcioniše u azotnu kiselinu i azotastu kiselinu u vodenom rastvoru:[9]
- 2 NO2 + H2O → HNO3 + HNO2
U toplim ili koncentrisanim rastvorima, sveukupna reakcija dovodi do formiranja azotne kiseline, vode, i azot oksida:
- 3 HNO2 → HNO3 + 2 NO + H2O
