நைட்ரசு அமிலம்
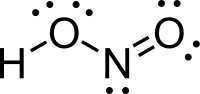
நைட்ரசு அமிலம் (Nitrous Acid) மூலக்கூறு வாய்ப்பாடு HNO2) ஒரு வலிமை குறைந்த ஒற்றை காரத்துவம் கொண்ட, நைட்ரைட் உப்புக்களின் கரைசல்களில் மட்டுமே காணப்படும் அமிலம் ஆகும்.
 | |
| பெயர்கள் | |
|---|---|
| விருப்பத்தெரிவு ஐயூபிஏசி பெயர் நைட்ரசு அமிலம் | |
| முறையான ஐயூபிஏசி பெயர் ஐதராக்சிடோநைட்ரசன் | |
| இனங்காட்டிகள் | |
| 7782-77-6 | |
| 3DMet | B00022 |
| ChEBI | CHEBI:25567 |
| ChEMBL | ChEMBL1161681 |
| ChemSpider | 22936 |
| EC number | 231-963-7 |
Gmelin Reference | 983 |
| யேமல் -3D படிமங்கள் | Image |
| KEGG | C00088 |
| ம.பா.த | நைட்ரசு+அமிலம் |
| பப்கெம் | 24529 |
SMILES
| |
| பண்புகள் | |
| HNO2 | |
| வாய்ப்பாட்டு எடை | 47.013 கி/மோல் |
| தோற்றம் | வெளிர் நீலக் கரைசல் |
| அடர்த்தி | 1 கி/மிலி (தோராயமாக) |
| உருகுநிலை | கரைசலில் மட்டுமே அறியப்பட்டது |
| காடித்தன்மை எண் (pKa) | 3.398 |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | தீப்பற்றாதது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | நைட்ரிக் அமிலம் |
| ஏனைய நேர் மின்அயனிகள் | சோடியம் நைட்ரைட் பொட்டாசியம் நைட்ரைட்டு அம்மோனியம் நைட்ரைட்டு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
| | |
| Infobox references | |
நைட்ரசு அமிலம் அமீன்களிலிருந்து டைஅசைடுகளைத் தயாரிக்கப் பயன்படுகிறது. இந்த வினையானது அமீன்களின் மீதான நைத்திரைற்றுகளின் கருக்கவர் தாக்கத்தின் காரணமாக நிகழ்கிறது. நைத்திரைற்றானது சூழ்ந்துள்ள கரைப்பானிலிருந்து மீண்டும் புரோத்தானேற்றம் செய்யப்படுகிறது. அதே நேரத்தில் நீர் மூலக்கூறானது இரு முறை நீக்கப்படுகிறது. டைஅசைடானது வெளியிடப்பட்டு காபீன் அல்லது காபீனாய்டைத் தருகிறது.
அமைப்பு
வாயு நிலையில், தள அமைப்பைக் கொண்ட நைட்ரசு அமிலமானது சிசு மற்றும் டிரான்சு வடிவங்களைப் பெறுகிறது. அறை வெப்பநிலையில் டிரான்சு(trans) வடிவம் சிசு (cis) வடிவத்தை விட விஞ்சியிருக்கிறது. அகச்சிவப்புக்கதிர் அளவீடுகள் டிரான்சு வடிவமானது சிசு வடிவத்தை விட 2.3 கிசூல் மோல்−1 ஆற்றல் வேறுபாட்டுடன் அதிக நிலைத்தன்மை பெற்றுள்ளதைச் சுட்டிக்காட்டுகிறது.[1]
 | 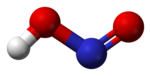 | 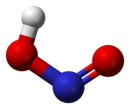 |
(நுண்ணலை நிறமாலையிலிருந்து) |
தயாரிப்பு
குளிர்ந்த நிலையில், நைத்திரைற்று அயனியின் NO2− நீர்த்த கரைசல்கள் கவனமாக அமிலத்தன்மையாக்கப்பட்டு ஒரு வெளிர் நீல நிற நைட்ரசு அமிலமானது தயாரிக்கப்படுகிறது. தனித்த நைட்ரசு அமிலமானது நிலைத்தன்மையற்றது ஆகும். அது விரைவில் சிதைவடைகிறது. நைட்ரசு அமிலமானது டைநைட்ரசன் டிரைஆக்சைடை நீரில் கரைப்பதன் மூலமாகவும் (பின்வரும் சமன்பாட்டின்படியான வினை) தயாரிக்கப்படலாம்.
- N2O3 + H2O → 2 HNO2
சிதைவு வினை
மிகவும் நீர்த்த, குளிர்ந்த நிலையில் உள்ள கரைசல்களைத் தவிர மற்ற அனைத்து நிலைகளிலும் நைட்ரசு அமிலமானது விரைவாகச் சிதைவடைந்து நைட்ரசன் டைஆக்சைடு, நைட்ரிக் ஆக்சைடு, மற்றும் நீர் ஆகியவற்றைத் தருகிறது:
- 2 HNO2 → NO2 + NO + H2O
நைட்ரசன் டைஆக்சைடு பொருத்தமற்ற விகிதத்தில் நீரிய கரைசல்களில் நைட்ரிக் அமிலம் மற்றும் நைட்ரசு அமிலமாகவும் மாறுகிறது.:[2]
- 2 NO2 + H2O → HNO3 + HNO2
மிதமான வெப்பநிலையில் உள்ள கரைசல்களில், ஒட்டுமொத்த வினையானது நைட்ரிக் அமிலம், நீர் மற்றும் நைட்ரிக் ஆக்சைடு ஆகியவற்றைக் குறிப்பிட்ட அளவு தருவதாக அமைகிறது.:
- 3 HNO2 → HNO3 + 2 NO + H2O
நைட்ரிக் ஆக்சைடானது பின்னர் காற்றினால் மறு ஆக்சிசனேற்றம் செய்யப்பட்டு நைட்ரசன் டைஆக்சைடாக மாறி வினையானது நிறைவு பெறுகிறது.:
- 2 HNO2 + O2 → 2 HNO3
வேதியியல்
கனிம வேதியியல்
அமிலத்தின் ஒடுக்க வினையானது, ஒடுக்கும் காரணிகளைப் பொறுத்து வேறுபட்ட விளைபொருட்களைத் தருகிறது.:[3]
I− மற்றும் Fe2+ அயனிகளுடன், NO உருவாகிறது:
- 2 KNO2 + 2 KI + 2 H2SO4 → I2 + 2 NO + 2 H2O + 2 K2SO4
- 2 KNO2 + 2 FeSO4 + 2 H2SO4 → Fe2(SO4)3 + 2 NO + 2 H2O + K2SO4
Sn2+ அயனிகளுடன், N2O உருவாகிறது:
- 2 KNO2 + 6 HCl + 2 SnCl2 → 2 SnCl4 + N2O + 3 H2O + 2 KCl
SO2 வாயுவுடன், NH2OH உருவாகிறது:
- 2 KNO2 + 6 H2O + 4 SO2 → 3 H2SO4 + K2SO4 + 2 NH2OH
காரக்கரைசலில் உள்ள Zn உடன், NH3 உருவாகிறது:
- 5 H2O + KNO2 + 3 Zn → NH3 + KOH + 3 Zn(OH)2
N2H5+ உடன், முதலில் HN3, ம் தொடர்ச்சியாக, N2 வாயுவும் உருவாகின்றன.:
- HNO2 + [N2H5]+ → HN3 + H2O + H3O+
- HNO2 + HN3 → N2O + N2 + H2O
நைட்ரசு அமிலத்தின் ஆக்சிசனேற்ற வினைகள் வெப்ப இயக்கவியல் கட்டுப்பாடுகளை விட வினைவேகவியல் கட்டுப்பாடுகளை அதிகமாகக் கொண்டுள்ளன எனலாம். இந்தக் கூற்றானது நீர்த்த நைட்ரசு அமிலம் I− ஐ I2 ஆக மாற்றமடையச் செய்கிறது. ஆனால், நீர்த்த நைட்ரிக் அமிலத்தால் இது சாத்தியமாகாது.
- I2 + 2 e− ⇌ 2 I− {Eo = +0.54 V}
- NO3− + 3 H+ + 2 e− ⇌ HNO2 + H2O {Eo = +0.93 V}
- HNO2 + H+ + e− ⇌ NO + H2O {Eo = +0.98 V}
இந்த வினைகளுக்கான Ecello மதிப்புகளானது ஒத்தவையாக உள்ளன, ஆனால் நைட்ரிக் அமிலமானது மேலும் வலிமையான ஆக்சிசனேற்றியாக உள்ளது என்பதை இதிலிருந்து அறிந்து கொள்ளலாம். இதன் காரணமாகவே, நீர்த்த நைட்ரசு அமிலமானது அயோடைடை அயோடினாக ஆக்சிசனேற்றம் செய்ய முடிகிறது. இதிலிருந்து நீர்த்த நைட்ரிக் அமிலமானது சற்று வலிமையான ஆக்சிசனேற்றியாக இருந்தும் கூட அதைவிட நைட்ரசு அமிலமானது இன்னும் வேகமாக செயல்படுவதற்கான காரணத்தை இதிலிருந்து வருவிக்க இயலும்.[3]
கரிம வேதியியல்
நைட்ரசு அமிலமானது டையசோனியம் உப்புக்களைத் தயாரிக்கப் பயன்படுகிறது:
- HNO2 + ArNH2 + H+ → ArN2+ + 2 H2O
மேலே குறிப்பிட்டுள்ள வினையில் Ar என்பது அரைல் தொகுதியைக் குறிக்கும்.
இத்தகைய உப்புக்கள் கரிமத் தொகுப்பு முறைகளில் பரவலாகப் பயன்படுத்தப்படுகின்றன. உதாரணமாக, சாண்ட்மேயர் வினை மற்றும் அசோ சாயங்கள் தயாரிப்பு வினையிலும் பயன்படுகின்றன. மேலும், பளிச்சிடும் நிறமுடைய சேர்மங்கள் அனிலீன்களுக்கான பண்பறி பகுப்பாய்வு சோதயைின் அடிப்படையாக உள்ளன.[4] சோடியம் அசைடு எனும் நச்சுத்தன்மை உடைய மற்றும் வெடிக்கக்கூடிய சேர்மத்தை அழிக்க நைட்ரசு அமிலம் பயன்படுகிறது. சோடியம் நைட்ரைட்டின் மீது கனிம அமிலங்களை வினைபுரியச் செய்து, தேவையான நேரத்தில் மட்டும், பலவித பயன்பாடுகளுக்கு, நைட்ரசு அமிலம் உடனுக்குடன் தயாரித்துக் கொள்ளப்படுகிறது.[5]இது முதன்மையாக நீல நிறத்தில் உள்ளது.
- NaNO2 + HCl → HNO2 + NaCl
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
இரண்டு α-ஐதரசன் அணுக்களைக் கொண்ட கீட்டோன்களுடன் வினைப்பட்டு ஆக்சைம்களை உருவாக்குகின்றன. இவை மீண்டும் ஆக்சிசனேற்றம் அடைந்து ஒரு கார்பாக்சிலிக் அமிலமாக அல்லது ஒடுக்கமடைந்து அமீன்களாகவோ மாற்றமடைகின்றன. இந்த செயல்முறையானது அடிப்பிக் அமிலம் தயாரிக்க உதவும் வணிகத் தயாரிப்பு முறையில் பயன்படுகிறது.
நைட்ரசு அமிலமானது அலிபாடிக் ஆல்ககால்களுடன் தீவிரமாக வினைப்பட்டு அல்கைல் நைட்ரைட்டுகளைத் தயாரிக்க உதவுகிறது. இந்த அல்கைல் நைட்ரைட்டுகள் திறன் மிகுந்த இரத்த நாள விரிப்பிகளாகப் பயன்படுகின்றன:
- (CH3)2CH-CH2-CH2-OH + HNO2 → (CH3)2CH-CH2-CH2-ONO + H2O