Азоцістая кіслата
Азоцістая кіслата HNO2 — слабая аднаасноўная кіслата, існуе толькі ў разведзеных водных растворах, афарбаваных у слабы блакітны колер, і ў газавай фазе.
| Азоцістая кіслата | |
 | |
 | |
| Агульныя | |
|---|---|
| Сістэматычнае найменне | Азоцістая кіслата |
| Хім. формула | HNO2 |
| Фізічныя ўласцівасці | |
| Стан (ст. ум.) | цвёрдае |
| Адн. малек. маса | 47.0134 а. а. м. |
| Малярная маса | 47.0134 г/моль |
| Шчыльнасць | 1.685 (вадк) |
| Тэрмічныя ўласцівасці | |
| Тэмпература плаўлення | 42.35 °C |
| Тэмпература кіпення | 158 °C |
| Хімічныя ўласцівасці | |
| pKa | 3.4 |
| Растваральнасць у вадзе | 548 г/100 мл |
| Класіфікацыя | |
| Рэг. нумар CAS | [] |
| PubChem | |
| Рэг. нумар EINECS | 231-963-7 |
| SMILES | |
| ChemSpider | |
Солі азоцістай кіслаты называюцца нітрытамі або азоцістакіслымі. Нітрыты значна больш устойлівыя, чым HNO2, усе яны з'яўляюцца таксічнымі.
Будова
У газавай фазе планарная малекула азоцістай кіслаты існуе ў выглядзе двух канфігурацый цыс- и транс-. Пры пакаёвай тэмпературы пераважае транс-ізамер.
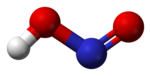 | 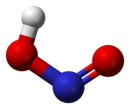 |
Другая структура з'яўляецца больш устойлівай. Так, для цыс-HNO2(г) DG°f = -42,59 кДж/моль, а для транс–HNO2(г) DG = -44,65 кДж/моль.
Літаратура
- Азоцістая кіслата // Беларуская энцыклапедыя: У 18 т. Т.1: А — Аршын / Рэдкал.: Г. П. Пашкоў і інш. — Мн.: БелЭн, 1996. — Т. 1. — 552 с. — 10 000 экз. — ISBN 985-11-0036-6 (т.1).
- Хімічны слоўнік навучэнца. — Мн.: Народная асвета, 2004 — С. 12. // Азоцістая кіслата
Спасылкі
- Азотистая кислота (руск.) — артыкул з Вялікай савецкай энцыклапедыі
- Азотистая кислота // ХиМиК.ру (руск.)
 На Вікісховішчы ёсць медыяфайлы па тэме Азоцістая кіслата
На Вікісховішчы ёсць медыяфайлы па тэме Азоцістая кіслата
🔥 Top keywords: Галоўная старонкаАдмысловае:SearchУладзімір КараткевічКарлес ПучдэмонМіхась ПазнякоўАдмысловае:RecentChangesВікіпедыя:ФорумЯнка БрыльРаіса Андрэеўна БаравіковаМарыя АнтуанетаАлесь БадакЯнка СіпакоўПімен ПанчанкаДзеяслоўВіктар Анатолевіч ШніпГенадзь Пятровіч ПашкоўЯўгенія ЯнішчыцМар’ян ДуксаЮрась СвіркаУладзімір Іванавіч КарызнаАлесь РазанаўБеларусьЛюдміла РублеўскаяДзікае паляванне караля СтахаВікіпедыя:СупольнасцьМіхась БашлакоўЯкуб КоласМагіла льва (паэма)Янка КупалаБярозка (часопіс)AP$ENTІван МележІван ШамякінУННВАркадзь КуляшоўДзеепрыслоўеВасіль БыкаўРыгор БарадулінЛюдзі на балоце (раман)
