Բենզոլ
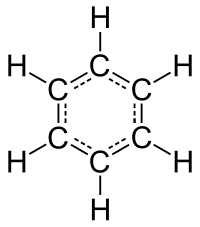
Բենզոլ կամ բենզեն (C6H6, PhH), քիմիական բանաձևը՝ , օրգանական միացություն, պարզագույն արոմատիկ ածխաջրածին։ Բենզոլը կանոնավոր վեցանկյուն է, որում C – C կապի երկարությունը 0,1407 նմ է, իսկ կովալենտային անկյունը՝ 130°։ Ածխածին–ածխածին և ածխածին–ջրածին σ–կապերը գոյանում են ածխածնի sp2 hիբրիդային օրբիտալների վրածածկից՝ առաջացնելով հարթ ցիկլիկ σ–կմախք։
| Բենզոլ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | բենզոլ |
| Ավանդական անվանում | ֆենիլ ջրածնի, բենզիլ |
| Քիմիական բանաձև | C₆H₆ |
| Մոլային զանգված | 1,3E−25 կիլոգրամ[1][2] գ/մոլ |
| Խտություն | 0,88 ± 0,01 գ/սմ³[3] գ/սմ³ |
| Դինամիկ մածուցիկություն | 0,0652 պուազեյլ Պա/վ |
| Իոնիզացման էներգիա | 9,24 ± 0,01 Էլեկտրոն-վոլտ և 1,5E−18 ջոուլ[4] կՋ/մոլ |
| Հալման ջերմաստիճան | 42 ± 1 ℉, 6 °C[5] և 5,53 °C[4] °C |
| Եռման ջերմաստիճան | 176 ± 1 ℉, 80 °C[5] և 80,09 °C[4] °C |
| Այրման ջերմաստիճան | 12 ± 1 ℉ և −11 ± 0 °C[6] |
| Ինքնաբռնկման ջերմաստիճան | 498 ± 1 °C[6] |
| Գոյացան էնթալպիա | 82 930 ջոուլ մեկ մոլի համար[7] և 49 080 ջոուլ մեկ մոլի համար[7] կՋ/մոլ |
| Գոլորշու ճնշում | 75 ± 1 mm Hg |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջրում | 0,180 գ/100 մլ |
| Բեկման ցուցիչ | 1,501 |
| Դիպոլ մոմենտ | 0 Կլ·մ[4] |
| Դասակարգում | |
| CAS համար | 71-43-2 |
| PubChem | 241 |
| EINECS համար | 200-753-7 |
| SMILES | C1=CC=CC=C1 |
| ЕС | 200-753-7 |
| RTECS | CY1400000 |
| ChEBI | 236 |
| Թունավորություն | |
| ՄԲ50 | 520 |
| Թունավորություն | NFPA 714 |
| IDLH | 1595 ± 1 mg/m³ |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Պատմություն
Մաքուր վիճակում բենզոլը 1833 թվականին ստացել է Էյլարդ Միչերլիխը բենգոյական թթվի կալցիումական աղի չոր թորումից, որտեղից էլ՝ բենզոլ անվանումը։ Նույնիսկ ածխածնի քառավալենտության հաստատումից և ալկեններում ու ալկիններում չհագեցած կապ հասկացությունը մտցնելուց հետո բենզոլի կառուցվածքը մնաց հանելուկային, քանի որ, այդքան չհագեցած լինելով, այն պասիվ էր միացման ռեակցիաներում։

Ֆիզիկական հատկություններ
Անգույն, յուրահատուկ հոտով, դյուրաշարժ, ցնդող հեղուկ է։ Հալման ջերմաստիճանը՝ 5,5 °С, եռմանը՝ 80,1 °С, խտությունը՝ 879, 1 կգ/մ³։ Լավ է լուծվում օրգանական լուծիչներում, վատ՝ ջրում։ Բենզոլը ջրի հետ առաջացնում է 69,25 °С ում եռացող ազեոտրոպ խառնուրդ։
Քիմիական հատկություններ
Բենզոլի մոլեկուլն ունի 6-րդ կարգի սիմետրիայի առանցք և հարթ է, π էլեկտրոնների տեսքը ունի փակված միասնական էլեկտրոնային համակարգի ձև։ Ստանում են քարածխի չոր թորման արդյունքներից և նավթի արոմատացմամբ։ Բենզոլը քիմիական արդյունաբերության կարևորագույն ելանյութերից է։Բենզոլը չի գունազրկում կալիումի պերմանգանատի ջրային լուծույթն ու բրոմաջուրը։
- բենզոլը սովորական պայմաններում չի օքսիդանում,
- բենզոլը սովորական պայմաններում միացման ռեակցիա չի տալիս և դրանով տարբերվում է ալկեններից։
Տեղակալման ռեակցիաներ
- Հալոգենացում
Բրոմի և քլորի հետ բենզոլը փոխազդում է միայն կատալիզատորի առկայությամբ։ Որպես կատալիզատոր վերցնում են մետաղների անջուր հալոգենիդներ (AICI3, AIBr3, FeCI3, FeIBr3, SnCI4, TiCI4 և այլն)։ Բրոմացման կամ քլորացման արդյունքում առաջանում են բենզոլի համապատասխան բրոմ կամ քլորածանցյալները.

Որպես ռեակցիայի արգասիք անջատվում է նաև քլորաջրածին, որը կլանում են ջրով և ստացված լուծույթում հայտաբերում քլորիդ իոնը արծաթի նիտրատի լուծույթով։
- Նիտրացում
Ռեակցիան իրականացվում է նիտրացնող խառնուրդով (խիտ ծծմբական և ազոտական թթուների խառնուրդ), և ստացվում է նիտրոբենզոլ.
- Ալկիլացում
Բենզոլային օղակի ջրածնի ատոմի տեղակալումը ալկիլ խմբով անվանվում է ալկիլացում և ընթանում է ալկիլ հալոգենիդների կամ ալկենների և բենզոլի փոխազդեցությունից՝ AICI3, FeCI3, FeBr3 կատալիզատորների առկայությամբ (ՖրիդելԿրաֆտսի ռեակցիա)։

Միացման ռեակցիաներ
Բենզոլը դժվարությամբ է մտնում միացման ռեակցիաների մեջ, քանի որ միացման ռեակցիաների հետևանքով արոմատիկությունը խախտվում է, վերանում է օղակը կայունացնող 6–էլեկտրոնանոց ընդհանուր ամպը։
- Հիդրում
Ջրածնի միացումը բենզոլին և իր հոմոլոգներին ընթանում է բարձր ջերմաստիճանի և ճնշման պայմաններում՝ մետաղական կատալիզատորների առկայությամբ.

- Քլորացում
Քլորի միացումը բենզոլին ռադիկալային մեխանիզմով ընթացող ռեակցիա է և իրականացվում է ուլտրամանուշակագույն ճառագայթման ու տաքացման պայմաններում։ Բենզոլի ռադիկալային քլորացումը հանգեցնում է հեքսաքլորցիկլոհեքսանի (հեքսաքլորան)՝ առաջացմանը, որը վնասատու միջատների դեմ պայքարի միջոց է.

Օքսիդացում և այրում
Բենզոլը չի օքսիդանում նույնիսկ ուժեղ օքսիդիչներով (KMnO4, K2CrO4 և այլն)։ Դա հաստատվել է փորձով։ Բենզոլն օդում այրվում է ծխացող բոցով, ինչը պայմանավորված է բենզոլի մոլեկուլում ածխածնի մեծ զանգվածային բաժնով.

Բենզոլի կիրառում
Բենզոլը կիրառվում է որպես լուծիչ և ներքին այրման շարժիչների վառելիքի որակի լավացման հավելանյութ, այն ելանյութ է օրգանական միացություններից շատ շատերի սինթեզի համար։ Նիտրացման ռեակցիայով ստացվում է նիտրոբենզոլ՝ C6H5NO2, որն անիլինի ստացման սկզբնանյութն է, իսկ անիլինից ստացվում են շատ մեծ թվով դեղանյութեր և ներկանյութեր։ Բենզոլի քլորացումից ստացված քլորբենզոլն օգտագործվում է որպես լուծիչ։ Բենզոլն օգտագործվում է նաև օծանելիքի ստացման համար։ Այն ելանյութ է բարձրամոլեկուլային միացությունների մոնոմերների սինթեզի համար։
Բենզոլի հոմոլոգներն օգտագործվում են որպես լուծիչներ, ինչպես նաև զանազան ներկանյութեր, դեղանյութեր, պայթուցիկ, հոտավետ նյութեր ստանալու համար և այլն։ Բենզոլի և մյուս ածխաջրածինների քլորածանցյալները թունաքիմիկատներ են և գյուղատնտեսության մեջ օգտագործվում են որպես բույսերի պաշտպանության քիմիական միջոցներ, օրինակ՝ հեքսաքլորցիկլոհեքսանը, որն ստացվում է բենզոլին քլոր միացնելիս, և հեքսաքլորբենզոլը, որն ստացվում է բենզոլի ջրածինները քլորով տեղակալելիս։ Լայն կիրառություն ունի ստիրոլը, որը հեշտությամբ պոլիմերվում է՝ առաջացնելով արժեքավոր պոլիմեր՝ պոլիստիրոլ. Օգտագործվում է ֆենոլի, ացետոնի, ստիրոլի, պայթուցիկ նյութերի, ներկանյութերի, օծանելիքի, միջատասպանների արտադրություններում։ Բենզոլի գոլորշիները օրգանիզմի համար թունավոր են։ Շնչառական ուղիներով և մաշկի միջով օրգանիզմ թափանցելով՝ բենզոլն առաջացնում է սուր և քրոնիկական թունավորումներ։ Թունավորման նշաններն են՝ գլխացավ, գլխապտույտ, սրտխառնոց, փսխում, արյան ճնշման անկում, ծանր թունավորման դեպքերում՝ ցնցումներ և գիտակցության կորուստ։
Պայքարի հուսալի միջոցը լավ օդափոխումն է։ Բենզոլի թույլատրելի քանակն օդում 20 մգ/մ³ է։
Ծանոթագրություններ
Գրականություն
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Բենզոլ» հոդվածին։ |
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 2, էջ 392)։ |


