Манган
Манган (лат. manganium) је хемијски елемент симбола Mn и атомскога броја 25, метал 7. групе (VIIB). Има 15 изотопа (атомске масе 49—62; постојан је само један: манган-55).Не налази се као слободан у природи; често се може наћи у минералима у комбинацији с гвожђем. Један је од најраспрострањенијих елемената у кори Земље.Има важну индустријску употребу за метално легирање — нарочито нерђајућих челика.
 | ||||||||||||||||||||||||||||||||
| Општа својства | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | манган, Mn | |||||||||||||||||||||||||||||||
| Изглед | сребрнасто металан | |||||||||||||||||||||||||||||||
| У периодном систему | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
| Атомски број (Z) | 25 | |||||||||||||||||||||||||||||||
| Група, периода | група 7, периода 4 | |||||||||||||||||||||||||||||||
| Блок | d-блок | |||||||||||||||||||||||||||||||
| Категорија | прелазни метал | |||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 54,938044(3)[1] | |||||||||||||||||||||||||||||||
| Ел. конфигурација | [Ar] 3d5 4s2 | |||||||||||||||||||||||||||||||
по љускама | 2, 8, 13, 2 | |||||||||||||||||||||||||||||||
| Физичка својства | ||||||||||||||||||||||||||||||||
| Агрегатно стање | чврсто | |||||||||||||||||||||||||||||||
| Тачка топљења | 1.519 K (1.246 °C, 2.275 °F) | |||||||||||||||||||||||||||||||
| Тачка кључања | 2.334 K (2.061 °C, 3.742 °F) | |||||||||||||||||||||||||||||||
| Густина при с.т. | 7,21 g/cm3 | |||||||||||||||||||||||||||||||
| течно ст., на т.т. | 5,95 g/cm3 | |||||||||||||||||||||||||||||||
| Топлота фузије | 12,91 kJ/mol | |||||||||||||||||||||||||||||||
| Топлота испаравања | 221 kJ/mol | |||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 26,32 J/(mol·K) | |||||||||||||||||||||||||||||||
Напон паре
| ||||||||||||||||||||||||||||||||
| Атомска својства | ||||||||||||||||||||||||||||||||
| Оксидациона стања | 7, 6, 5, 4, 3, 2, 1, −1, −2, −3 ацидично, базично или амфотерично; зависно о оксидационом стању | |||||||||||||||||||||||||||||||
| Електронегативност | 1,55 | |||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 717,3 kJ/mol 2: 1.509 kJ/mol 3: 3.248 kJ/mol (остале) | |||||||||||||||||||||||||||||||
| Атомски радијус | 127 pm | |||||||||||||||||||||||||||||||
| Ковалентни радијус | 139±5—161±8 pm | |||||||||||||||||||||||||||||||
| Остало | ||||||||||||||||||||||||||||||||
| Кристална структура | унутрашњецентр. кубична (BCC) | |||||||||||||||||||||||||||||||
| Брзина звука танак штап | 5.150 m/s (на 20 °C) | |||||||||||||||||||||||||||||||
| Топл. ширење | 21,7 µm/(m·K) (на 25 °C) | |||||||||||||||||||||||||||||||
| Топл. водљивост | 7,81 W/(m·K) | |||||||||||||||||||||||||||||||
| Електрична отпорност | 1,44 µΩ·m (на 20 °C) | |||||||||||||||||||||||||||||||
| Магнетни распоред | парамагнетични | |||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | (α) +529,0·10−6 cm3/mol (293 K)[2] | |||||||||||||||||||||||||||||||
| Јангов модул | 198 GPa | |||||||||||||||||||||||||||||||
| Модул стишљивости | 120 GPa | |||||||||||||||||||||||||||||||
| Мосова тврдоћа | 6,0 | |||||||||||||||||||||||||||||||
| Бринелова тврдоћа | 196 MPa | |||||||||||||||||||||||||||||||
| CAS број | 7439-96-5 | |||||||||||||||||||||||||||||||
| Историја | ||||||||||||||||||||||||||||||||
| Откриће | Карл Шеле (1774. год.) | |||||||||||||||||||||||||||||||
| Прва изолација | Јохан Ган (1774) | |||||||||||||||||||||||||||||||
| Главни изотопи | ||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||
Манган по свом изгледу подсећа на гвожђе. Сиво-беле је боје, али — за разлику од гвожђа — има много већу тврдоћу. Има електронску конфигурацију ([Ar] 3d5 4s2); максималан оксидациони број мангана у једињењима је +7 а најчешћи оксидациони бројеви +2, +4 и +7. Манган има својство пасивизирања на ваздуху; није склон корозији; реагује са разблаженим киселинама.
Историјски, манган је назван по пиролузиту и другим црним минералима из области Магнезија, у Грчкој — која је такође епоним за магнезијум и руду гвожђа магнетит. До средине 18. века, шведско-немачки хемичар Карл Шеле користио је пиролузит за добијање хлора. Шеле и други су били свесни да је пиролузит (данас познато да је то манган-диоксид) садржао нови елемент, али нису били у могућности да га изолују. Јохан Ган је први изоловао нечист узорак метала мангана 1774. године, што је учинио редуковањем диоксида угљеником.
Манганско фосфатирање се користи за превенцију рђе и корозије на челику. Јонизовани манган се користи индустријски као пигмент разних боја, које зависе од оксидационог стања јона. Перманганати алкалних и земноалкалних метала су моћни оксиданти. Манган-диоксид се употребљава као катодни (акцептор електрона) материјал у цинк-угљеничним и алкалним батеријама.
У биологији, манган(II) јони делују као кофактори за велики варијетет ензима који врше много функција. Ензими мангана су посебно есенцијални у детоксификацији супероксидних слободних радикала у организмима који морају да имају елементални кисеоник. Манган такође функционише у комплексу еволуције кисеоника фотосинтетичних биљака. И док је елемент неизоставан минерал у траговима за све познате живе организме, исто тако функционише као неуротоксин у већим количинама. Поготово путем инхалације, може да узрокује манганизам — стање код сисара које води неуролошком оштећењу које је каткад иреверзибилно.
Особине
Физичка својства

Манган је сребрносив метал који подсећа на гвожђе. Тврд је и веома крт, тешко се спаја али лако оксидује.[3] Метал манган и његови најчешћи јони су парамагнетични.[4] Манган лагано тамни на ваздуху и оксидује (’рђа’) као гвожђе у води која садржи растворени кисеоник.
Изотопи
Манган који се јавља природно чини један стабилни изотоп, 55Mn. Изоловано је и описано 18 радиоизотопа, који су по атомској тежини у распону од 46 u (46Mn) до 65 u (65Mn). Најстабилнији су 53Mn с полуживотом од 3,7 милиона година, 54Mn с полуживотом од 312,3 дана и 52Mn с полуживотом од 5,591 дана. Сви преостали радиоактивни изотопи имају полуживоте од мање од три сата, а већина од мање од једног минута. Примарни тип распада пре најзаступљенијег стабилног изотопа, 55Mn, јесте захват електрона; примарни тип после је бета распад.[5] Манган такође има три мета-стања.[5]
Манган је део гвожђеве групе елемената, за које се верује да су синтетисани у великим звездама недуго пре експлозије супернове. 53Mn се распада на 53Cr с полуживотом од 3,7 милиона година. Због његовог релативно кратког полуживота, 53Mn је релативно редак; прави га удар космичких зрака на гвожђе.[6] Изотопни садржаји мангана су обично у комбинацији са изотопним садржајима хрома и нашли су примену у изотопној геологији и радиометричком датирању. Mn—Cr изотопни односи из неколицине метеорита сугеришу почетни 53Mn/55Mn однос, што индицира да је Mn—Cr изотопна композиција морало да резултује из in situ распада 53Mn у диференцираним планетарним телима. Стога, 53Mn пружа додатни доказ за нуклеосинтетичке процесе непосредно пре коалесценције Сунчевог система.[5]
Оксидациона стања

Најчешћа оксидациона стања мангана су +2, +3, +4, +6 и +7, с тим да су посматрана сва стања оксидације од −3 до +7. Mn2+ се често ’надмеће’ са Mg2+ у биолошким системима. Једињења мангана где је манган у оксидационом стању +7, а која су углавном ограничена на нестабилни оксид Mn2O7, једињења интензивног љубичастог перманганатног анјона MnO4−, те неколико оксихалида (MnO3F и MnO3Cl) — моћни су оксидујући агенси.[3] Једињења са оксидационим стањима +5 (плаво) и +6 (зелено) јаки су оксидујући агенси и подложни су диспропорционацији.

Најстабилније оксидационо стање мангана је +2, при чему има бледу розе боју; многа једињења мангана(II) су позната, као што је манган(II) сулфат (MnSO4) и манган(II) хлорид (MnCl2). Ово оксидационо стање такође се види код минералног родохрозита (манган(II) карбонат). Манган(II) најчешће постоји с високим спином, S = 5/2 основно стање због високе енергије спаривања за манган(II). Како год, постоји неколико примера ниског спина: нпр. S = 1/2 за манган(II).[8] Нема d—d транзиција са спином код мангана(II), што објашњава зашто су једињења мангана(II) обично бледа или чак безбојна.[9]
| Оксидациона стања мангана[10] | |
|---|---|
| 0 | Mn 2(CO) 10 |
| +1 | MnC 5H 4CH 3(CO) 3 |
| +2 | MnCl 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2O 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | KMnO 4, Mn 2O 7 |
| Уобичајена оксидациона стања су подебљана. | |
Оксидационо стање +3 је познато у једињењима као што је манган(III) ацетат, али ово су прилично моћни оксидујући агенси и такође подложни диспропорционацији у једињењу — формирајући манган(II) и манган(IV). Чврста једињења мангана(III) карактерише јака љубичасто-црвена боја и преференција за изобличену октаедарску координацију која резултује из Јан—Телеровог ефекта.
Оксидационо стање +5 може да се добије растварањем манган диоксида у растопљеном натријум нитриту.[11] Соли манганата(VI) могу да се добију растварањем једињења Mn, као што је манган диоксид, у растопљеној алкалији при изложености ваздуху. Једињења перманганата (оксидационо стање +7) љубичаста су и могу да обоје стакло пурпурном бојом. Калијум перманганат, натријум перманганат и баријум перманганат су све потентни оксиданти. Калијум перманганат, такође познат и као Кондијеви кристали, уобичајено је коришћен лабораторијски реагенс због својих оксидујућих својстава; користи се као топикални лек (на пример, при третирању болести риба). Раствори калијум перманганата су били међу првим бојилима и фиксативима за употребу у припремању биолошких ћелија и ткива за електронску микроскопију.[12]
Историја
Етимологија мангана је комплексна. У древна времена, два црна минерала из Магнезије (налази се на територији данашње Грчке) звана су магнес по месту порекла — с тим да се сматрало да се разликују у роду. ’Мушки’ магнеси су привлачили гвожђе, а руда гвожђа данас је позната као магнетна руда или магнетит а и термин магнет је вероватно овако настао. Руда ’женског’ магнеса није привлачила гвожђе, али се користила за обезбојавање стакла. Овај женски магнес је касније добио назив магнесија тј. магнезија, сада познат као пиролузит или манган диоксид. Нити овај минерал нити елементални манган нису магнетични. У 16. веку, произвођачи стакла су манган диоксид назвали манганезум (приметити два „н”) — вероватно као корупција и конкатенација двеју речи, пошто су алхемичари и стаклари у коначници морали да разликују магнезију негра (црну руду) од магнезије алба (бела руда; такође из Магнезије, исто тако корисна у стакларству). Микеле Меркати је црну магнезију назвао манганеза, а метал на крају изолован из исте постао је познат као манган[ез] (нем. Mangan). Назив магнезија је тако на крају коришћен само када се односи на белу магнезију алба (магнезијум оксид), која је дала име магнезијум за слободни елемент који је изолован много касније.[13]

Неколико колористичних оксида мангана, на пример манган диоксид, заступљени су у природи и били су коришћени као пигменти још од каменог доба. Цртежи на пећинама у Гаргасу који су стари 30.000—24.000 година садрже пигменте мангана.[15]
Једињења мангана су користили египатски и римски стаклари, или за додавање или за уклањање боја стакла.[16] Употреба „стакларског сапуна” наставила се током средњег века до модерног доба и евидентна је у стаклу из Венеције из 14. века.[17]

Пошто је коришћен у производњи стакла, манган диоксид је био доступан за експерименте алхемичара — првих хемичара. Игнацијус Готфрид Кајм (1770) и Јохан Рудолф Глаубер (17. век) открили су да би манган диоксид могао да се претвори у перманганат, користан лабораторијски реагенс.[18] До средине 18. века, шведски хемичар Карл Вилхелм Шеле користио је манган диоксид за производњу хлора. Први, хлороводонична киселина, или смеша разблажене сумпорне киселине и натријум хлорида, учињено је да реагује са манган диоксидом; касније је хлороводонична киселина из Леблановог процеса употребљена и манган диоксид је рециклиран Велдоновим процесом. На производњу хлора и хипохлоритних избељивачких агенаса трошиле су се велике количине руде мангана.
Шеле и други хемичари су били свесни да је манган диоксид садржавао нови елемент, али нису били у могућности да га изолују. Јохан Готлиб Ган је први изоловао нечист узорак метала мангана године 1774, и то редуковањем диоксида угљеником.
Садржај мангана код неких руда гвожђа коришћених у Грчкој довео је до спекулација да се гвожђе добија из руде која садржи додат манган, чинећи спартански челик изузетно тврдим.[19] Око почетка 19. века, манган је био коришћен у производњи челика и неколико патената је било регистровано. Године 1816, документовано је да је гвожђе легирано с манганом било тврђе али и не кртије. Године 1837, британски академик Џејмс Купер приметио је повезаност између обилног излагања рудара мангану са обликом Паркинсонове болести.[20] Године 1912, патенти из САД су одобрени да би се заштитило ватрено оружје од рђе и корозије — електрохемијским конверзионим ’пресвлачењем’ манган фосфатом; процес је од тада до данас увелико заступљен.[21]
Изум Лекланшеове ћелије године 1866. и уследело унапређење батерија које садрже манган диоксид као катодни деполаризатор повећало је потребу за манган диоксидом. Све до развоја батерија са никлом и кадмијумом и литијумом, већина батерија је садржала манган. Цинк-угљенична батерија и алкална батерија обично користи индустријски произведен манган диоксид јер манган диоксид који се јавља у природи садржи нечистоће. У 20. веку, манган диоксид је широко коришћен катодно за комерцијалне једнократне суве батерије — и стандардног (цинк-угљеник) и алкалног типа.[22]
Јављање и производња
Манган сачињава око 1000 ppm (0,1%) Земљине коре; 12. је најзаступљенији од елемената у кори.[23] Тло садржи 7—9000 ppm мангана; просек је 440 ppm.[23] Морска вода има само 10 ppm мангана, а атмосфера садржи 0,01 µg/m3.[23] Манган се углавном јавља као пиролузит (MnO2), браунит (Mn2+Mn3+6)(SiO12),[24] псиломелан (Ba,H2O)2Mn5O10, те у мањој мери као родохрозит (MnCO3).
 |  |  |  |  |
| Руда мангана | Псиломелан (манганова руда) | Шпигелајзен је легура гвожђа са садржајем мангана од отприлике 15% | Дендрити манган оксида на кречњаку из Золнхофена (Немачка), врста псеудофосила; скала је у mm | Минерал родохрозит (манган(II) карбонат) |

Најважнија руда мангана је пиролузит (MnO2). Друге економски значајне руде мангана обично показују блиску спацијалну релацију са рудама гвожђа.[3] Ресурси у земљи су велики али ’неправилно распоређени’. Око 80% познатих ресурса мангана у целом свету је у Јужној Африци; други важни депозити мангана су у Украјини, Аустралији, Индији, Кини, Габону и Бразилу.[25] Према проценама из 1978, океанско дно има 500 милијарди тона манганских нодула (’израслина’).[26] Покушаји да се изнађу економски одрживи методи искоришћавања нодула мангана престали су 1970-их.[27] Ција је некада користила рудне модуле мангана на океанском дну као параван за унапређење совјетске морнарице.[28]
У Јужној Африци, најидентификованији депозити су лоцирани у близини Хотазела у провинцији Северни Кејп — са проценом од 15 милијарди тона за 2011. Исте године Јужна Африка је произвела 3,4 милиона тона, што је било више него од свих других земаља.[29]
Манган се углавном копа у Јужној Африци, Аустралији, Кини, Габону, Бразилу, Индији, Казахстану, Гани, Украјини и Малезији.[30] Извори о увозу за САД (1998—2001): руда мангана: Габон, 70%; Јужна Африка, 10%; Аустралија, 9%; Мексико, 5%; други, 6%; фероманган: Јужна Африка, 47%; Француска, 22%; Мексико, 8%; Аустралија, 8%; други, 15%. Манган садржан у свим увозима мангана: Јужна Африка, 31%; Габон, 21%; Аустралија, 13%; Мексико, 8%; други, 27%.[25][31]
За производњу феромангана, руда мангана се помеша са рудом гвожђа и угљеника а потом редукује или у високој пећи или у електролучној пећи.[32] Резултујући фероманган има садржај мангана 30—80 %.[3] Чисти манган који се користи за производњу легура без гвожђа добија се ликсивијацијом руде мангана са сумпорном киселином и уследелим процесом електродепозиције.[33]
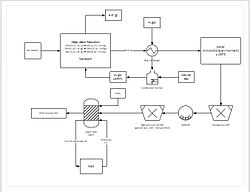
Прогресивнији процеси за екстраховање укључују директно редуковање руде мангана у гомиластој ликсивијацији. Ово се ради перколацијом природног гаса кроз дно гомиле; природни гас пружа топлоту (мора да буде најмање 850 °C), и редукујући агенс (угљеник моноксид). Овиме се редукује сва руда мангана на манган оксид (MnO), који је у ликсивијантној форми. Руда потом путује кроз круг за ’брушење’ да би се смањила величина честица на интервал око 150—250 μm, повећавајући површину да би се потпомогла ликсивијација. Руда се онда додаје у ликсивијацијски спремник сумпорне киселине и ферозног гвожђа (Fe2+) у омјеру 1,6/1. Гвожђе реагује с манган диоксидом да би настао гвожђе хидроксид и елементални манган. Овај процес омогућава искоришћавање приближно 92% мангана. За даљу пурификацију, манган се потом може послати у одељење за електродепозицију.[34]
Године 1972, Цијиним пројектом „Азоријан” — преко милијардера Хауарда Хјуза — наручен је брод Хјуз Гломар експлорер с параваном прикупљања манганских нодула са дна мора. Ово је покренуло лавину активности да се узима садржај манганских нодула, што у ствари није практично. Права мисија Гломар експлорера била је помагање потопљене подморнице СССР, имена K-129, с циљем доласка до совјетских шифрарника.[35]
Примена
Манган нема задовољавајућу замену што се тиче његових главних примена у металургији.[25] За мање примене (нпр. манганско фосфатирање), цинк и понекад ванадијум одговарајуће су замене.
Челик

Манган је есенцијалан за производњу гвожђа и челика због својстава везивања сумпора, деоксидовања и легирања — што је први препознао британски металург Роберт Форестер Машет (1811—1891) који је 1856. увео елемент у форми шпигелајзена (нем. Spiegeleisen) у челик а ради специфичне намене уклањања вишка раствореног кисеоника, сумпора и фосфора да би се побољшала ковност. Производња челика,[36] укључујући његову компоненту — производња гвожђа, броји се као главни разлог потражње односно потреба за манганом (тренутно у распону 85—90 % укупне потражње).[33] Манган је кључна компонента нескупоценог нерђајућег челика.[31][37] Обично је фероманган (најчешће око 80% мангана) интермедијер у модерним процесима.
Мање количине мангана побољшавају обрадивост челика на високим температурама формирајући сулфид који се топи на оваквим температурама и спречавајући формирање течног гвожђе сулфида на границама зрна. Ако садржај мангана досегне 4%, кртост челика постаје доминантна одлика. Кртост се смањује при већим концентрацијама мангана и досеже прихватљив ниво на 8%. Челик који садржи 8—15 % мангана има велику затезну чврстоћу од и до 863 MPa.[38][39] Челик са 12% мангана је ’открио’ Роберт Хадфилд године 1882. и и дан-данас је познат као Хадфилдов челик (енгл. Hadfield steel) или „манглегура” (енгл. mangalloy). Коришћен је за израду британских војних челичних шлемова (нпр. Броди), а касније и од стране војске САД.[40]
Алуминијумске легуре
Друга највећа примена мангана су алуминијумске легуре. Алуминијум са отприлике 1,5% мангана има повећан отпор на корозију преко зрна која апсорбују нечистоће које би довеле до галванске корозије.[41] Алуминијумске легуре 3004 и 3104 (0,8—1,5 % мангана) отпорне на корозију користе се за већину конзерви за напитке.[42] Пре године 2000, више од 1,6 милиона тона ових легура је употребљено; на 1% мангана, било је потребно 16.000 тона мангана.[42]
Друге употребе
Метилциклопентадијенил манган трикарбонил користи се као адитив у безоловном бензину да се појача октански рејтинг и смањи куцкање мотора (иначе карактеристично за дизелаше). Манган у овом необичном органометаличном једињењу је у оксидационом стању +1.[43]
Манган(IV) оксид (манган диоксид, MnO2) користи се као реагенс у органској хемији за оксидацију бензиличних алкохола (где је хидроксилна група суседна за ароматични прстен). Манган диоксид се користио од антике за оксидовање и неутрализовање зеленкасте ’аномалије’ у стаклу која је од контаминације количином гвожђа у траговима.[17] MnO2 се такође користи у производњи кисеоника и хлора, те у сушењу црних боја. У неким приправкама, може да буде браон пигмент за боје и конституент је природног умбера.
Манган(IV) оксид се користио у оригиналном типу батерије са сувом ћелијом, као електронски акцептор од цинка; црнкасти је материјал у ћелијама карбон-цинк батерија. Манган диоксид се редукује до манган оксид-хидроксида MnO(OH) током пражњења, спречавајући формирање водоника на аноди батерије.[44]
- MnO2 + H2O + e− → MnO(OH) + OH−
Исти материјал такође функционише у новијим алкалним батеријама (углавном ћелије батерије), где се користи иста базична реакција али различита микстура електролита. Године 2002, више од 230.000 t манган диоксида је употребљено у ову сврху.[22][44]

Метал се повремено користи за кованице; до 2000, једина кованица у САД која је садржала манган био је „ратни” никл из 1942—1945.[45] Легура од 75% бакра и 25% никла традиционално је коришћена за производњу кованица никла. Међутим, због недостатка метала никла током рата, замењен је више доступним сребром и манганом — тако резултујући легуром од 56% бакра, 35% сребра и 9% мангана. Од 2000, кованице долара (нпр. долар Сакагавеје и председнички 1 долар) праве се од месинга који садржи 7% мангана са чистом бакарном језгром.[46] У оба случаја, и за никл (новац од пет центи) и за долар, употреба мангана у кованици била је ради дуплицирања електромагнетних својстава претходне кованице идентичне величине и вредности у механизмима аутомата за продају. У случају каснијих кованица америчког долара, легура мангана је с намером дуплицирања својстава легуре бакра/никла употребљене у претходном долару Сузан Б. Ентони. ЕУ користи манган у кованицама од 1 и 2 евра, због веће и јефтиније доступности.
Једињења мангана користила су се као пигменти и за бојење керамике и стакла. Смеђа боја керамике је понекад резултат присуства манганових једињења.[47] У стакларској индустрији, једињења мангана се користе за два ефекта. Манган(III) реагује с гвожђем(II) да би се индуковала јака зелена боја у стаклу формирањем мање обојеног гвожђа(III) и благо розе мангана(II), компензујући за резидуалну боју гвожђа(III).[17] Веће количине мангана се користе за производњу ружичасто обојеног стакла.
Тетравалентни манган се користи као активатор код фосфора који емитују црвено. И док су позната многа једињења која показују луминесценцију,[48] већина их се не користи у комерцијалној примени услед ниске ефикасности или емисије дубоке црвене боје.[49][50] Како год, неколико флуорида које активира Mn4+ познато је као потенцијални црвеноемитујући фосфор за топлобели LED.[51][52] Али до дана-данашњег, само је K2SiF6:Mn4+ комерцијално доступан за употребу код топлобелих LED сијалица.[53]
Манганов оксид се такође користи у смешама портландског цемента.[54]
Биолошки значај

Манган је важан елемент за људско здравље, есенцијалан за развој, метаболизам и антиоксидативни систем. Без обзира на ово, прекомерно излагање или унос могу да доведу до стања познатог као манганизам, а у питању је неуродегенеративни поремећај који узрокује допаминергетску неуроналну смрт и симптоме сличне као код Паркинсонове болести.[23][55] Сет ензима који имају манганске кофакторе[56] је велик и укључује оксидоредуктазе, трансферазе, хидролазе, лијазе, изомеразе, лигазе, лектине и интегрине. Реверзне транскриптазе многих ретровируса (мада не лентивируса као што је HIV) садрже манган. Најпознатији полипептиди који садрже манган могу да буду аргиназа, дифтерични токсин и супероксид дисмутаза која садржи Mn (Mn-SOD).[57]
Mn-SOD је тип SOD-а присутан у еукариотским митохондријама, а такође и код већине бактерија (ова чињеница је у складу са теоријом бактеријског порекла за митохондрије). Mn-SOD ензим је вероватно један од најдревнијих, за скоро све организме који живе у присуству кисеоника те користе исти за решавање проблема са токсичним ефектима супероксида (O−
2); формира се из редукције диоксигена 1 електроном. Изузеци, који су све бактерије, укључују Lactobacillus plantarum и повезане лактобациле, који користе различит неензиматски механизам с јонима мангана (Mn2+) у комплексу с полифосфатом — што сугерише путању еволуције за ову функцију у аеробном животу.
Људско тело садржи око 12 mg мангана, углавном у костима. Остатак у меком ткиву је концентрисан у јетри и бубрезима.[23] У људском мозгу, манган се веже за манганске металопротеине, при чему је најзначајнија глутаминска синтетаза у астроцитима.[58]
Манган је такође важан у фотосинтетичној еволуцији кисеоника у хлоропластима код биљака. Комплекс еволуције кисеоника (OEC) део је фотосистема II садржаног у тилакоидним мембранама хлоропласти; одговоран је за терминалну фотооксидацију воде током светлосних реакција фотосинтезе, а има металоензимску језгру која садржи четири атома мангана.[59][60] Да би се испунила ова потреба, већина биљних ђубрива из широког спектра садржи манган.
Дијететске препоруке
| М | Ж | ||
|---|---|---|---|
| Доб | AI (mg/дан) | Доб | AI (mg/дан) |
| 1—3 | 1,2 | 1—3 | 1,2 |
| 4—8 | 1,5 | 4—8 | 1,5 |
| 9—13 | 1,9 | 9—13 | 1,6 |
| 14—18 | 2,2 | 14—18 | 1,6 |
| 19+ | 2,3 | 19+ | 1,8 |
| труд.: 2 | |||
| лакт.: 2,6 | |||
Амерички институт за Медицину (IoM) ажурирао је процењене просечне потребе (енгл. Estimated Average Requirements, EARs) и препоручене дијетарне количине (енгл. Recommended Dietary Allowances, RDAs) за минерале 2001. године. За манган није било довољно информација да би се одредили EARs и RDAs, тако да су потребе описане као процене за адекватни унос (енгл. Adequate Intakes, AIs). Због сигурности, IOM одређује толерантне нивое максималног уноса (енгл. Tolerable upper intake levels, ULs) за витамине и минерале када постоји довољно доказа. У случају мангана, UL за одрасле је одређен на 11 mg/дан. Колективно, EARs, RDAs, AIs и ULs називају се дијетарним референтним уносима (енгл. Dietary Reference Intakes, DRIs).[61] Дефицијенција мангана је ретка.[62]
Европски ауторитет за сигурност хране (EFSA) односи се на колективни сет информација као дијетарне референтне вредности (енгл. Dietary Reference Values), са популационим референтним уносом (енгл. Population Reference Intake, PRI) уместо RDA, те просечним потребама (енгл. Average Requirement) уместо EAR. AI и UL дефинисани су исто као и у САД. За људе доби 15 или више година AI је одређен на 3,0 mg/дан. AI за трудноћу и лактацију је 3,0 mg/дан. За децу доби 1—14 година AI се повећава годиштем од 0,5 до 2,0 mg/дан. AI за одрасле су виши него амерички RDAs.[63] EFSA је ревидирала исто сигурносно питање и одлучила да није било довољно информација да се одреди UL.[64]
За америчке намене означавања хране и дијета количина за оброк се изражава као проценат дневне вредности (енгл. Daily Value, %DV). За намене означавања мангана 100% од дневне вредности је било 2,0 mg, али 27. маја 2016. ревидирано је на 2,3 mg да би се усагласили са RDA.[65] Табела за старе и нове дневне вредности за одрасле је дата у чланку en:Reference Daily Intake. Компаније које производе храну и суплементе имале су времена до 1. јануара 2020. да се усагласе с променама.[66]
Предострожност
| Опасности | |
|---|---|
| ГХС пиктограми | нема |
| ГХС сигналне речи | нема |
ГХС извештаји опасности | H401 |
ГХС изјаве предрострожност | P273, P501[67] |
| NFPA 704 | |
Једињења мангана су мање токсична од оних других широко раширених метала, као што су никл и бакар.[68] Међутим, излагање мангановим прашинама и парама не би требало да пређе највишу вредност од 5 mg/m3, чак ни на кратке периоде — због нивоа токсичности истог.[69] Манган представља посебан ризик за децу због своје склоности да се веже за CH-7 рецепторе. Тровање манганом се повезује са оштећеним моторичким вештинама и когнитивним поремећајима.[70]
Перманганат показује већу токсичност од једињења мангана(II). Фатална доза је око 10 g, а неколико фаталних тровања се и десило. Јак оксидативни ефекат води до некрозе мукозне мембране. На пример, езофагус је погођен ако се перманганат прогута. Само ограничена количина се апсорбује у цревима, али ова мала количина показује озбиљне ефекте на бубреге и на јетру.[71][72]
Излагање мангану у Сједињеним Америчким Државама регулише Окупациона сигурносна и здравствена администрација (енгл. Occupational Safety and Health Administration, OSHA).[73] Људи могу да буду изложени мангану на радном месту удишући га или га гутајући. OSHA је поставила правни лимит (енгл. permissible exposure limit — „дозвољени ниво излагања”) за излагање мангану на радном месту — и то као 5 mg/m3 током радног дана од 8 часова. Национални институт за окупациону сигурност и здравље (енгл. National Institute for Occupational Safety and Health, NIOSH) поставио је препоручени лимит излагања (енгл. recommended exposure limit, REL) од 1 mg/m3 током радног дана од 8 сати те краткорочни лимит од 3 mg/m3.
На нивоима од 500 mg/m3, манган је моментално опасан за живот и здравље (IDLH).[74]
Генерално, излагање ваздушним концентрацијама Mn у околини преко 5 μg Mn/m3 може да доведе до симптома узрокованих манганом. Повећана експресија протеина феропортина код ћелија људског ембрионичног бубрега (HEK293) повезује се са смањеном интрацелуларном концентрацијом Mn и ослабљеном цитотоксичношћу, што карактерише укидање Mn-редукованог глутаматног уноса и смањено цурење лактат дехидрогеназе.[75]
Питања заштите животне средине
Манган у пијаћој води
Водени манган има већу биодоступност него дијетарни манган. Према резултатима студије из 2010,[76] виши нивои излагања мангану у пијаћој води повезују се с повећаном интелектуалном поремећеношћу и смањеним коефицијентом интелигенције код деце школског узраста. Претпостављало се односно постојала је хипотеза да дугорочно излагање мангану који се јавља природно у води под тушем ставља на ризик и до 8,7 милиона Американаца.[77][78] Међутим, подаци индицирају да се људско тело може опоравити од одређених адверзних ефеката прекомерног излагања мангану ако се излагање заустави и тело може да се очисти од вишка.[79]
Манган у бензину

Метилциклопентадијенил манган трикарбонил (MMT) јесте бензински адитив који се користи да замени оловна једињења за безоловне бензине да би се побољшао октански рејтинг нискооктанских дестилата петролеума. Смањује агенс куцкања мотора преко деловања карбонилних група. Горива која садрже манган имају тенденцију да формирају манган карбиде, који оштећују испушне вентиле. Потреба за оловом или додавањем мангана је само историјска пошто савремени процеси реформације стварају горива са повећаним нивоом октана. Таква горива, директно или у смеши са нереформисаним дестилатима, универзална су у развијеним земљама (САД, Јапан, ЕУ и сл.). У САД, императив да се пружи најнижа цена по запремини моторних горива и најнижа пореска стопа — у комбинацији са лабавом легислацијом садржаја горива пре године 2000, потакла је рафинерије да користе MMT. При поређењу са 1953, нивои мангана у ваздуху су пали.[80] На многим аутомобилским тркама једињења мангана су специфично забрањена у гориву аутомобила, као и картинг аутомобила и др. MMT садржи 24,4—25,2 % мангана. Повишене атмосферске концентрације мангана су јако повезане са густином аутомобилског саобраћаја. Ниво мангана који емитују MMT горива сигуран је за општу популацију и рањиве групе као што су новорођенчад и старе особе (ово су потврдиле агенције EPA, EEA, CEA и др.).
Манган у дувану
Биљка дувана (лат. Nicotiana) спремно апсорбује и акумулира тешке метале као што је манган из околне земље у своје листове. Исти се потом удишу током пушења дувана.[81] Док је манган конституент дуванског дима,[82] студијама је засигурно закључено да концентрације нису опасне по људско здравље (нису директно животно угрожавајуће).[83]
Улога у неуролошким поремећајима
Манганизам
Превелико излагање мангану се најчешће повезује с манганизмом, ретким неуролошким поремећајем који је у вези с вишком уноса мангана или инхалације. Историјски, особе запослене у производњи или процесуирању легура мангана[84][85] биле су изложене ризику развијања манганизма; међутим, тренутне здравствене и сигурносне регулације штите раднике у развијеним земљама.[73] Поремећај је први пут описао 1837. године британски академик Џон Купер, који је проучавао двојицу пацијената који су млели манган.[20]
Манганизам је бифазан поремећај. У својим раним стадијумима, отрована особа може да искуси депресију, нагле промене расположења, компулзивна понашања и психозе. Рани неуролошки симптоми отварају пут за развијени манганизам, који је налик на Паркинсонову болест. Симптоми укључују слабост, монотон и успорен говор, безизражајно лице, тремор, ход с нагнутошћу напред, немогућност ходања уназад без падања, ригидност и опште проблеме са декстеритетом, ходом и балансом.[20][86] За разлику од Паркинсонове болести, манганизам се не повезује с губитком осећаја мириса и пацијенти су обично нереспонзивни на лечење са [[L-DOPA|L-DOPA-ом.[87] Симптоми манганизма у узнапредовалом стадијуму постају још озбиљнији временом чак иако је извор излагања уклоњен а нивои мангана у мозгу се вратили на нормалу.[86]
Хронично излагање мангану је показано да производи болест налик паркинсонизму, који карактеришу абнормалности покрета.[88] Ово стање није респонзивно на типичне терапије које се користе током третирања ПБ, што сугерише на алтернативну путању у односу на типичне допаминергичне губитке унутар супстанције нигра.[88] Манган може да се акумулира у базалним ганглијама, водећи до абнормалних покрета.[89] Мутација гена SLC30A10, манганског ефлуксног транспортера неопходног за смањивање интрацелуларног Mn, повезано је с развојем ове болести која подсећа на паркинсонизам.[90] Левијева тела типична за ПБ не могу да се виде код паркинсонизма индукованог манганом.[89]
Експерименти на животињама дали су могућност да се испитају последице прекомерног излагања мангану под контролисаним условима. Код (неагресивних) пацова, манган узрокује међуубилачко понашање мишева.[91]
Развојни поремећаји у детињству
Неколико скорашњих студија покушава да испита ефекте хроничне нискодозне преизложености мангану током развоја детета. Најранија студија је проведена у кинеској провинцији Шанси. Пијаћа вода тамо била је контаминирана услед неисправног канализационог одвода и садржала је 240—350 µg Mn/L. Иако су се концентрације Mn на или испод 300 µg Mn/L сматрале сигурним у време студије од стране америчке EPA-е а 400 µg Mn/L од стране WHO-а, 92 узорковане деце (између 11 и 13 година старости) из ове провинције показало је нижи перформанс на тестовима мануелне декстерности и рапидности, краткорочне меморије и визуелне идентификације — при успоредби са децом из неконтаминираног подручја. Још скорије, студија 10-годишњака из Бангладеша показала је однос између концентрације Mn у води из бунара и умањеног IQ резултата. Трећа студија проведена у Квебеку испитивала је школску децу доби од 6 до 15 година која су живела у домовима који су добијали воду из бунара са садржајем мангана 610 µg Mn/L воде; контролни субјекти су живели у домовима где је долазила вода из бунара са 160 µg Mn/L. Деца у експерименталној групи су показала повећану хиперактивност и опозиционо понашање.[76]
Тренутна максимална сигурна концентрација по правилима које одређује EPA је 50 µg Mn/L.[92]
Неуродегенеративне болести
Протеин под називом DMT1 је главни транспортер у апсорпцији мангана из црева, а може да буде главни транспортер мангана преко крвно-мождане баријере. DMT1 такође транспортује инхалирани манган преко назалног епитела. Предложени механизам за токсичност мангана је да дерегулација води до оксидативног стреса, митохондријалне дисфункције, глутаматно посредоване ексцитоксичности и агрегације протеина.[93]
Види још
- Бели лук#Хемијски састав
- Манганска нодула, формација на морском дну
- Мангански експортер, протеин мембранског транспорта
- Паркеризација (фосфатизација), метод заштите површине челика
- Списак светске производње#Хемијски елементи
- Трећа аналитичка група катјона
- Челик#Манган (Mn)
Референце
Литература
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- Рајић, Снежана (2011). Неорганска хемија. Завод за уџбенике, Београд. ISBN 978-86-17-17630-1.
- Тодоровић, Тамара; Медаковић, Весна (2013). Практикум из неорганске хемије у редакцији проф. др Софије Совиљ. Универзитет у Београду — Хемијски факултет. ISBN 978-86-7220-051-5.
- Jiménez, Sánchez; et al. (2004). Development of a Standardised Method for Measuring Manganese Exposure (PDF). Institute of Occupational Medicine. Архивирано из оригинала (Research Report TM/10/04) 24. 4. 2017. г. Приступљено 16. 5. 2017.
/Ова студија упоређује концентрације инхалабилног и респирабилног мангана сакупљеног из три ваздушна узорка: CIS (Conical Inhalable Sampler), IOM (Institute of Occupational Medicine) и HDC (Higgins Dewell Cyclone)./
Спољашње везе
 Медији везани за чланак Манган на Викимедијиној остави
Медији везани за чланак Манган на Викимедијиној остави
- NPI — чињенице о мангану и једињењима (језик: енглески)
- IMI — Интернационални мангански институт (језик: енглески)
- NIOSH — тематска страница о мангану (језик: енглески)
- Манган на сајту periodicvideos.com (језик: енглески)




